转谷氨酰胺酶改性大豆分离蛋白的溶解性研究
张志衡,王升楠,卢亚东,李玉娥,陈振家
(山西农业大学食品科学与工程学院,山西太谷 030801)
大豆不仅是一种优良的油料作物,更是一种理想的食用蛋白质资源,随着社会的进步与经济的发展,人们越来越强的健康意识促进了大豆相关食品市场的活跃,其中大豆分离蛋白(SPI)是大豆蛋白产品中极为重要的产品之一,大豆分离蛋白作为优质的植物蛋白质,蛋白浓度极高,营养成分均衡,富含人体必需的氨基酸,在机体内的消化利用率高,适当地添加可提高食品的蛋白功效比值。大豆分离蛋白亦具有良好的溶解性、起泡性、乳化性等功能特性,这些特性在食品加工中起着决定性作用[1]。因而对SPI 的深入研究至关重要。
由于当前SPI 在食品加工中某些功能特性的兼容性较差,且很难同时兼具多种功能,而生产上需求的却是专项最佳功能或兼具几种功能平衡的产品。因此,需对其进行改性处理。转谷氨酰胺酶(简称TG)是一种催化转酰基酶,它能催化蛋白质中赖氨酸上的ε-氨基与谷氨酸上γ-羟酰胺基之间发生联合反应,聚合蛋白多肽形成共价聚合物。而TG 酶交联能改变SPI 的溶解性、凝胶特性、疏水性等性质,利用TG 酶交联改性大豆分离蛋白,使SPI 的空间结构和功能特性得以改变,能够满足人们的生产要求[2]。如改性后蛋白产物中小分子肽组分含量高,比氨基酸蛋白质更易于被人体消化吸收;改性后的大豆蛋白具有更高的应用价值,可以拓宽SPI 在食品工业中作为配料应用的范围。国内外很多学者对TG 酶交联改性SPI 的功能特性已有一定的研究,但温度、pH、盐离子浓度对改性SPI 溶解性影响的研究却寥寥无几,再者,溶解性作为食品的主要功能特性,具有很重要的研究价值。本研究以脱脂豆粕为原料制备SPI 和MSPI,研究它们分别在不同温度、pH 和盐离子浓度下改性前后大豆分离蛋白的溶解性,并使用SDS-PAGE 电泳技术对改性后的大豆分离蛋白组分进行了亚基分析,探究改性前后大豆分离蛋白聚集特性的变化,旨在为改性大豆分离蛋白在食品中的应用提供一定的参考。
1 材料和方法
1.1 材料
1.1.1 试验材料与试剂 大豆脱脂豆粕(购于金源粮油工业有限责任公司,蛋白质>51%);转谷氨酰胺酶、NaCl、考马斯亮蓝G-250、牛血清蛋白、无水乙醇、巯基乙醇、丙烯酰胺、甲双叉丙烯酰胺、SDS、溴酚蓝、过硫酸铵、低分子量Marker(14.4~97.4 ku)、四甲基乙二胺、Tris(分析纯)。
1.1.2 试验仪器 DYY-7C 型电泳仪(北京市六一仪器厂);可见分光光度计(上海菁华科技有限仪器公司);HH 系列数显恒温水浴锅、磁力加热搅拌器(金坛市科析仪器有限公司);HC-2064 高速离心机、大容量低速离心机(安徽中科中佳科学仪器有限公司);高剪切分散机(德国IKA 公司);精密增力电动搅拌器(常州国华电器有限公司)。
1.2 试验方法
试验于2019 年12 月在山西农业大学食品科学与工程学院粮油实验室进行。
1.2.1 大豆分离蛋白样品的制备 将脱脂豆粕与水按1∶10(m∶V)比例混合,调pH 值至8.5,搅拌2 h 后纱布过滤,过滤液4 000 r/min 离心20 min,上清液调pH 值至4.5,静置15 min 后离心,水洗沉淀2 次;沉淀加水复溶至pH 值7.0 后,冷冻干燥后备用。
1.2.2 TG 酶改性大豆分离蛋白样品的制备 将脱脂豆粕与水按1∶10(m∶V)比例混合,调pH 值至8.5,搅拌2 h 后纱布过滤,过滤液4 000 r/min 离心20 min,上清液调pH 值至4.5,静置15 min 后离心,水洗沉淀2 次;沉淀加水复溶至pH 值7.0 后,加入0.5%(m酶∶m溶液)TG 酶,50 ℃水浴反应2 h,之后沸水浴5 min 灭酶。调pH 值至4.5,离心,弃上清液,沉淀水洗2 次,复溶至中性,冷冻干燥后备用。
1.2.3 溶解性单因素试验 将蛋白样品分散于蒸馏水中配制质量浓度为1%的溶液,在一定的温度下用恒温磁力搅拌器搅拌30 min,调整pH 值,称取一定质量的NaCl,并搅拌10 min 至溶解,取1 mL样品离心(10 000 r,10 min),适当稀释一定倍数,取100 μL 样品与5 mL 考马斯亮蓝溶液混合[3],用分光光度计在595 nm 下测定可溶性蛋白质的含量。温度分别设为50、60、70、80、90、100 ℃共6 个水平,pH 值分别设为2、3、4、4.5、5、6、7、8、9、10、11、12 共12 个水平,盐离子浓度分别设为0、0.01、0.05、0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0 mol/L 共13 个水平。
1.2.4 大豆分离蛋白组分SDS-PAGE 电泳 溶解度测定完成后,分别取上述不同处理蛋白样品中的上清液和底部沉淀制备电泳样品,上清液和沉淀的添加量不超过1 mg/mL(m蛋白:m电泳液),本试验要分析二硫键的变化规律,因此,需添加2%β 巯基乙醇作还原处理进行对比。SDS -PAGE 电泳采用LAEMMLI[4]的方法,制得的分离胶浓度为12%,浓缩胶浓度为5%,上样量5 μL,恒压电泳,电流为40 mA,浓缩胶电压为100 V,分离胶电压为150 V。电泳完毕,固定3 h 并染色,染色2.5 h 后脱色,然后用扫描仪进行扫描,并分析图谱。
1.3 数据分析
采用Microsoft Excel 2019 对数据进行分析,采用Orign 8.0 软件进行制图。
2 结果与分析
2.1 不同温度下MSPI 和SPI 溶解性的比较

由图1 可知,经TG 酶改性后的MSPI 溶解性明显下降。改性前后SPI 的溶解性在50~70 ℃内均增大,在70~100 ℃内随温度升高而下降。有研究表明[5],蛋白质进行适当的热处理会出现离解和开链现象,增强了水合能力,溶解度增大。但是当温度达到70 ℃以上时,肽链结构发生变化,大量疏水性基团暴露在蛋白质表面并且蛋白质分子间互相缠绕,促进了蛋白质分子的聚集和沉淀,导致蛋白质溶解度下降,因此,在70 ℃时蛋白含量达到峰值。同时,因为在大豆分离蛋白交联过程中分子间或分子内发生共价交联,使小分子物质聚集成大分子物质,形成了以G-L 键连接的更加稳定的蛋白质网络结构,不易与水结合,因此,MSPI 的溶解性较SPI 低。
2.2 不同pH 值梯度下MSPI 和SPI 溶解性的比较

由图2 可知,在不同pH 条件下的MSPI 的溶解性明显低于SPI。SPI 和MSPI 曲线虽均呈先下降后上升趋势,但MSPI 的溶解性对pH 的敏感度较SPI 低。2<pH<4.5 时,溶解性均逐渐下降;4.5<pH<12 时,溶解性均逐渐上升,在等电点(pH 值4.5)附近时,SPI 和MSPI 的溶解性最差,究其原因是,蛋白质在等电点附近时,溶液正负电荷达到平衡,蛋白质分子间的排斥力很小,更容易形成大的不溶性聚集体,因此,溶解度最低;当远离等电点时,平衡被打破,在较酸或较碱环境下,蛋白质溶液带正电荷或负电荷,蛋白质分子间的排斥力增大,体系分散性越好,则溶解性越好。MSPI 溶解性明显低于SPI,原因是经过TG 酶改性后,大豆蛋白分子内或分子间形成了以共价键(G-L 键)连接的共聚物,使其蛋白质网络结构更加稳定,这与张海均[6]等的研究结果一致。
2.3 不同盐离子浓度下MSPI 和SPI 溶解性的比较
由图3 可知,在不同盐离子浓度下MSPI 的溶解性明显低于SPI;MSPI 和SPI 的溶解性随盐离子浓度的变化趋势相似,均呈先升高后降低的趋势,在盐离子浓度为0.05 mol/L 时,SPI 和MSPI 的溶解性最大。盐离子浓度大于0.05 mol/L 后,MSPI 和SPI 的溶解性逐渐降低,究其原因是,随着盐离子浓度的增加,盐离子大量中和蛋白质颗粒上的电荷,降低了蛋白分子间排斥力,从而使蛋白质颗粒更容易聚集形成沉淀析出,即盐析效应[7-8]。

2.4 不同温度下MSPI 上清与沉淀的电泳图谱

从图4 可以看出,在非还原电泳图谱中,MSPI上清液中的亚基主要分布在相对分子质量14.4~97.4 ku 之间,在此区间的亚基条带颜色随温度升高越来越浅,这与MSPI 在不同温度下溶解度的变化趋势相符。在还原电泳图谱中,上清液中的亚基主要分布在14.4~97.4 ku和大于97.4 ku,各泳道浓缩胶消失,AB-11S 亚基完全消失,说明这些亚基是通过二硫键连接形成的;各亚基条带的颜色随温度的升高逐渐加深,推测是由于AB-11S 亚基的断裂形成了这些新的亚基。
在非还原电泳图谱中,MSPI 沉淀中的亚基主要分布在66.2~97.4 ku和大于97.4 ku的区间。各泳道的浓缩胶和14.4~97.4 ku的亚基条带颜色随温度的增加逐渐变浅。在14.4~22、31~43 ku的亚基条带颜色非常浅。在还原电泳图谱中,大于97.4 ku的亚基条带颜色变浅,各泳道的浓缩胶消失,AB-11S亚基完全消失;各泳道亚基条带颜色随温度升高逐渐变浅,这对应了上清中的亚基变化规律;在31~43、14.4~22 ku的亚基颜色明显变深,推测是AB-11S 亚基断裂形成了这些新的亚基[9]。
2.5 不同pH 下MSPI 上清与沉淀电泳图谱
由图5 可知,3、4、5 泳道的亚基条带颜色很浅,说明在此区间蛋白溶解度很低,这与MSPI 在等电点附近的溶解性一致。在非还原电泳图谱中,MSPI上清中的蛋白亚基主要分布在43~97.4 ku和大于97.4 ku的区间。MSPI 的亚基条带对于pH 变化较为敏感,pH 值为3 时颜色较浅,pH 值2、11、12 时亚基条带颜色较深,pH 值在6~10 时,亚基条带的颜色随pH 值的升高逐渐加深。在还原电泳图谱中,相对分子质量在66.2~97.4 ku及大于97.4 ku的亚基条带颜色明显变浅,在14.4 及31 ku附近的亚基消失,在52~68 ku的AB-11S 亚基消失,说明这些亚基主要是通过二硫键形成;在31~43 ku的A-11S亚基和14.4~22 ku的B-11S 亚基颜色加深,推测是由于AB-11S 亚基断裂形成,这与DING 等[10]研究结果相符。
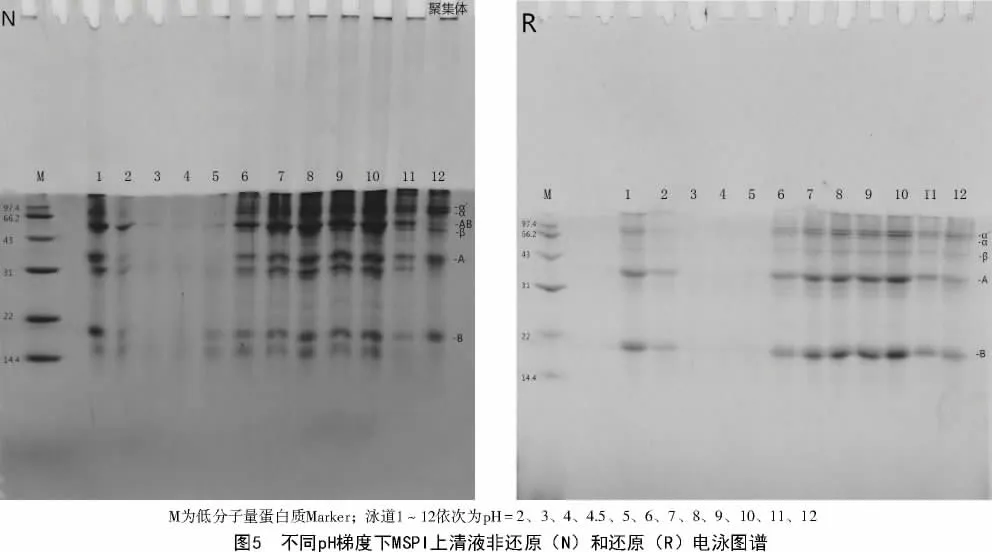
从图6 可以看出,无论是在非还原还是还原条件下,3、4、5 三条泳道的颜色最深,说明等电点附近沉淀中的蛋白含量最高,对应了图5 上清中蛋白溶解度,再次印证了等电点附近溶解度变化规律。在非还原电泳图谱中,MSPI 沉淀的亚基主要分布在43~97.4 ku,pH 值为3 时亚基条带颜色最浅,pH 值4 时颜色最深,pH 值在4~10 时,各亚基条带颜色随pH 增加越来越浅;与图5 相比,A-11S 亚基和B-11S 亚基的颜色在图5 中较深,在图6 中较浅,说明A-11S 亚基和B-11S 亚基主要存在于上清中,为可溶性单体。在还原电泳图谱中,AB-11S亚基和大于97.4 ku的亚基颜色明显变浅,说明这些亚基主要是通过二硫键连接形成;同样,pH 值在4~10 的亚基条带随pH 增加颜色逐渐变浅,在14.4~22 ku出现新的亚基,这可能是11S 蛋白亚基断裂形成的,与部分学者得出的结果一致[11]。

2.6 不同盐离子浓度下MSPI 上清和沉淀的电泳图谱
从图7 可以看出,在非还原电泳图谱中,MSPI的上清蛋白亚基主要分布在43~97.4 ku。随着盐离子浓度的增加,条带颜色逐渐变浅,说明随着盐离子浓度的增加,MSPI 的溶解度逐渐降低,这与图3 中MSPI 的溶解性变化曲线相符;不同盐离子浓度条件下,上清液中的蛋白亚基种类没有发生改变,说明盐离子浓度的变化不会改变MSPI 上清中的亚基分布。在还原电泳图谱中,各泳道浓缩胶消失,相对分子质量大于97.4 ku及43~97.4 ku的亚基除了α′和α亚基外颜色均变浅,AB-11S 亚基完全消失,说明这些亚基主要是由二硫键形成的;在31~43、14.4~22 ku的亚基颜色变深,在14.4 ku 附近出现新的亚基条带,推测是由于AB-11S 亚基断裂形成的,且随着盐离子浓度的增加,各浓度亚基条带的颜色基本一致。

从图8 可以看出,在非还原电泳图谱中,盐离子浓度为0.6 mol/L 时亚基条带颜色最浅,其余泳道的亚基条带颜色基本保持一致。对比图7 发现,在66.2~97.4 ku和大于97.4 ku的亚基在图8 中颜色加深,说明这些亚基主要是以不溶性聚集体的形式存在。在还原电泳图谱中,各泳道浓缩胶消失,AB-11S 亚基完全消失,大于97.4 ku的亚基条带颜色变浅,说明这些亚基主要是由二硫键连接形成的。在66.2~97.4、31~43、14.4~22 ku的亚基颜色明显变深,14.4 ku附近出现新的亚基,推测是AB-11S亚基断裂形成了这些新的亚基。同样是在盐离子浓度为0.6 mol/L 时,条带颜色最浅,其余泳道的条带颜色基本保持一致,整体比未加入β 巯基乙醇时的颜色更深。

3 结论与讨论
大豆分离蛋白经TG 酶交联后形成了以G-L键连接的更加稳定的蛋白质网络结构,因此,在不同温度、pH、盐离子浓度下,MSPI 的溶解性均低于SPI,在食品行业中可以用以改善因蛋白质溶解酸败而出现的食品问题,具有重要的研究价值。随着温度的升高,MSPI 的溶解度呈先上升后下降的趋势,在70 ℃时溶解度最高,80~100 ℃溶解度变化不大。MSPI 的溶解度随pH 值的增加呈先下降后上升的趋势且明显低于SPI,在pH 值4.5 即等电点时溶解度最低。MSPI 的溶解度在盐离子浓度大于0.05 mol/L时有着小幅度上升,后随盐离子浓度的升高而下降。本试验结果与大多数学者的研究结果相似,不足之处在于试验方法单一,还有待进一步研究。
从非还原状态下的MSPI 电泳图谱中可以明显看出,有6 条亚基:α′、α、β、AB、A、B 亚基。相对分子质量在14.4~22 ku 的B-11S 亚基在不同温度下主要是以可溶性粒子形式存在于上清液中;MSPI在等电点附近时主要以沉淀形式存在;盐离子浓度的增加不会改变MSPI 溶液中的亚基分布。在加入β 巯基乙醇后,AB-11S 亚基的二硫键断裂,生成其他新的亚基。本试验结果与部分学者的研究结果相似,不足之处在于试验存在一定的误差,可通过多次试验对试验结果进行检验来改善。

