8-异戊烯基柑橘素促进体外骨髓基质干细胞成骨性分化的研究
明磊国,陈克明,葛宝丰,马慧萍,翟远坤
8-异戊烯基柑橘素是存在于啤酒花中的一种黄酮类化合物,Milligan等[1-3]报道,该化合物具有植物雌激素样作用,可以用作雌激素替代品。而雌激素已广泛应用于抗骨质疏松替代疗法,疗效已得到临床和实验研究证实。本文通过研究8-异戊烯基柑橘素对体外培养骨髓间充质干细胞成骨分化的影响,初步探讨其是否具有促进骨形成活性及作用机制。
1 材料与方法
1.1 材料 120 g左右Wistar♂大鼠12只(甘肃中医学院实验动物中心提供,合格证号:SCXK(甘)2004-0006-152;8-异戊烯基柑橘素(Enzo,385-025-M005,USA);DMEM-12培养基(Gibco公司);胎牛血清(兰州民海生物工程公司);噻唑兰(MTT)、胰蛋白酶、Ⅱ型胶原酶、α-萘基磷酸钠、地塞米松、β-甘油磷酸钠、磷酸化抗坏血酸(Sigma公司);骨钙素ELLSA检测试剂盒(ids,UK);钙盐沉积量检测试剂盒(BioVision,USA);RNAiso Reagent、反转录试剂盒、Taq DNA聚合酶、Easy Dilution稀释液均由大连TaKaRa公司提供;引物由大连TaKaRa公司设计合成。
1.2 大鼠骨髓基质干细胞培养 将大鼠用乙醚麻醉并用体积分数75%乙醇浸泡消毒,超净工作台中剥离出股骨和胫骨,剪去两端骨骺并向骨髓腔内注入DMEM/F12培养液(含肝素钠500 kU·L-1),完全冲出骨髓,吹散细胞得单细胞悬液;用150目的滤网过滤并计数,调整细胞浓度为1.0×108mol·L-1,以每孔100 μl接种于 96 孔培养板、1.5 ml接种于6孔板或1 ml接种于12孔板(Nunc),培养液中含体积分数为10%的胎牛血清。在37℃、5%CO2、湿度饱和条件下培养48 h,弃培养液,用0.1 mol·L-1PBS洗涤两遍并更换新培养液。以后每72 h更换培养液1次,待细胞融合率达到80%以上时,进行成骨性诱导。
1.3 8-异戊烯基柑橘素最佳浓度的筛选 原代细胞接种于96孔板中,待BMSCs长满80%孔底时换成骨性诱导培养基(DMEM/F12、1×10-7mmol·L-1地塞米松、10 mmol·L-1β-甘油磷酸钠和 50 mg·L-1抗坏血酸),同时加入 1 ×10-7、1 ×10-6、1 ×10-3、1 ×10-4mol·L-1的 8-异戊烯基柑橘素,对照组只加入8-异戊烯基柑橘素的载体溶液(1 μl DMSO/ml培养液),每组平行做8孔。每72 h后更换培养液1次,于诱导培养的d 8进行ALP活性比较。采用南京建成生物工程研究所生产的ALP试剂盒,96孔板中每孔加入缓冲液和基质液各25 μl,37℃水浴15 min,每孔加入显色液75 μl,充分混匀后在酶标仪上测定490 nm处的吸光度(OD)值。
1.4 细胞增殖分析 P1代细胞以3×107cells·L-1接种于96孔板中,每孔100 μl。24 h后依次加入8-异戊烯基柑橘素,使终浓度分别为1×10-7、1×10-6、1 ×10-5mol·L-1浓度的 1 ml·L-1,对照组加入不含8-异戊烯基柑橘素的载体溶液(DMSO)1 ml·L-1,每组平行做8孔。48 h和72 h后弃培养液,PBS洗 2次;换含有 0.5%MTT的无血清DMEM/F12,继续培养4 h。弃培养液,每孔加入100 μl DMSO,振荡溶解10 min完全溶解后,酶标仪上测定570 nm处的吸光度(OD)值。
1.5 成骨性分化分析 将原代培养细胞分为两组进行成骨性诱导培养,培养基内含体积分数为10%FBS的 DMEM/F12、1 ×10-7mmol·L-1地塞米松、10 mmol·L-1β-甘油磷酸钠和 50 mg·L-1抗坏血酸。一组加入不同浓度的8-异戊烯基柑橘素,作为实验组,另一组仅加入等体积的8-异戊烯基柑橘素载体溶液(DMSO)作为对照。常规72 h更换培养液1次,进行如下指标分析。
1.5.1 不同时间点ALP活性测定 P0代细胞以5×108cells·L-1接种于 24 孔板,每孔加 0.5 ml,培养3 d待细胞铺满孔底后更换诱导培养基,实验组培养液中8-异戊烯基柑橘素的浓度为1×10-6mol·L-1,与对照组同时培养的 d 4、8、12、16 分别进行ALP活性测定,24孔板中每孔加入缓冲液和基质液各0.2 ml,37℃水浴15 min,每孔加入显色液0.6 ml,充分混匀后于紫外分光光度计上测定507 nm处的吸光度(OD)值。用酚标准作标准并将检测值换算为每15 min每毫克蛋白反应所产生的酚。
1.5.2 ALP组织化学染色 成骨性诱导培养16 d后弃培养液,PBS洗两次,加10%的福尔马林固定2 min,随即进行ALP组织化学染色。具体方法为:将α-萘基磷酸钠和固蓝RR各25 mg溶于pH 8.9的巴比妥-盐酸缓冲液25 ml中,摇匀后每孔1 ml加入12孔板各孔中,待出现阳性结果后,停止染色,照像记录,Image-Pro Plus 6.0扫描计数并计算阳性克隆的面积。
1.5.3 骨钙素分泌量测定 分别收集成骨性诱导后0~4 d、4~8 d、8~12 d、12~16 d细胞更换培养液时的旧培养液1 ml,-20℃保存;ELLSA法测定,标准曲线制备及样品测定方法按说明书操作;于酶标仪上450 nm处测定OD值,并通过标准曲线计算样品中骨钙素含量。
1.5.4 钙盐沉积量测定 在皿中分别于成骨性诱导培养d 4、8、12、16进行钙含量测定。具体方法:弃培养液,PBS洗两次,加1 mol·L-1的HCl每皿2 ml,吹起贴壁细胞并超声波破碎,在摇床上摇动过夜后1 000 r·min-1离心10 min并收集上清液;标准曲线制备及样品的测定方法按说明书操作;与酶标仪上570 nm处测定OD值,并通过标准曲线计算每皿样品中钙盐沉积量。
1.5.5 茜素红组织化学染色 成骨性诱导培养d 16,进行茜素红染色,具体方法如下:弃培养液,PBS洗2次,加入pH 8.9、0.1%的茜素红染色液,每皿3 ml,37℃水浴1 h,显微镜下观察结果、照相并记录,Image-Pro Plus 6.0扫描计数并计算阳性克隆的面积。
1.5.6 RT-Real Time PCR分析 成骨性诱导前12 h实验组加入终浓度为1×10-6mol·L-1的8-异戊烯基柑橘素,对照组加入等体积的8-异戊烯基柑橘素载体溶液。分别在成骨性诱导培养0、6、12、24、48、72 h,提取总 RNA,检测 bFGF、IGF-1、Osterix、Runx-2、BMP-2及COL-Ⅰ的mRNA表达水平。所用引物均委托宝生物(大连)公司根据Genbank所发布的序列设计并合成(Tab 1),总RNA的提取采用TRIzol一步法进行,紫外分光光度计检测浓度,并用1%甲醛变性琼脂糖电泳检测其完整性。调整总RNA 的浓度至50 mg·L-1,取 2 μl将其逆转录为cDNA。逆转录体系、PCR扩增体系及反应条件均参照说明书设定。以标本中所提取的高浓度、高纯度RNA逆转录后得到的cDNA作为标准品,经等比稀释后,进行PCR反应制备标准曲线。经内参校正,求得目的基因的相对表达水平。
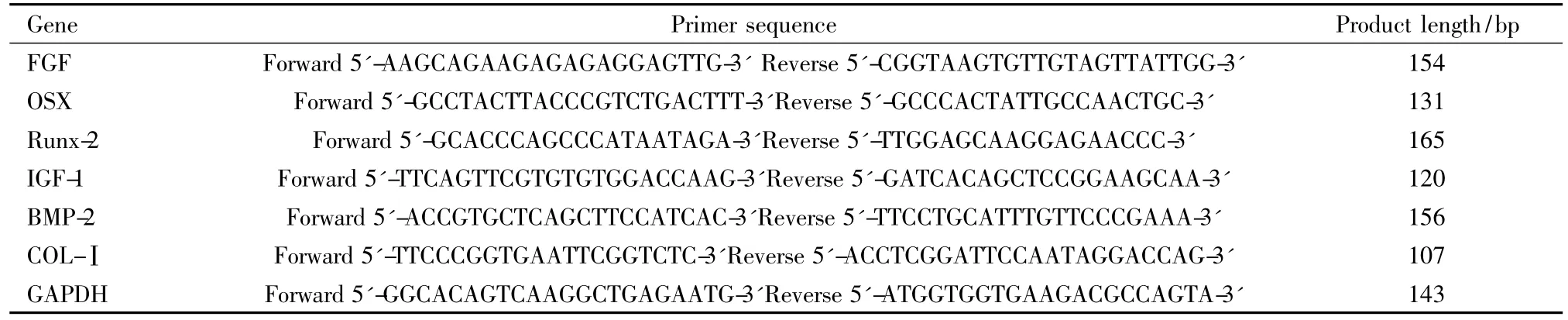
Tab 1 The primer sequence of RT-Real Time PCR
2 结果
2.1 细胞形态学观察 全骨髓培养法培养的细胞,BMSCs贴壁而血细胞及单核细胞不贴壁,两天后BMSCs开始克隆,随着更换培养液液次数的增加,不贴壁细胞逐渐被洗去;Fig 1A是BMSCs培养3 d首次更换培养液后形态,细胞以长梭形为主;Fig 1B是BMSCs培养6 d第2次更换培养液形态,细胞开始大量克隆;Fig 1C是BMSCs药物干预并成骨诱导6 d后,细胞分化并融合,铺满皿底的形态;Fig 1D是BMSCs药物干预并成骨诱导12 d后,细胞成骨分化成熟并沉积骨基质,形成钙化结节。
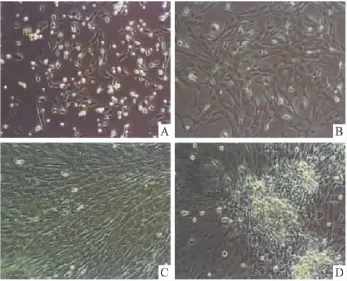
Fig 1 A:BMSCs were cultured 3 days;B:BMSCs were cultured 6 days;C:BMSCs were cultured 6 days in inducing medium;D:BMSCs were cultured 12 days in inducing medium
2.2 不同浓度8-异戊烯基柑橘素对 BMSCs的ALP活性影响 实验组与对照组之间采用方差分析法进行数据分析。ALP是成骨性分化的标志性酶,在490 nm的OD值越高,表明ALP活性越强,则成骨性分化愈强;由Tab 2可知,不同浓度梯度的8-异戊烯基柑橘素干预BMSCs后,结合细胞形态学观察发现1×10-4mol·L-1对细胞有较大的损害,其余3组均有促进ALP活性的功能,其中1×10-6mol·L-1组明显高于对照组、1×10-7mol·L-1和1×10-5mol·L-1组,差异有统计学意义。表明终浓度为1×10-6mol·L-1的8-异戊烯基柑橘素对BMSCs作用效果最明显。
2.3 对BMSCs增殖的影响 数据统计采用单因素方差分析,两组间差异有统计学意义(P<0.05)。如Tab 3所示,培养液中8-异戊烯基柑橘素浓度为1×10-5、1 ×10-6、1 × 10-7mol·L-1时,OD 值低于对照组,说明3种浓度均不促进细胞增殖。
Tab 2Effect of 8-Prenylnaringenin on ALP activity(±s,n=6)
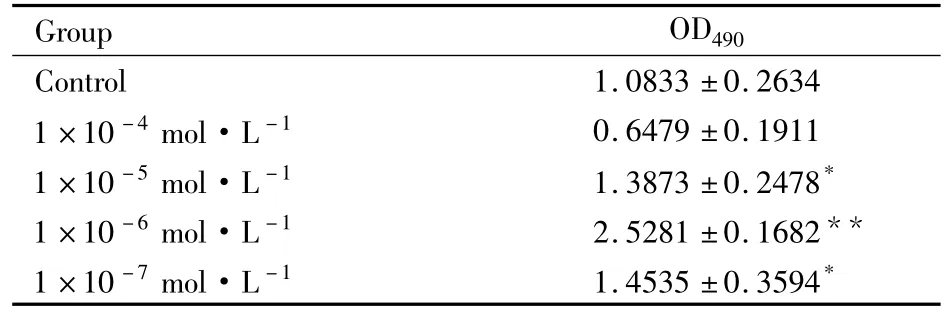
Tab 2Effect of 8-Prenylnaringenin on ALP activity(±s,n=6)
*P <0.05,**P <0.01 vs control
Group OD490 Control 1.0833±0.2634 1×10-4mol·L-1 0.6479±0.1911 1×10-5mol·L-1 1.3873±0.2478*1×10-6mol·L-1 2.5281±0.1682**1×10-7mol·L-1 1.4535±0.3594*
Tab 3 Effect of 8-Prenylnaringenin on BMSCs proliferation(±s,n=6)
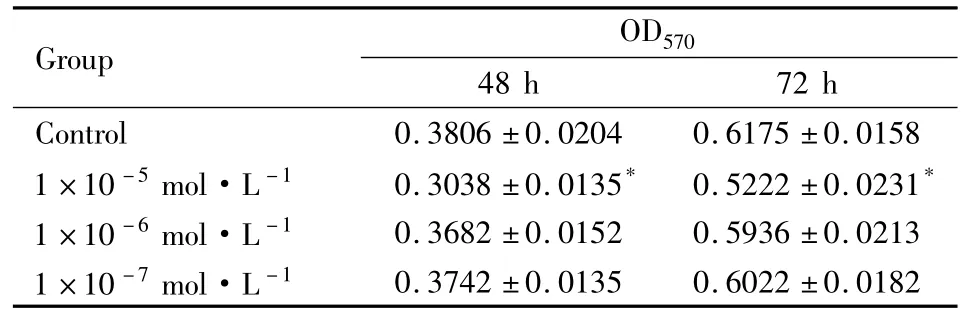
Tab 3 Effect of 8-Prenylnaringenin on BMSCs proliferation(±s,n=6)
*P<0.05 vs control
Group OD570 48 h 72 h Control 0.3806±0.0204 0.6175±0.0158 1×10-5mol·L-1 0.3038±0.0135* 0.5222±0.0231*1×10-6mol·L-1 0.3682±0.0152 0.5936±0.0213 1 ×10-7mol·L-10.3742±0.0135 0.6022±0.0182
2.4 对BMSCs成骨性分化的影响
2.4.1 对BMSCs的ALP活性影响 由Fig 2可见,成骨性诱导4 d开始8-异戊烯基柑橘素组在各时间点的ALP活性均高于对照组;d 8~12 ALP活性上升最快,在d 12~16 ALP增加幅度较小,说明8-异戊烯基柑橘素刺激ALP增加主要集中在d 8~12。d 12和d 16分别是对照组的1.72和1.68倍;各时间点与对照组相比差异有统计学意义。
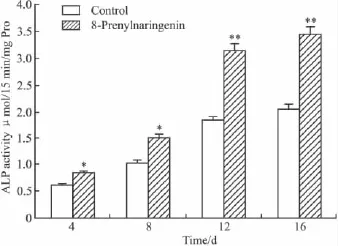
Fig 2 Comparison of the ALP activity in BMSCs between experiment group and control(n=4)ALP activity in experiment group was stronger than that in control group,especially on 12th and 16th day. *P <0.05,**P <0.01 vs control.
2.4.2 ALP组织化学染色结果 成骨性诱导d 16的ALP组化染色结果(Fig 5a)表明,8-异戊烯基柑橘素组ALP阳性克隆子数目及克隆子所占皿底的表面积明显高于对照组,差异有统计学意义(Tab 4)。
Tab 4Effect of 8-Prenylnaringenin on cell CFU-ALP(±s,n=4)

Tab 4Effect of 8-Prenylnaringenin on cell CFU-ALP(±s,n=4)
*P <0.05,**P <0.01 vs control
Group Number of CFU Total area of CFU(mm2/dish Control 164±3.68 41.5194±2.427 8-Prenylnaringenin 210±4.25* 80.5156±2.884)**
2.4.3 对BMSCs分泌骨钙素的影响 由Fig 3可知,BMSCs成骨性诱导后,8-异戊烯基柑橘素组骨钙素含量均高于对照组,特别是d 4~8骨钙素分泌最活跃,是对照组的2.14倍,说明BMSCs的成骨性分化最强烈,d 12~16有所下降,但仍高于对照组,且差异有统计学意义。
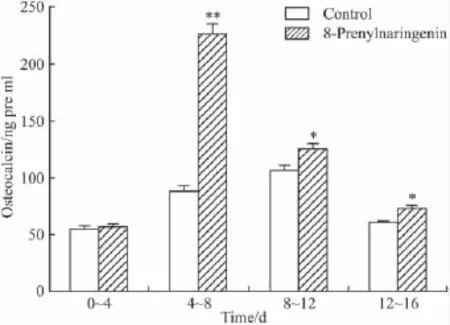
Fig 3 Comparison of the osteocalcin secretion in BMSCs between experiment group and control(n=4)Experiment group was stronger than control group at anytime,especially on 4~12 days.*P <0.05,**P <0.01 vs control
2.4.4 对BMSCs钙盐沉积量的影响 由Fig 4可知,诱导前4~6 d后开始矿化并沉积钙盐,随时间增长钙盐含量逐渐上升,尤其是d 8~16沉积量明显增强,d 16达到最高,d 12和d 16分别是对照组的2.82和2.21倍。8-异戊烯基柑橘素实验组从d 8开始高于对照组,且差异有统计学意义。
2.4.5 对形成钙化结节的影响 d 16的茜素红组化染色结果表明,钙化结节染色结果呈阳性(Fig 5b),8-异戊烯基柑橘素实验组的钙化结节数目及其所占皿底的表面积高于对照组,差异有统计学意义(Tab 5)。
2.4.6 对基因表达的影响 bFGF、IGF-1、OSX、Runx-2、BMP-2、COL-Ⅰ、GAPDH 的溶解曲线均只见一个特异性峰,表明引物的特异性好。各基因的扩增曲线都呈“S”型,说明扩增效率较高。每个样本平行做3组(n=3),数据统计分析采用重复测量的方差分析法处理,各基因相对表达量分析结果如下:
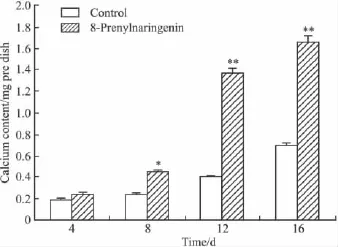
Fig 4 Comparison of the calcium salt sediment yield in BMSCs between experiment group and control(n=4)Experiment group was stronger than control group at anytime,especially on 12th and 16th day.*P<0.05,**P<0.01 vs control
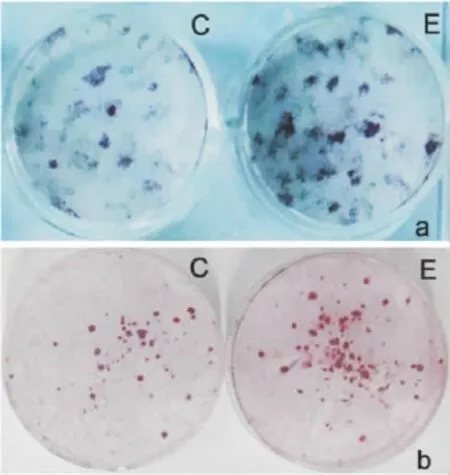
Fig 5 Comparison of the CFU-ALP(Fig 5a)and CFU-Ca(Fig 5b)area in BMSCsThere was obviously more CFU-ALP and CFU-Ca in 8-Prenylnaringenin group than in control.C represented control group,E represented 8-Prenylnaringenin group
Tab 5 Effect of 8-Prenylnaringenin on cell CFU-Ca ± s,n=4)

Tab 5 Effect of 8-Prenylnaringenin on cell CFU-Ca ± s,n=4)
*P <0.05,**P <0.01 vs control
Group Number of CFU Total area of CFU/mm2/dish Control 58±2.25 38.3894±2.168 8-Prenylnaringenin 122±3.55** 167.8951±3.747**
2.4.6.1 bFGF 该基因表达在诱导后4 h达到最高值,此后表达量有下降趋势,但在不同时间点实验组表达量均高于对照组,差异有统计学意义(Tab 6)。
2.4.6.2 IGF-Ⅰ 该基因表达随着培养时间的增加而增大,48 h达到最大值;在测定的不同时间点,8异戊烯基柑橘素均明显提高IGF-ⅠmRNA的水平,且在未诱导条件下也能促进该因子的表达,与对照组相比,差异有统计学意义(Tab 7)。
2.4.6.3 OSX 对照组OSX的表达在诱导4 h时达到较高值;实验组在诱导后持续升高,到12 h达到最高值,随时间的延长均有所下降。实验组各时间点均高于对照组,差异有统计学意义(Tab 8)。
2.4.6.4 Runx-2 该基因表达量在诱导后0~12 h逐步上升,12 h达到最大值,之后开始下降,实验组与对照组基因表达量的变化一致。实验组在各时间点的表达量均高于对照组,差异有统计学意义(Tab 9)。
2.4.6.5 BMP-2 该基因表达量在诱导后持续上升,0 h时的表达量实验组与对照组之间无统计学意义,其余各时间点实验组均高于对照组,差异具有统计学意义。说明8-异戊烯基柑橘素对BMSCs的BMP-2影响,主要在诱导条件下发挥作用(Tab 10)。
2.4.6.6 COL-Ⅰ 8-异戊烯基柑橘素干预后该基因表达量高于对照组,差异具有统计学意义。表达量的变化趋势与对照组一致,诱导后4 h达到峰值,诱导0 h时实验组已明显高于对照组,说明在不存在诱导剂的条件下,它也能够上调COL-Ⅰ的表达,诱导条件下同样发挥促进作用(Tab 11)。

Tab 6 Effect of 8-Prenylnaringenin on mRNA bFGF expression

Tab 7 Effect of 8-Prenylnaringenin on mRNA IGF-Ⅰexpression

Tab 8 Effect of 8-Prenylnaringenin on OSX mRNA expression

Tab 9 Effect of 8-Prenylnaringenin on Runx-2 mRNA expression

Tab 10 Effect of 8-Prenylnaringenin on BMP-2 mRNA expression

Tab 11 Effect of 8-Prenylnaringenin on COL-ⅠmRNA expression
3 讨论
成骨细胞和破骨细胞的功能平衡是骨质疏松发生的机制核心,在研究或筛选抗骨质疏松药物时也以对这两种细胞的影响为主要依据或评价标准。然而随着对BMSCs研究的深入,其在骨质疏松发生中可能发挥的重要作用日益引起人们的高度重视。在骨发生和新骨形成过程中,BMSCs是成骨细胞的重要来源,在机体成骨活动中的作用极其重要,如果其分化成骨的机制发生障碍就会导致成骨细胞数量不足或功能降低,从而导致骨形成水平降低。同时会引起骨密度下降,骨量丢失,骨折率升高等骨质疏松症状。相反,如果能够诱导促进其向成骨细胞方向分化,则有望防治骨质疏松。因此,当认识到BMSCs的重要作用以后,在研究发病机制或进行新药研究时就必须考虑药物对BMSCs的作用和影响[9]。
Christoffel等[4]的研究发现8-异戊烯基柑橘素能够抑制骨质疏松模型大鼠的骨密度下降;Stephan等[5]比较研究了8-异戊烯基柑橘素、6-异戊烯基柑橘素和6,8-异戊烯基柑橘素的抗骨质疏松活性,发现8-异戊烯基柑橘素的活性最强;本实验以BMSCs作为研究对象,首先以ALP为筛选指标筛选确定了8-异戊烯基柑橘素的有效浓度范围,同时对细胞的增殖作用做了研究,发现其无促进细胞增殖作用。通过比较分析成骨性分化的多项指标发现,1×10-6mol·L-1的8-异戊烯基柑橘素能强烈促进 BMSCs的成骨性分化,表现为可诱导提高成骨细胞标志酶ALP的活性并增加ALP阳性克隆数、提高骨钙素分泌量、增加钙盐沉积量和钙化结节数。除此之外,8-异戊烯基柑橘素也明显提高了成骨相关因子bFGF、IGF-1、BMP-2和成骨相关转录因子Osterix和Runx-2,以及骨基质蛋白COL-Ⅰ的基因表达量,差异有统计学意义。实验结果表明,8-异戊烯基柑橘素具有促进BMSCs成骨性分化的活性,可能是其抗骨质疏松的重要机制。同时在试验中观察到,在不进行BMSCs成骨性诱导,只用8-异戊柑橘素干预BMSCs时,8-异戊柑橘素有抑制BMSCs成脂肪细胞分化促进成骨性分化的作用,但具体的量化指标及基因调控过程需要进一步实验论证。
在前期研究中陈克明[6-8]和笔者[9-11]等研究发现淫羊藿苷和蛇床子素对骨髓间充质干细胞和成骨细胞的分化成熟有明显促进作用,值得注意的是淫羊藿苷和蛇床子素的8位碳上也带有异戊烯基,说明此基团与上述化合物的抗骨质疏松活性密切相关,此基团的准确定位将是下一步研究重点。本实验说明了8-异戊烯基柑橘素对BMSCs具有促进成骨性分化作用,但其对其它成骨性相关细胞的影响、作用机制及分子结构与功能相关性等尚待进一步研究。
[1]Pepper M S,Hazel S J,Michael M,et al.8-Prenylnaringenin,a novel phytoestrogen,inhibits angiogenesis in vitro and in vivo[J].J Cell Physiol,2004,199(1):98-107.
[2]Milligan S,Kalita J,Pocock V,et al.Oestrogenic activity of the hop phyto-oestrogen,8-prenylnaringenin[J].Reproduction,2002,123:235-42.
[3]Martina B,Julie C,Wolfgang W.Effects of long-term treatment with 8-prenylnaringenin and oral estradiol on the GH-IGF-1 axis and lipid metabolism in rats[J].J Endocrinol,2008,198:395-401.
[4]Christoffel J,Rimoldi G,Wuttke W.Effects of 8-prenylnaringenin on the hypothalamo-pituitary-uterine axis in rats after 3-month treatment[J].J Endocrinol,2006,188:397-405.
[5]Stephan S,Frauke H,Julie C,et al.Comparison of the phytohormones genistein,resveratrol and 8-Prenylnaringenin as agents for preventing osteoporosis[J].Planta Med,2008,74:794-801.
[6]Chen K M,Ge B F,Ma H P,et al.The serum of rats administered flavonoid extract from Epimedium sagittatum but not the extract itself enhances the development of rat calvarial osteoblast-like cells in vitro[J].Pharmazie,2004,59:61-4.
[7]Chen K M,Ge B F,Ma H P,et al.Inhibitory effect of total flavonoid extract of Epimedium sagittatum on rat osteoorosis induced by ovarietomy[J].Chin J Clin Rehab,2004,8(26):5681-3.
[8]Chen K M,Ge B F,Ma H P,et al.Icariin,a flavonoid from the herb Epimedium enhances the osteogenic differentiation of rat primary bone marrow stromal cells[J].Pharmazie,2005,60(12):939-42.
[9]明磊国,王鸣刚,陈克明,等.淫羊藿苷对体外培养人骨髓基质干细胞增殖与成骨性分化的影响[J].中国骨质疏松杂志,2010,16(2):100-4.
[9]Ming L G,Wang M G,Chen K M,et al.Effects of icariin on human bone marrow stromal stem cells differentiate and proliferate in vitro[J].Chin J Osteoporos,2010,16(2):100-4.
[10]明磊国,葛宝丰,陈克明,等.蛇床子素对体外培养骨髓基质干细胞增殖与成骨性分化的影响[J].中国药理学通报,2010,26(8):1098-103.
[10]Ming L G,Ge B F,Chen K M,et al.Effects of osthol on bone marrow stromal stem cell differentiation and proliferation in vitro[J].Chin Pharmacol Bull,2010,26(8),1098-103.
[11]明磊国,葛宝丰,陈克明,等.蛇床子素对体外培养成骨细胞增殖与成骨性分化的影响[J].中国骨伤,2010,9(23):42-5.
[11]Ming L G,Ge B F,Chen K M,et al.Effect of Osthol on the proliferation and differentiate of osteoblasts in vitro[J].China J Orthopaed Traumatol,2010,9(23):42-5.

