叶酸受体及二氢叶酸还原酶与人乳腺癌细胞MCF-7/ADR多药耐药的关系
黄 瀚,李 兵,欧阳林旗2,,李佐军,刘世坤2,
乳腺癌是危害妇女健康的主要恶性肿瘤,复发率和转移率高,化疗可改善乳腺癌治疗效果和提高生存率,但肿瘤细胞产生的多药耐药常使化疗效果不佳并最终导致化疗失败。叶酸受体(folate receptor,FOLR)可介导细胞外叶酸进入细胞内,有研究[1]发现乳腺癌细胞膜上FOLRα表达增加,而利用反义寡核苷酸抑制乳腺癌细胞MDA-MB/435的FOLRα表达后,该细胞对阿霉素(adriamycin,ADR)的敏感性增加了5倍[2];二氢叶酸还原酶(dihydrofolate reductase,DHFR)基因是FOLRα的下游基因,高海德等[3]观察到双突变 DHFR基因(酶活性增高)对大剂量氨甲喋呤(methotrexate,MTX)化疗小鼠骨髓细胞具有保护作用。本实验旨在探讨FOLRα及其下游基因DHFR的表达与乳腺癌细胞多药耐药的关系,并验证DHFR抑制剂甲氨蝶啶能否逆转耐药细胞系MCF-7/ADR的多药耐药(multidrug resistance,MDR),为临床乳腺癌化疗方案设计提供新的思路。
1 材料与方法
1.1 主要试剂及仪器 人乳腺癌阿霉素敏感细胞系MCF-7和耐药细胞系MCF-7/ADR购自北京大学肿瘤医院;阿霉素(江苏恒瑞医药股份有限公司),甲氨蝶啶(四川正安医药有限公司);MTT(Sigma公司),DMSO(Amresco公司),胎牛血清(杭州四季清生物有限公司),RPMI 1640培养液(Hyclone公司);RNA提取剂TRIzol、逆转录试剂盒、PCR试剂盒(Fermentas公司);免疫组化试剂盒及鼠抗人P-gp一抗(福建迈新生物技术公司),FOLRα一抗(Santa Cruz Biotechnology);美国 ABI 2720型 PCR仪;德国Eppendorf公司高速低温离心机;德国Eppendorf生物分光光度仪。
1.2 方法
1.2.1 细胞培养 两株细胞均用含体积分数为10%胎牛血清的 RPMI 1640培养液于37℃、5%CO2饱和湿度培养箱中培养。MCF-7/ADR细胞株培养过程中加入1 μmol·L-1的ADR用以维持其耐药性。定期在倒置显微镜下观察细胞形态与生长状况。收集细胞并计数,绘制细胞生长曲线。
1.2.2 MTT法测定ADR的细胞毒性[4]取对数生长期细胞用0.25%胰酶消化调整MCF-7和MCF-7/ADR 细胞浓度为1×108·L-1,每孔 100 μl接种于96孔板中,每细胞株设10个浓度梯度,分别为128、64、32、16、8、4、2、1、0.5、0.25 μmol·L-1,每个浓度梯度设4个复孔,同时设阴性对照组(在含细胞的培养孔内加等量培养液)和调零组(不接种细胞,仅加等量培养液),于37℃、5%CO2饱和湿度培养箱中培养24 h。加入不同浓度ADR,继续培养48 h,每孔加入 5.0 g·L-1的 MTT 溶液 20 μl,培养 4 h,吸除上清液,每孔加入 DMSO 150 μl,振荡器震荡10 min,490 nm波长处用酶标仪测定每孔吸光度值(OD),计算ADR对细胞的抑制率,并由此计算IC50及耐药倍数,实验重复3次。抑制率(IR/%)=[1-(试验组OD值/对照组OD值)]×100%,孙氏法求半数抑制浓度(IC50),耐药倍数=MCF-7/ADR细胞IC50/MCF-7细胞IC50。
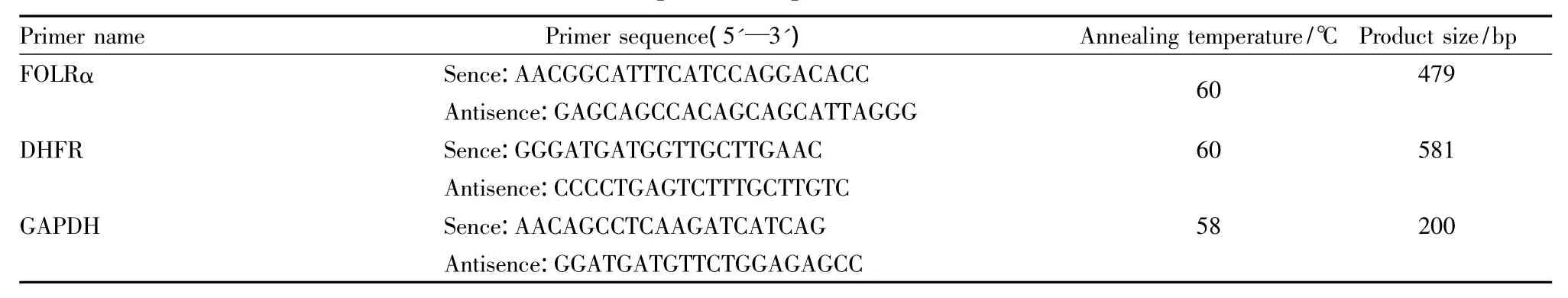
Tab 1 Primer sequences and product size in real time PCR
1.2.3 RT-PCR检测细胞FOLRα、DHFR mRNA的转录水平 用TRIzol试剂按照说明书提取细胞内总RNA,1.0%琼脂糖凝胶电泳鉴定,紫外分光光度计检测RNA的浓度和纯度。用RevertAidTMFirst-Strand cDNA合成试剂盒逆转录成cDNA。逆转录合成的cDNA进行PCR扩增,引物用Primer3在线设计(Tab 1)。PCR反应体系为25 μl:PCR Master Mix(2 × )12.5 μl,Nuclear-free Water 10 μl,引物各0.5 μl,cDNA 模板 2 μl。PCR 反应条件:94℃ 预变性 2.5 min,94℃变性 40 s,60℃退火 40 s,72℃延伸40 s,共进行 35个循环,最后 72℃延伸 10 min。1.5%琼脂糖凝胶电泳,凝胶成像系统紫外照相扫描分析。以GAPDH基因为内参基因进行半定量分析(Tab 1)。
1.2.4 免疫细胞化学测定细胞FOLRα、P-gp的表达水平 MCF-7及 MCF-7/ADR细胞以5×107·L-1爬片,接种后待细胞密度为70%左右,用体积分数为4%多聚甲醛4℃固定30 min,室温下山羊血清封闭液封闭20 min,除去封闭液,一抗4℃反应过夜。一抗分别为抗FOLRα、抗p-gp(均为1∶100稀释)的兔多克隆抗体。4℃冰箱过夜,二抗37℃培养30 min,DAB显色,苏木精对比染色,盐酸乙醇风化,中性树胶封固。每步均用pH=7.4,0.01 mol·L-1PBS冲洗3~4次,每次3~5 min。结果判定:细胞膜或胞质着黄棕色颗粒为阳性细胞。结果采用Ver 3.00程序软件分析,每张爬片随机选取5个视野,测定阳性面积占视野面积的比例,以各组均值进行比较。
1.2.5 MTT比色法测定甲氨蝶啶对MCF-7/ADR的逆转作用 确定逆转的药物浓度:收集对数生长期MCF-7和MCF-7/ADR的细胞,同上MTT法进行实验,设置二氢叶酸还原酶抑制剂甲氨蝶啶(MTX)浓度分别为 0.5、1、2、4、8、16、32 μmol·L-1计算各浓度对MCF-7细胞和MCF-7/ADR细胞的增殖抑制率,绘制细胞增殖抑制曲线,选取抑制率≤20%的低细胞毒性MTX浓度作为耐药逆转浓度。
耐药逆转倍数的测定:实验设3组:① 空白对照组;② ADR组(ADR浓度同实验方法“1.2.2”);③无毒剂量MTX+ADR(ADR浓度同实验方法“1.2.2”)组,以上过程均重复3次。逆转倍数按以下公式计算:逆转倍数=IC50A/IC50B(其中IC50A为ADR组的IC50值,IC50B为MTX+ADM组的IC50值)。
2 结果
2.1 MCF-7和MCF-7/ADR细胞生长曲线 通过对两细胞株生长增殖曲线(Fig 1)进行比较,敏感细胞MCF-7群体倍增时间为(24.5±2.5)h,耐药细胞MCF-7/ADR群体倍增时间为(30.6±2.7)h,两者比较差异有显著性[5](P <0.05)。
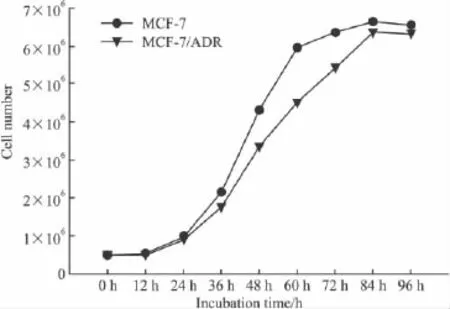
Fig 1 The growth curve of MCF-7 and MCF-7/ADR cells
2.2 MCF-7/ADR对ADR的耐药倍数的测定MTT比色法显示MCF-7/ADR细胞对ADM有较强耐药性,ADM浓度在8 μmol·L-1及以下时细胞生长与对照组比较差异无显著性,其IC50为(35.4±1.82)μmol·L-1;MCF-7细胞对ADM敏感,其IC50为(1.66 ±0.31)μmol·L-1,MCF-7/ADR 对 ADR的耐药倍数约为22.5倍。
2.3 MCF-7和MCF-7/ADR细胞FOLRα、DHFR的mRNA的转录水平 我们分别测定了MCF-7和MCF-7/ADR细胞 FOLRα、DHFR的 mRNA的转录水平(Fig 2),半定量结果(Tab 2)显示MCF-7细胞FOLRα mRNA转录水平较MCF-7/ADR叶酸受体mRNA转录水平高,而MCF-7/ADR细胞DHFR的mRNA的转录水平比MCF-7细胞高。
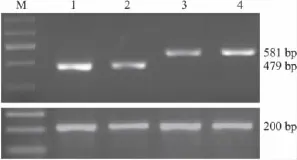
Fig 2 The transcriptional level of MCF-7/S cells and MCF-7/ADR cellsM:Marker;1:MCF-7 FOLRα;2:MCF-7/ADR FOLRα;3:MCF-7 DHFR;4:MCF-7/ADR DHFR
Tab 2 The mRNA expression of FOLRα and DHFR in MCF-7 and MCF-7/ADR cells±s,n=5)
*P<0.05 vs MCF-7
Group FOLRα/GAPDH DHFR/GAPDH MCF-7 0.89±0.13 0.41±0.10 MCF-7/ADR 0.43±0.11* 0.72±0.11*
2.4 FOLRα、P-gp在 MCF-7和 MCF-7/ADR 细胞中的表达 高倍镜下(Fig 3)P-gp主要分布于细胞质上,细胞膜上有少量分布;FOLRα主要分布于细胞膜上,细胞质中也有少量分布。MCF-7和MCF-7/ADR细胞比较(Tab 3),MCF-7/ADR细胞P-gp表达量高于MCF-7细胞,而MCF-7/ADR细胞FOLRα表达量低于MCF-7细胞。
Tab 3 The expression of P-gp and FOLRα in MCF-7 and MCF-7/ADR cells(±s,n=5)
*P<0.05 vs MCF-7
Group P-gp staining area proportion FOLRα staining area proportion MCF-7 cells 0.51±0.11 0.21±0.05 MCF-7/ADR cells 0.19±0.05* 0.12±0.04*
2.5 MTX对MCF-7/ADR细胞的抑制作用 不同浓度MTX作用48 h后,MTX对MCF-7、MCF-7/ADR细胞有抑制作用且成剂量依赖性(Fig 4),经统计学处理,MTX对MCF-7、MCF-7/ADR细胞抑制作用差异无显著性(P>0.1)。
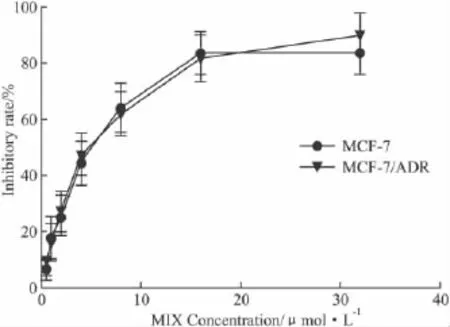
Fig 4 Inhibitory effect curve of MTX on MCF-7 and MCF-7/ADR cells
MTX 浓度为1 μmol·L-1时对 MCF-7/ADR 细胞的增殖抑制率为(16.3±5.1)%,选择浓度为MTX耐药逆转浓度,结果显示对MCF-7/ADR细胞多药耐药有逆转作用,无毒剂量MTX+ADR组IC50时的ADR的浓度为(5.6±2.65)μmol·L-1,ADR组 IC50时的浓度为(34.9 ±2.53)μmol·L-1,逆转倍数为6.3。
3 讨论
肿瘤多药耐药是多种机制共同作用的结果,膜糖蛋白介导的药物外排机制、细胞内解毒物质活性增强、细胞凋亡相关基因表达与突变、肿瘤细胞损伤后自我修复能力增强及其肿瘤干细胞的存在[6]等因素是肿瘤多药耐药重要的机制。本实验与王玲等[4]都证实P-gp表达增强是MCF-7/ADR细胞多药耐药的重要机制。
叶酸受体是一种糖基磷脂酰肌醇(GPI)锚定膜蛋白,可介导细胞外叶酸进入细胞内[7],是目前抗肿瘤治疗研究的重要靶点[8],目前已鉴定出α-FR、β-FR、γ-FR 3种亚型,FR特别是FOLRα在正常细胞中少量表达或不表达,但在许多肿瘤细胞中存在过度表达,如卵巢癌、乳腺癌、肾癌、结直肠癌、肺癌、睾丸癌、室鼓膜瘤和脉络膜瘤等[1,9]。叶酸受体介导细胞外叶酸进入细胞内,它的表达水平与肿瘤进展及细胞增殖相关[10]。本实验RT-PCR及免疫细胞化学结果均证实MCF-7细胞叶酸受体表达水平较MCF-7/ADR细胞高,可能原因与MCF-7细胞增殖速度较MCF-7/ADR细胞快[5],对叶酸的需求量较大有关[10],与耐药的具体关系还有待进一步实验证实。
DHFR可催化FH2转化为FH4,FH4作为体内一碳单位转移载体,参与体内同型半胱氨酸(Hcy)转变为甲硫氨酸过程,参与体内核苷酸(dTMP)合成,与 DNA生物合成及损伤修复相关。MTX是DHFR抑制剂,是临床乳腺癌化疗常用药物之一。实验中我们发现MCF-7/ADR细胞DHFR的mRNA的转录水平比MCF-7细胞高,MTX能逆转MCF-7/ADR细胞的多药耐药,说明DHFR可能参与ADR对细胞DNA损伤的修复作用,与MCF-7/ADR细胞的MDR可能存在相关性;另外我们发现MCF-7/ADR细胞对 MTX敏感[11],其原因可能在于:①ADR诱导细胞MDR与MTX诱导的细胞耐药在机制上存在差别;②有报道MCF-7/ADR细胞与亲代细胞相比较,S期细胞增多,G1期细胞减少[5],而MTX则特异性作用于S期。
总之MCF-7/ADR细胞FOLRα的表达水平下调,与细胞增殖水平有关,其下游基因DHFR表达水平与MCF-7/ADR细胞的MDR可能存在相关性。由于MTX能逆转MCF-7/ADR细胞的多药耐药,因此MTX+ADR组合方案在乳腺癌化疗方案有可行之处。
[1]Evans C O,Reddy P,Brat D J.et al.Differential expression of folate receptor in pituitary adenomas[J].Cancer Res,2003,63(14):4218-24.
[2]Jhaveri M S,Rait A S,Chung K N,et al.Antisense oligonucleotides targeted to the human alpha folate receptor inhibit breast cancer cell growth and sensitize the cells to doxorubicin treatment[J].Mol Cancer Ther,2004,3(12):1505-12.
[3]高海德,路 平,鲁 阳,等.双突变二氢叶酸还原酶基因对小鼠的化疗保护作用[J].中华肿瘤杂志,2006,28(8):583-5.
[3]Gao H D,Lu P,Lu Y,et al.Double-mutant dihydrofolate reductase gene transfection into bone marrow cells protects mice from chemotherapy[J].Chin J Oncol,2006,28(8):583-5.
[4]王 玲,刘世坤,周于禄,等.华蟾素对人乳腺癌细胞阿霉素多药耐药性的逆转作用[J].中国药理学通报,2007,23(5):677-80.
[4]Wang L,Liu S K,Zhou Y L,et al.Reversa l effect of cinobufac ine on adriamycin resistance human breast cancer cells[J].Chin Pharmacol Bull,2007,23(5):677-80.
[5]张小平,陶永辉,陈其亮,等.人乳腺癌细胞MCF-7紫杉醇耐药株的建立及其生物学特性的研究[J].中国药理学通报,2008,24(6):804-9.
[5]Zhang X P,Tao Y H,Chen Q L,et al.Establishment and characteristics of a paclitaxel resistant human mammaryadenocarcinoma cell subline MCF-7/Taxol[J].Chin Pharmacol Bull,2008,24(6):804-9.
[6]李德冠,王小春,孟爱民.肿瘤干细胞靶向研究[J].中国药理学通报,2009,25(6):701-3.
[6]Li D G,Wang X C,Meng A M.Target therapies of cancer stem cell[J].Chin Pharmacol Bull,2009,25(6):701-3.
[7]Sierra E E,Goldman I D.Recent advances in the understanding of the mechanism of membrane transport of folates and antifolates[J].Semin Oncol,1999,26(2):11-23.
[8]Galt J R,Halkar R K,Evans C O,et al.In vivo assay of folate receptors in nonfunctional pituitary adenomas with 99mTc-folate SPECT/CT[J].J Nucl Med,2010,51(11):1716-23.
[9]Evans C O,Young A N,Brown M R,et al.Novel patterns of gene expression in pituitary adenomas identified by complementary deoxyribonucleic acid microarrays and quantitative reverse transcriptionpolymerase chain reaction[J].J Clin Endocrinol Metab,2001,86(7):3097-107.
[10]Figini M,Ferri R,Mezzanzanica D,et al.Reversion of transformed phenotype in ovarian cancer cells by intracellular expression of anti folate receptor antibodies[J].Gene Therapy,2003,10(12):1018-25.
[11]严 婷,张莲芬,张熔熔,等.人乳腺癌多药耐药细胞系MCF-7/MDRa的建立及其生物学特性的初步研究[J].细胞生物学杂志,2006,28(4):591-5.
[11]Yan T,Zhang R RF,Zhang R R,et al.Establishment of multidrugresistant breast cancer cell line MCF-7/MDRa and its preliminary analysis on the biological properties[J].Chin J Cell Biol,2006,28(4):591-5.

