燕麦发芽过程中三大营养素的变化
徐托明,田斌强,孙智达,谢笔钧
华中农业大学食品科技学院,武汉430070
燕麦发芽过程中三大营养素的变化
徐托明,田斌强,孙智达*,谢笔钧
华中农业大学食品科技学院,武汉430070
为了丰富燕麦相关产品、充分利用中国现有稀缺的燕麦资源以及最大限度的挖掘裸燕麦的可利用性,对来自陕西的一个裸燕麦品种进行发芽六天的试验,并分析燕麦籽粒在发芽过程中三大营养素和β-葡聚糖含量的变化得出以下结果:在裸燕麦发芽过程中总氮含量和脂肪含量变化不明显,分别下降了0.2%和0.1%,发芽六天后淀粉含量从原种子的63.04%降至52.8%。但是游离氨基酸、可溶性糖和还原糖含量则增加很明显,β-葡聚糖含量相对于原燕麦种子本身含量来说在发芽过后下降幅度也较大,下降了约3%。这一结果说明燕麦发芽后其营养价值增加,但是基于β-葡聚糖功能特性的利用会有所降低。
燕麦;发芽;脂肪;淀粉;β-葡聚糖
近年来燕麦被证实因其含有丰富的可溶性膳食纤维、均衡的蛋白质以及丰富的维生素和必须脂肪酸而有益人体健康备受人们的关注和喜爱。1997年,美国食品和药品管理局认定燕麦水溶性膳食纤维可以减少心血管疾病的发生,允许燕麦食品无需批报,就可以进行功效宜传[1]。燕麦食品已成为发达国家近年来消费增长量最快的谷物食品。燕麦是一种兼备食疗功能的作物,其中裸燕麦是世界上目前种植面积最大的一个燕麦品种,已经有很多的相关文献报道表明裸燕麦是很多哺乳动物和非哺乳动物的优良食物来源[3]。裸燕麦中蛋白质,脂肪,矿物质元素总量及不饱和脂肪酸含量均居谷物之首,特别是属于水溶性膳食纤维的β-葡聚糖在所有谷物中含量最高(2.5%~8.8%),是小麦的4.7倍,玉米的7.7倍[9]。β-葡聚糖的功能特性主要表现在:可增加小肠内容物的黏度,直接阻碍胆固醇向肠壁黏膜细胞的扩散,以及胆汁与胆固醇的乳化作用,较大程度地干扰了膳食胆固醇的吸收,降低了胆固醇的吸收率;也能有效地抑制胆汁酸在肠道内的重吸收,促进粪便胆汁酸的排泄,阻断胆汁酸肝肠循环,因而促使更多的肝脏胆固醇向胆汁酸转化,最终降低了血清胆固醇水平[7]。故选择裸燕麦为研究对象且对其进行发芽试验,研究其中三大营养素及具有功能特性的β-葡聚糖含量变化。
1 材料和方法
1.1 试验材料
燕麦种子由山西省农科院高寒作物研究所提供,该种子品种为晋燕八号裸燕麦。原料处理:先将燕麦种子用2%的次氯酸钠于室温下浸泡15 min进行表面杀菌处理,然后用蒸馏水清洗残余的次氯酸钠溶液2~3次,接着用蒸馏水浸渍于18℃的生化培养箱(无光照)中浸泡16 h,将浸泡后的燕麦种子用蒸馏水清洗沥干后置于自制的发芽盘中于18℃培养箱(无光照)中连续发芽144 h,培养箱保持湿度在95%以上。浸泡和发芽的燕麦种子每隔24 h取一次样品。将所取得样品置于40℃恒温鼓风干燥箱中干燥48 h(原种子也进行相同的处理)。将干燥的燕麦种子去处根和芽后于干燥封闭条件下存放以待后续试验。
1.2 主要仪器和试剂
755B分光光度计,水浴锅,鼓风干燥箱,分析天平,高速离心机。
淀粉糖苷酶(sigma试剂公司)、β-葡聚糖酶(sigma试剂公司),其他试剂皆为分析纯试剂。
1.3 主要方法
1.3.1 总氮采用微量凯氏定氮法测定[6]。
1.3.2 总脂肪采用索氏抽提仪(Soxtee system HT6,Teeator,Hoganas,Sweden),以乙醚为抽提液测定样品粗脂肪含量。
1.3.3 可溶性β-葡聚糖含量的测定AOAC995.16
燕麦鼓或干燥样品80~120 mg→4 mL,20 mM,pH 6.5磷酸钠缓冲液→0.2 mL,10 U β-葡聚糖酶→50℃,水浴30 min→分别取0.1 mL三个等分样液,一个空白和两个测定→分别加入等体积的醋酸缓冲液(空白)和R一葡萄糖昔酶(样品)→50℃水浴l0 min→加入3.0 mL葡萄糖氧化酶一过氧化物酶缓冲液3 mL→50℃水浴20 min→510 nm比色[9]。
1.3.4 淀粉含量的变化
精确称取50 mg样品在室温下经激烈震动30 min均匀分散于6 mL 3 mol/L KOH溶液中,不得有淀粉包生成,在此悬浮液中加入3 mL 0.4 mol/L的醋酸钠缓冲溶液,混合后的液体用2 mol/L的HCL或0.5 mol/L的NaOH调节pH为4.75并加入25 μL(300 u)的淀粉糖苷酶,将混合液在震荡恒温水浴(120 r/mim,55℃)震荡45 min。用DNS(3,5-二硝基水杨酸)法测定葡萄糖含量,以不加淀粉样的溶液为空白。
1.3.4 游离氨基酸含量的测定
准确称取不同发芽天数且粉碎后的燕麦粉末0.2~0.5 g于离心管中,加入10 mL 10%的乙酸充分振荡,重复提取三次,收集上清液于100 mL容量瓶中并定容。游离氨基酸含量的测定采用茚三酮显色法测定[6]。
1.3.5 可溶性糖的测定
准确称取燕麦粉碎后的粉末100~200 mg于离心管中,加入10 mL蒸馏水,塑料薄膜封口后于沸水浴中提取30 min(提取三次),离心,上清液并入25 mL容量瓶中待测。用蒽酮比色法测定提取液中可溶性糖的含量[6]。
1.3.6 还原糖含量的测定
准确称取0.5 g燕麦粉碎后的粉末于离心管中,加入一定量的蒸馏水并充分混匀,置于50℃水浴中浸提20 min,离心,收集上清液并定容至25 mL。用3,5-硝基水杨酸测定其含量[6]。
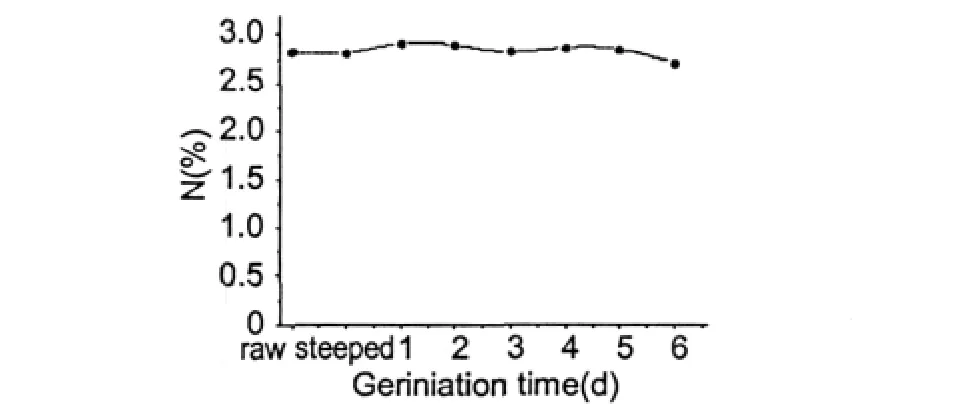
图1 发芽过程中总氮含量的变化Fig.1 Changes of total N content during oat germination
2 结果与分析
2.1 总氮含量的变化
由图1总氮变化趋势可看出燕麦籽粒在发芽过程中总氮含量变化不明显:原燕麦籽粒含氮量为2.73%,发芽六天后其含氮量变为2.54%,仅仅降低了0.19%。燕麦籽粒在发芽过程中总氮含量略微有所升高很可能是由于种子萌发进行的呼吸作用导致干物质损失而造成的。这一试验结果与David M.Peterson研究中的裸燕麦品种MF913-148相似,略有不同的是总氮含量比MF913-148稍低[2]。
2.2 粗脂肪含量的变化
从图2看出脂肪在燕麦籽粒发芽过程中变化趋势不是很明显,但是在发芽四天时达到了最大值(7.25%),且从发芽三天到四天的过程中燕麦籽粒脂肪含量变化最大:由6.79%增加至7.25%。而在整个发芽过程中燕麦籽粒的脂肪含量并没有多大的变化(原燕麦籽粒脂肪含量:6.82%,发芽6 d后其脂肪含量:6.74%),这一试验结果与 David M.Peterson研究中的燕麦品种88Ab3073在发芽过程中的脂肪含量变化的趋势相同[2]。出现这一现象的可能原因是燕麦种子发芽三天后萌发迅速(本试验过程中观察到的现象),因而燕麦籽粒中的相关酶系的酶活力也会相应地增大,其中脂肪酶的活力增加就会导致燕麦籽粒中原来与其他大分子物质相结合(或包裹)的甘油三酯被降解(释放)为游离的脂肪酸和甘油从而使脂肪含量得到明显的增加。发芽四天后燕麦籽粒脂肪含量反而降低一方面可能是随着萌发时间的增加其中的脂肪为迅速萌发的根和芽提供物质需求,另一方面则可能是燕麦种子迅速萌发所进行的呼吸作用增强,增加了脂肪的消耗。
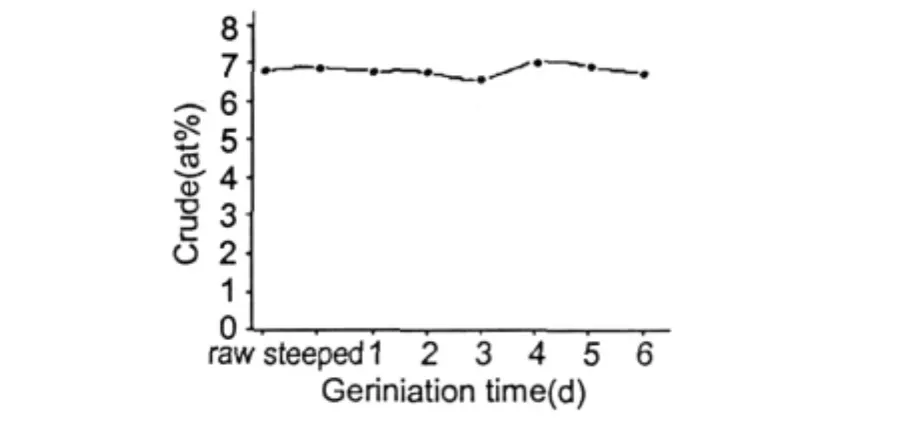
图2 发芽过程中脂肪含量的变化Fig.2 Changes of crude fat during oat germination
2.3 淀粉含量的变化
淀粉是燕麦籽粒中主要的贮藏物质,约占谷物干重的60%。由图3可知燕麦种子在发芽后淀粉含量降低了约10%,原燕麦籽粒和发芽6 d后的淀粉含量分别为63.04%、52.8%。尽管在谷物发芽过程中有淀粉酶的合成,但与其他谷物相比燕麦种子中的淀粉在发芽过程中降解却非常有限[4]。
在燕麦种子发芽前两天淀粉含量呈上升趋势,并在第二天达到最大值,之后的四天里淀粉含量逐天降低,在第六天时含量低至52.8%。这一现象的可能原因是燕麦籽粒浸渍后淀粉颗粒吸水溶胀,同时淀粉酶被激活或者开始合成,使其由原来的结合态逐渐变为游离态从而使淀粉含量有所增加。但是当燕麦籽粒发芽两天后由于种子迅速萌发的需要淀粉酶降解淀粉的速度加快而导致淀粉含量逐天降低。这一试验结果与David M.Peterson研究结果略有不同,在David M.Peterson研究中几个燕麦品种的淀粉含量在发芽过程中平均下降幅度约为5%[2]。
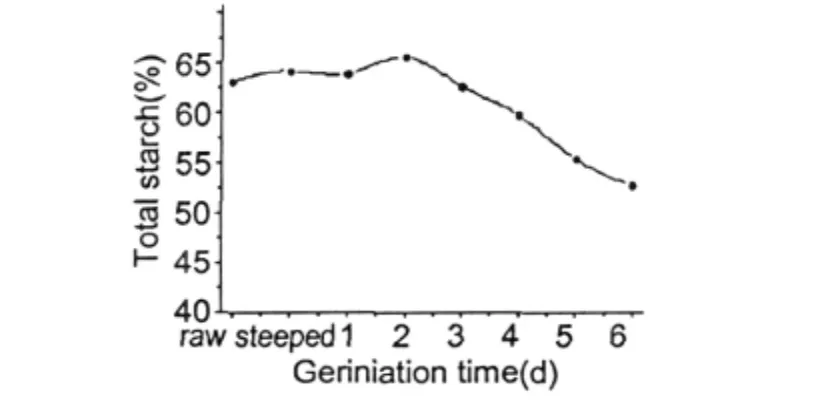
图3 发芽过程中淀粉含量的变化Fig.3 Changes of total starch content during oat germination
2.4 游离氨基酸总量的变化
从图4可以看出燕麦种子在萌发过程中总的游离氨基酸呈升高趋势,且含量增加相当明显,经过六天的发芽其游离总氨基酸含量从原种子的139.93 mg/kg增加到1582.39 mg/kg,含量增加了超过11倍之多。由于氨基酸总量的变化受到其净生成速度(主要是蛋白质降解和氨基酸从头合成速度)及外运速度和新蛋白质合成利用速度的影响,故氨基酸质量在一定程度上与蛋白质的变化相联系[10]。但是当在发芽第三天时游离氨基酸总量出现下降趋势,这可能是因为此裸燕麦品种在三天后萌发速度变快而需要大量的氨基酸用来重新合成新组织中的蛋白质,即蛋白质合成酶的活力大于蛋白质降解酶的活力使其含量略有下降。

图4 发芽过程中游离氨基酸含量的变化Fig.4 Changes of free amino acid during oat germination
2.5 可溶性糖和还原糖含量的变化
2.5.1 可溶性糖
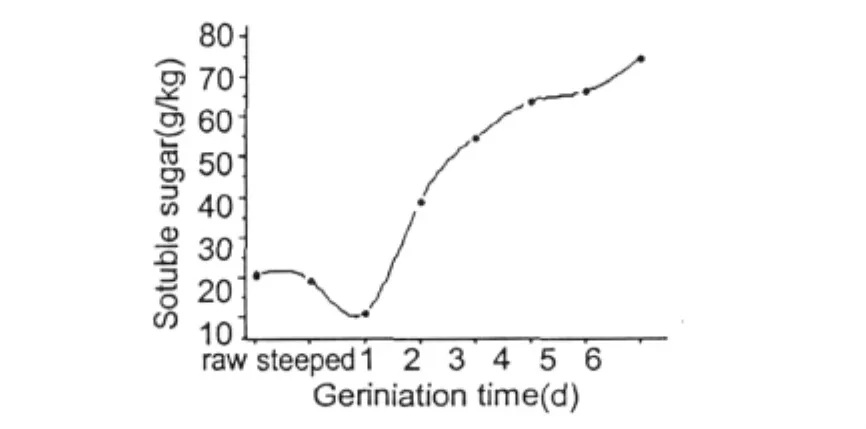
图5 发芽过程中可溶性糖含量的变化Fig.5 Changes of soluble sugar during oat germination
由图5可知燕麦种子中的可溶性糖含量总体趋势是增加的,发芽六天后其含量从20.93 g/kg增加到74.75 g/kg。从浸渍到发芽第一天可溶性糖含量下降原因可能是种子萌发开始进行的呼吸作用消耗种子内部的贮存的可溶性糖来提供能量,第一天后其含量急剧增加是因为种子萌发过程中产生的淀粉酶、纤维素酶等将大分子碳水化合物降解为小分子的糖如麦芽糖、蔗糖、单糖等。第三天后可溶性糖增加缓慢是因为燕麦种子在第三天后生长迅速,需要消耗大量的糖来提供能量或者用于新物质的重新合成。
2.5.2 还原糖
由图6可看出还原糖在燕麦发芽过程中的总体变化趋势和可溶性糖类似,发芽六天后含量从原种子的6.4 g/kg增加至47.4 g/kg,而且四天后增加速度最快。浸渍过程中还原糖含量降低是呼吸作用(主要是无氧呼吸)消耗所致,第三天出现转折点也是由于燕麦种子在第三天后因萌发速度加快需要大量消耗种子内部的还原糖来提供能量和用于新碳水化合物(芽和根中的纤维素等)的合成,且其增加的速度小于消耗的速度。通过对比还原糖含量和可溶性糖含量的增加趋势可知,燕麦籽粒萌发过程中还原糖含量约占可溶性糖的50%左右。

图6 发芽过程中还原糖含量的变化Fig.6 Changes of reducing sugar during oat germination
2.6 β-葡聚糖含量的变化
燕麦种子内胚乳细胞壁的主要成分是交错连接的(1→3),(1→4)-β-D-葡聚糖,且燕麦β-葡聚糖的分子量比大麦和黑麦的 β-葡聚糖分子量要大[8]。由图7可知β-葡聚糖含量在发芽过程中总体呈明显的下降趋势,且降低趋势很大:原燕麦种子中的β-葡聚糖含量为4.64%,发芽六天后含量降至1.6%。这一结果与[15]所研究的发芽大麦β-葡聚糖变化趋势类似。含量最大值出现在浸渍后表明浸渍会使燕麦籽粒中的β-葡聚糖得到释放,使其与其他大分子分离。在发芽过程中β-葡聚糖含量在第三天至第四天出现了一个上升趋势,这一异常现象的出现可能是由籽粒迅速萌发使呼吸作用加大而导致干物质大量损失而导致的[5,2]。此虽然有关燕麦β-葡聚糖摄入量与其功能特性的相关研究较少,但是此试验结果表明此裸燕麦品种发芽后β-葡聚糖含量明显降低可能对其在利用β-葡聚糖相关功能特性方面有一定的限制[13]。

图7 发芽过程中bata葡聚糖含量的变化Fig.7 Changes of beta glucan during oat germination
3 讨论
有关谷物通过发芽以软化籽粒结构、增加营养素的含量和可利用性以及降低抗营养因子种类与含量已经进行了一个多世纪的研究,同时谷物发芽后能产生一些新的风味,但是产生这一现象的生化原因尚未清楚[5]。发芽后的裸燕麦要达到切实可行的商业利用,必须符合以下几个标准:①燕麦种子必须在现有的发芽技术或程序上做最小的改编时具有很好的适应能力;②麦芽产品必须具有一些实用的特性,且这些特质是其他谷物没有或者其他谷物要通过更加高昂的成本才能具有;③发芽燕麦的特性能够通过未发芽燕麦的某些特性推测出来;④发芽燕麦品质必须有一定的稳定性且不含有损害人类健康或不被接受的物质[2]。本试验基于以上原则对裸燕麦进行了基础性的研究,而发芽后β-葡聚糖含量降低对裸燕麦利用有益与否完全取决于其利用的方式,而发芽增加的可溶性糖和还原糖则可为其相关产品提供天然的甜味。
1 Kang Z(康泽),Zhou HJ(周海军),Ren JJ(任嘉嘉).Research progress on oat nutritional value and processing(燕麦营养价值与食品加工研究进展).Collected Papers of 2008th academy annual conference of Chinese Society of Agricultural Machinery(中国农业机械学会2008年学术年会论文集):960-965.
2 David M.Peterson.Malting Oats:Effects on chemical composition of hull-less and hulled genotypes.Cereal Chem,1998,75:230-234.
3 Cave NA,Burrows VD.Evaluation of naked oat(Avena nuda)in the broiler chicken diet.Can J Anim Sci,1993,3: 393-399.
4 Sutcliffe JF,Baset QA.Control of hydrolysis of reserve materials in the endosperm of germinating oat grains.Plant Sci Lett,1973.1:15-20.
5 Kaukovirta-Norja A,Wilhelmson A,Poutanen K.Germination-a means to improve the functionality of oat.2004,13: 100-112.
6 Wang XK(王学奎).Principles and techniques of plant phyciological biochemical experiment(2ndedition)(植物生理生化实验原理和技术),Beijing:Higher Education Press,2006.
7 Burrows VD,Cave NA.,Hamilton RM.G.The Changing Role of Oats in Human and Animal Nutrition,Proc.IV Int.Oat Conf.,Vol.1.A.R.Barr,ed.Organising Committee,IV Int.Oat Conf.:Adelaide,Australia 1992:64-68.
8 Beer MU,Wood P.J.Weisz J.Molecular weight distribution and(1→3)(1→4)-β-D-glucan content of consecutive extracts of various oat and barley cultivars.Cereal Chem,1997,74:476-480
9 Shen RL(申瑞玲),Yao HY(姚惠源).Study on the extraction,purification and characterization of oat β-glucan,Jiang Nan University.2005.
10 Wu YV.Northen Regional Center.Effect of germination on oars and oat protein.Cereal Chem,1983,60:418-420.
11 Mikola M,Jonest BL.Electrophoretic and‘In Solution’Analyses of Endoproteinases Extracted from Germinated Oats.Cereal Sci,2000,31:15-23.
12 Larsson M,Sandberg AS.Malting of oats in a pilot-plant process.Effects of heat treatment,storage and soaking conditions on phtate reduction.Cereal Sci,1995,21:87-95.
13 Zhang D,Doehlert DC,Moore WR.Rheological properties of (1→3),(1→4)-β-D-glucan from raw,roasted,and steamed oat groats.Cereal Chem.1998,75:433-438.
14 Wilhelmson A,Oksman-Caldentey KM,Laitila A,et al.Development of a germination process for producing high β-glucan,whole grain food ingredients from oat.Cereal Chem,2001,78:715-720.
15 Bhatty RS.Production of food malt from hull-less barley.Cereal Chem.1996,73:75-80.
16 Jone Qian,Rayas-Duartep,Grant L.Partial characterization of buck wheat starch.Cereal Chem,1998,75:365-373.
Changes of Three Main Nutrient During Oat Germination
XU Tuo-ming,TIAN Bing-qiang,SUN Zhi-da*,XIE Bi-jun
College of Food Science and Technology in Huazhong Agricultural University,Wuhan 430070,China
Germination of cereals has been used for centuries to soften kernel structure,and in order to utilize oat seed sufficiently and increase nutrient content and availability of oat,one of hull-less oat seed from Shan xi province was analysed for three nutrients and β-glucan content.The results as follows:about 10%less starch and slightly less N was found in malted oat than in unmalted,and lipid content slightly decreased(about 0.1%).Free amino acid,soluble carbohydrate and reducing sugar content increased but β-glucan content decreased remarkably during the germination process.
oat;germination;lipid starch;β-glucan
1001-6880(2011)03-0534-05
2009-09-14 接受日期:2009-11-24
“十一五”国家科技技支撑计划项目(2006BAD27B09)
*通讯作者 Tel:86-27-87283201;E-mail:sunzhida@hzau.edu.cn
S512.6
A

