四种五加果实的活性成分的HPLC定量比较分析
冯 胜,刘向前,2*,朱晓东,郑礼胜
1中南大学制药工程系,长沙410083;2湖南中医药大学药学院,长沙410208
四种五加果实的活性成分的HPLC定量比较分析
冯 胜1,刘向前1,2*,朱晓东1,郑礼胜1
1中南大学制药工程系,长沙410083;2湖南中医药大学药学院,长沙410208
首次系统地对短梗五加、糙叶五加、藤五加、窄叶藤五加四种五加属植物果实中的金丝桃苷、芦丁、槲皮素、山奈素、6,7-二甲氧基香豆素、紫丁香苷等6种活性成分进行了含量比较。采用RP-HPLC测定各个活性成分的含量。色谱柱为ODS C18柱,各活性成分的含量测定均选择最优的色谱条件和供试品溶液制备方法。结果显示:糙叶五加,藤五加,窄叶藤五加果实中除紫丁香苷外的其他活性成分含量均高于短梗五加,但尚未得到有效利用,具有相当好的开发前景。
五加属植物;黄酮类;6,7-二甲氧基香豆素;紫丁香苷;HPLC
五加科(Araliaceae)五加属(Acanthopanax Miq.)植物全世界分布约有37种,主要分布于亚洲的中国、韩国和日本。我国分布有26种18变种,占世界首位,其中短梗五加、糙叶五加、藤五加、窄叶藤五加均为常见品种。韩国已发现五加属植物17种(11种3变种3变型),日本也已发现五加属植物9种[1]。其根皮大都为民间常用药材,俗称“五加皮”,始载于我国《神农本草经》,列为上品[2]。其性温,味辛、苦,归肝、肾经,具有祛风湿、补肝肾、强筋骨、通淤血、利水肿、镇痛解热等功效,中日韩三国的药典均有记载。
由于五加属植物的良好食药用价值和开发前景,受到广泛关注[3]。研究表明五加属植物果实中的黄酮类物质、香豆素类物质、紫丁香苷等为其主要活性成分,是具有广泛生物活性的植物功效成分,但迄今未见对五加属植物果实中的黄酮类和香豆素类物质进行系统研究的报道。本研究首次采用RPHPLC对4种五加属植物(短梗五加、糙叶五加、藤五加和窄叶藤五加)中的主要黄酮类成分(金丝桃苷、芦丁、槲皮素和山奈素)和6,7-二甲氧基香豆素、紫丁香苷的含量进行测定,以期为五加属植物果实的开发利用提供参考。
1 材料与方法
1.1 仪器与材料
Agilent 1100 Speries高效液相色谱仪(日本岛津公司);SPD-10A紫外检测器(日本岛津公司); CBM-102自动进样器(日本岛津公司);LC-10AT双泵(日本岛津公司);AUW120D高精度电子天平(日本岛津公司);AS3120A超声波清洗器(天津奥特塞恩斯仪器有限公司);DZF-6020型真空干燥箱(上海金鹏分析仪器有限公司)。
金丝桃苷对照品、芦丁对照品、槲皮素对照品、山奈素对照品、6,7-二甲氧基香豆素对照品、紫丁香苷对照品均购于湖南省药检所;甲醇(色谱纯)、乙腈(色谱纯)、四氢呋喃、三氯甲烷、盐酸、磷酸、冰醋酸均为天津市科密欧化学试剂有限公司生产;水为双蒸水。
实验用4种五加果实经韩国庆熙大学陆昌洙教授鉴定为短梗五加A.sessiliflorus(Rupr.et Maxim.) Seem(辽宁丹东)、窄叶藤五加A.leucorhizus var.scaberulus(Harms et Rehd)(湖南新化)、糙叶五加A.henryi(Oliv.)Harms(湖南新化)、藤五加A.leucorhizus(Oliv.)Harms(湖南新化),标本存于中南大学制药工程系标本室(标本号:094~097)。
1.2 试验方法
1.2.1 色谱条件
六种活性物质HPLC含量测定的色谱条件[4-9],如表1所示:

表1 六种活性物质含量测定的色谱条件Table 1 Chromatographic conditions of Quantitative comparison of six kinds of active substances
1.2.2 对照品溶液的制备
六种活性物质HPLC含量测定的对照品溶液制备方法[10],如表2所示:
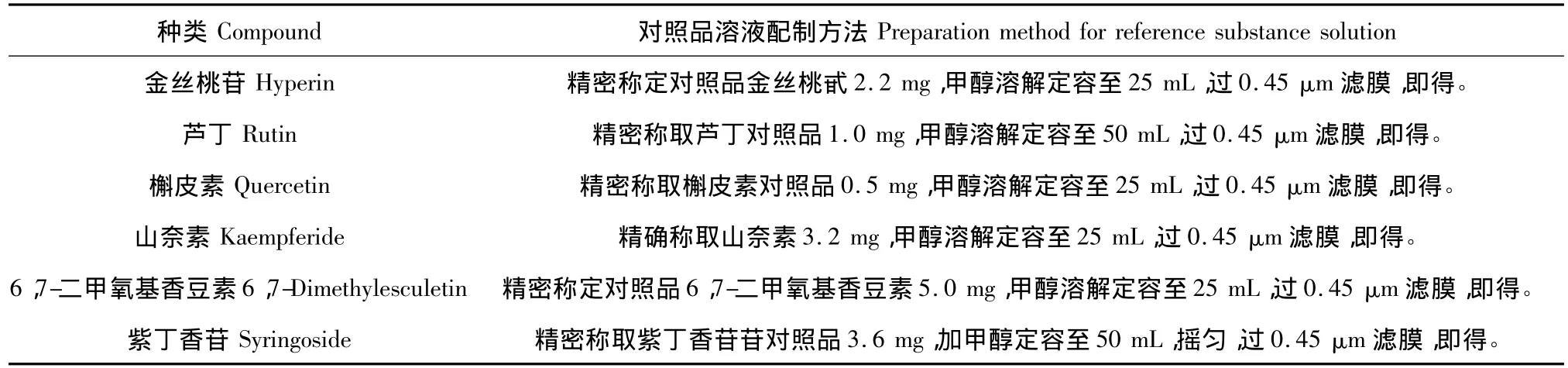
表2 对照品溶液配制方法Table 2 The preparation method of reference substance solution
1.2.3 供试品溶液的制备
六种活性物质HPLC含量测定的供试品溶液制备方法[4-9],如表3所示:

表3 供试品溶液配制方法Table 3 The preparation method of solution for the test product

芦丁R u t i n 取干燥后的四种五加药材,粉碎,精密称定约1.0 g,置具塞锥形瓶中,精密加入5 0 m L甲醇称定重量,超声处理4 5 m i n,放冷,再称定重量,用甲醇补足减失的重量,摇匀,微孔滤膜过滤,即得。槲皮素Q u e r c e t i n山奈素K a e m p f e r i d e取干燥后的四种五加药材,粉碎,精密称定约0.5 g,置具塞锥形瓶中,精密加入8 0 %甲醇,密塞,称定重量,加热回流1.5 h,放冷;再称定重量,用8 0 %甲醇补足减失的重量,摇匀,滤过,精密量取滤液2 5 m L,精密加入2 5 %盐酸7 m L,置8 5℃水浴中水解3 0 m i n,取出,迅速冷却,转移至5 0 m L容量瓶中,并加甲醇稀释至刻度,摇匀微孔滤膜过滤,即得。取干燥后的四种五加药材,粉碎,精密称定约1.0 g,精密称定,置索氏提取器中,加三氯甲烷回流提取2 h,弃去溶剂,药渣挥干,加甲醇回流提取4 h,提取液蒸干,残渣加甲醇-2 5 %盐酸溶液( 4∶1 )混合液2 5 m L,加热回流3 0 m i n,放冷,转移至5 0 m L量瓶中,并加甲醇至刻度,摇匀,即得。6,7 -二甲氧基香豆素6,7 -D i m e t h y l e s c u l e t i n取干燥后的四种五加药材,粉碎,精密称定约1.0 g,置于锥形瓶中,加入5 m L蒸馏水浸润,放置过夜,加入三氯甲烷1 0 0 m L,超声提取3 0 m i n,震荡3 0 m i n,滤过,滤液挥干,残渣用甲醇溶解,过0.4 5 μ m微孔滤膜,用甲醇定容于1 0 m L量瓶中,即得。紫丁香苷S y r i n g o s i d e 取干燥后的四种五加粉末约0.5 g,精密加入甲醇2 0 m L,称重,记录重量,浸1 2 h后,超声处理( 2 5 k w,3 6 k H z ) 3 0 m i n,静置至室温,补足重量,过滤后取续滤液备用,即得。
2 结果与讨论
2.1 结果分析
2.1.1 标准曲线的制备
由于芦丁、槲皮素和山奈素的检测方法来源于中国药典[11-13],故仅对金丝桃苷、6,7-二甲氧基香豆素、紫丁香苷进行方法学考察。选用短梗五加果实为研究精密度、稳定性、重现性以及加样回收率试验的样品。
精密吸取短梗五加果实对照品溶液4、8、12、16、20 μL进样,以峰面积积分值A为纵坐标,进样量B为横坐标进行线性回归,得三种活性物质回归方程分别为:
金丝桃苷:Y=8461.3X+83238,r2=0.9991 6,7-二甲氧基香豆素:Y=2029.1X-21781,r2= 0.9997
紫丁香苷:Y=15234.6X-7881.8,r2=0.9999
表明金丝桃苷在0.3168~1.8304 μg/mL,6,7-二甲氧基香豆素在0.00466~0.0466 mg/mL,紫丁香苷在0.0148~0.074 mg/mL范围内与峰面积呈良好的线性关系。
2.1.2 精密度试验
精密吸取对照品溶液10 μL,在1.2.1项色谱条件下,重复进样5次,测定峰面积,计算相对标准偏差RSD;测得金丝桃苷,6,7-二甲氧基香豆素,紫丁香苷的RSD分别为0.61%,0.30%,0.52%。
2.1.3 稳定性试验
精密吸取同一供试品溶液10 μL,分别在0、3、6、9、12、24 h测定峰面积,计算相对标准偏差RSD,测得金丝桃苷峰面积值的RSD为1.48%,6,7-二甲氧基香豆素峰面积值的RSD为0.77%,紫丁香苷峰面积值的RSD为3.25%,说明样品在24 h内稳定。
2.1.4 重现性试验
取同一批短梗五加果实粉末5份,分别按样品测定方法操作,测定峰面积,计算相对标准偏差RSD;测得金丝桃苷的RSD为1.50%,6,7-二甲氧基香豆素的RSD为3.38%,紫丁香苷的RSD为2.25%。
2.1.5 加样回收率试验
精密称取一定量已知含量的样品,精密加入一定量金丝桃苷、6,7-二甲氧基香豆素、紫丁香苷对照品,按样品含量测定项下方法测定,测得金丝桃苷、6,7-二甲氧基香豆素、紫丁香苷平均回收率分别为97.61%、99.60%、98.25%,RSD分别为1.55%、1.03%、0.96%,结果见表4。

表4 加样回收率试验结果(n=5)Table 4 Recoveries of syringin at various spiked amounts(n=5)

6,7 -二甲氧基香豆素6,7 -D i m e t h y l e s c u l e t i n 1 1.7 0 0.0 5 0.1 6 0.2 1 9 9.8 4 2 1.7 4 0.0 5 0.1 6 0.2 1 9 9.4 0 9 9.6 0紫丁香苷S y r i n g o s i d e 1 0.3 6 0.0 2 0.1 5 0.1 6 9 4.8 6 2 0.3 4 0.0 2 0.1 5 0.1 7 1 0 0.8 1 3 0.3 3 0.0 2 0.1 5 0.1 6 9 8.0 4 4 0.3 5 0.0 2 0.1 5 0.1 7 1 0 1.0 8 9 8.2 4 1.7 4 0.0 5 0.1 6 0.2 2 1 0 0.6 6 3 1.7 0 0.0 5 0.1 6 0.2 1 9 9.0 9 4 1.6 9 0.0 5 0.1 6 0.2 1 9 9.0 1 5 5 0.3 6 0.0 2 0.1 5 0.1 6 9 6.4 2
2.1.6 样品测定
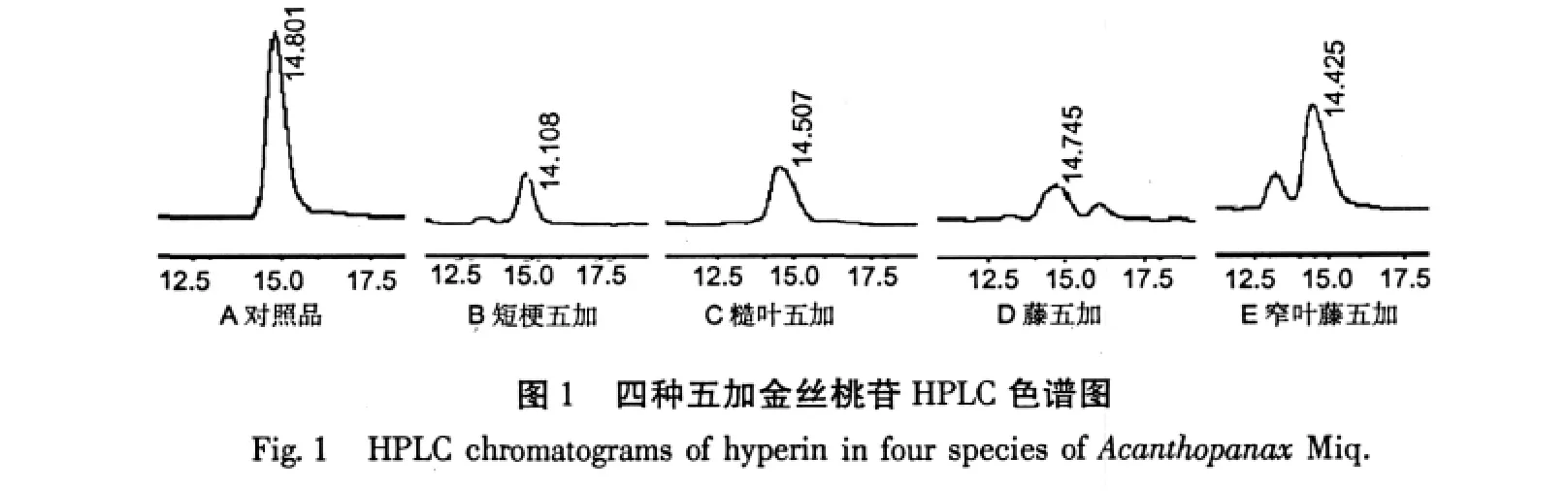





精密吸取供试品溶液10 μL进样,测定峰面积,外标法计算含量。图1~图6分别为四种五加中金丝桃苷、芦丁、槲皮素、山奈素、6,7-二甲氧基香豆素、紫丁香苷含量测定的液相色谱图。
根据HPLC检测结果,由标准曲线计算出各成分的含量,结果如表5所示。
2.2 讨论
2.2.1 色谱条件及供试品制备方法的优化
根据05版中国药典一部[9]和文献[10-12],以基线漂移小,各色谱峰的高度合适,分离效果好,且能得到较多的峰信息为判定标准,选择了六种活性物质的测定波长,结果见表1。

表5 四种五加果实中的主要活性成分含量Table 5 The contents of primary active ingredient in the fruit of four species of Acanthopanax Miq.
本文对色谱条件和供试品制备方法进行了探索[10-14],比较了流动相组成和配比在测定四种五加果实中六种活性物质含量时对色谱峰分离度的影响,以及供试品制备方法对四种五加中六种活性物质测定含量的影响。通过反复摸索,分别确定了四种五加果实中的金丝桃苷[10],6,7-二甲氧基香豆素[11],紫丁香苷[12]的最优色谱条件及供试品制备方法,而芦丁,槲皮素,山奈素在05版中国药典的方法下,具有最好的色谱峰分离度和最准确的含量[6-8]。
2.2.2 四种五加果实的活性成分含量比较
对比表5中的数据,得到:
金丝桃苷含量:窄叶藤五加>糙叶五加>藤五加>短梗五加;
芦丁含量:藤五加>窄叶藤五加>糙叶五加>短梗五加;
槲皮素含量:藤五加>窄叶藤五加>糙叶五加>短梗五加;
山奈素含量:糙叶五加>窄叶藤五加>藤五加>短梗五加;
6,7-二甲氧基香豆素含量:窄叶藤五加>藤五加>糙叶五加>短梗五加;
紫丁香苷含量:糙叶五加>短梗五加>藤五加>窄叶藤五加。
比较四种五加果实中黄酮类物质的含量,窄叶藤五加中各种黄酮类物质的含量均较高。藤五加中除山奈素的含量相对较低以外,其他黄酮类物质均有较高的含量。糙叶五加的山奈素和金丝桃苷含量较高,其他黄酮类物质也有一定的含量。短梗五加的各种黄酮类物质含量均为最低。
比较四种五加果实中6,7-二甲氧基香豆素的含量,窄叶藤五加中6,7-二甲氧基香豆素含量最高,藤五加次之,糙叶五加和短梗五加中的含量相对较低。
比较四种五加果实中紫丁香苷的含量,糙叶五加中的紫丁香苷含量最高,短梗五加也有较高的含量,而藤五加和窄叶藤五加中的含量较低。
3 结论
黄酮类物质,6,7-二甲氧基香豆素,紫丁香苷作为五加属植物果实中的主要有效成分,具有良好的抗疲劳、抗衰老作用,并能明显地提高耐缺氧能力,同时具有促进腺发育、止血等疗效[14]。通过对研究结果的分析发现,若开发五加果实中的黄酮类物质,窄叶藤五加和藤五加最好,糙叶五加次之;若开发五加果实中的6,7-二甲氧基香豆素,窄叶藤五加最佳,其他均可;若开发五加果实中的紫丁香苷,则以糙叶五加和短梗五加为佳。
我国东北地区特有的短梗五加已通过卫生部新资源食品批准,可广泛应用于制药和食品等行业,其果实现已用于饮料类、酒类的生产;而糙叶五加、藤五加、窄叶藤五加则尚未得到有效利用。由于糙叶五加、藤五加、窄叶藤五加的果实与短梗五加的果实相比,同样含有大量的活性成分,在多数活性成分的含量上甚至超过了短梗五加,这三种五加的果实将在食品和药品领域拥有广泛的应用价值和巨大的应用前景。
1 Ni N(倪娜),Liu XQ(刘向前).Advances in studies on plants of Acanthopanax Miq.in Araliaceae.Chin Tradit Herb Drugs(中草药),2006,37:1895-1900.
2 Li LL(李丽丽),Zheng LS(郑礼胜),Liu XQ(刘向前),et al.Analysis of syringin content in new resource Acanthopanax.sessiliflorus(Rupr.et Maxim.)seem and other seven species of Acanthopanax Miq.by RP-HPLC.Food Sci(食品科学),2009,30(10):140-143.
3 Zhang P(张鹏),Zheng JP(郑金萍),Sun BJ(孙宝俊),et al.The series product processes the craft of Acanthopanax Sessiliflorus.Acad Period Farm Prod Proc(农产品加工·学刊)2006,3:66-67.
4 National Pharmacopoeia Committee.The People's Republic of China Pharmacopoeia:1(中华人民共和国药典:一部).2005,Appendix IXH.
5Yang ZF(杨志芳),Wang WN(王维娜),Yang K(杨坤),et al.Determination of hyperoside,isoquerditrin and quercitrin-3'-glucoside in flos Abelmoschus manihot of different areas by HPLC.Pharm J Chin PLA(解放军药学学报),2005,21:388-393.
6 He FY(何方奕),Han Y(韩莹),Liu M(刘曼).Determination of the contents of total coumarin and 6,7-dimethoxycoumarin in fruit of Acanthopanax sessiliflorum(Rupr.et Maxim.)Seem..J Shenyang Pharm Univ(沈阳药科大学学报),2006,1(23):18-20.
7 Zhang CX(张崇禧),Zhang YY(张莹莹),Tian X(田芯),et al.Determination of syringoside in Acanthopanax of different areas by HPLC.Chin Tradit Patent Med(中成药),2008,30:1648-1651.
8 Jin XQ(靳晓秋),Chen L(陈黎).Determination of hyperoside,quercetin and kaempferide in Eupatorium lindleyanum DC.by HPLC.Chin Tradit Herb Drugs(中草药),2008,39: 1254-1255.
9 Liu JF(刘军峰),Gao JC(高锦成),Liu JF(刘建峰),et al.Determination of syringoside in Acanthopanax obovatus Hoo by HPLC.Northwest Pharm J(西北药学杂志),2008,23:358-359.
10 Yu SL(于世林).High performance Liquid Chromatography and Its Application(高效液相色谱法及应用).2 version.Beijing:Chemical Industry Press,2003.
11 National Pharmacopoeia Committee.The People's Republic of China Pharmacopoeia:1(中华人民共和国药典:一部).2005,36-37.
12 National Pharmacopoeia Committee.The People's Republic of China Pharmacopoeia:1(中华人民共和国药典:一部).2005,84.
13 National Pharmacopoeia Committee.The People's Republic of China Pharmacopoeia:1(中华人民共和国药典:一部).2005,220-221.
14 Xu F(徐峰),Zhao JY(赵江燕),Liu TS(刘天硕).Analysis of anti-fatigue effect of Acanthopanax.Food Sci(食品科学),2005,26:453-456.
Quantitative Analysis Comparison of Primary Active Ingredients in Four Species of Acanthopanax Miq.by HPLC
FENG Sheng1,LIU Xiang-qian1,2*,ZHU Xiao-dong1,ZHENG Li-sheng11Department of Pharmaceutical Engineering,Central South University,Changsha 410083,China;2Hunan University of Chinese Medicine,Changsha 410208,China
For the first time,the study compared the contents of active ingredient,which include hyperin,rutin,quercetin,kaempferide,6,7-dimethylesculetin,and syringoside,from 4 species of Acanthopanax Miq.such as A.sessiliflorus (Rupr.et Maxim.)Seem,A.leucorhizus var.scaberulus(Harms et Rehd),A.henryi(Oliv.)Harms,A.leucorhizus (Oliv.)Harms by RP-HPLC.The column was ODS C18.Best chromatographic conditions and preparation methods of Solution for test were used to analysis every active ingredient.The results showed that the contents of primary active ingredients in other three plants were more than those of primary active ingredients A.sessiliflorus(Rupr.et Maxim.)Seem except for syringoside,but has not yet been effective used.
Acanthopanax Miq.;flavones;6,7-dimethylesculetin;syringoside;HPLC
1001-6880(2011)03-0498-07
2009-10-19 接受日期:2010-04-21
河南省教育厅产业化项目(09CY020);教育部留学回国人员科研启动基金(教外司留[2005]55号)和中大研究生创新项目(2009SSXT046)
*通讯作者 E-mail:lxq0001cn@163.com
r284.1;Q946.8
A

