胍乙酸壳聚糖的合成及其对黄瓜的保鲜研究
曾 涵,赵淑贤,张 雷,王永疆
1新疆师范大学生命科学与化学学院,乌鲁木齐830054;2新疆农业大学附属中学,乌鲁木齐830052
胍乙酸壳聚糖的合成及其对黄瓜的保鲜研究
曾 涵1*,赵淑贤1,张 雷2,王永疆1
1新疆师范大学生命科学与化学学院,乌鲁木齐830054;2新疆农业大学附属中学,乌鲁木齐830052
以自制的不同脱乙酰度的壳聚糖和1-氯胍乙酸为原料合成了胍乙酸壳聚糖,研究了胍乙酸壳聚糖对黄瓜的保鲜效果。结果表明,由脱乙酰度为96%的壳聚糖制得的胍乙酸壳聚糖平均分子量为5287。随着脱乙酰度的增加,黄瓜失重率的增加逐渐减缓,随着贮存时间延长总叶绿素含量先升高然后缓慢下降,而维生素C含量则一直缓慢下降;脱乙酰度为96%的壳聚糖制得的胍乙酸壳聚糖贮存35 d后,黄瓜的质量损失为0.7%;贮存20 d后,总叶绿素含量仍然可达1.34 mg/g;贮存时间20 d后,维生素C含量可达0.18 mg/g。
胍乙酸壳聚糖;黄瓜;涂膜;保鲜
壳聚糖由于安全,无毒副作用且成膜性好,目前已经应用于辣椒、番茄、草莓等的保鲜研究[1-5]。欧春艳等[6]首先研究了不同脱乙酰度的壳聚糖对黄瓜的保鲜效果,但是在保存7 d之后,黄瓜的性状便发生了明显改变,可见壳聚糖保鲜能力有限。胍基本身具有良好的生物相容性,胍乙酸又是一种具有较好生理活性的有机物,在生理条件下处于完全质子化状态,是形成配体和受体、酶和底物之间氢键、静电力等相互作用的基础,但其对细胞表面缺乏亲和力,在细胞表面无法成膜,吸湿保湿性能不稳定[7]。前文[8]结合这二者的优点,合成了既具有良好的吸湿保湿性,又具有良好生理活性的胍乙酸壳聚糖(GAAC)。在此基础上,采用以微波加热代替常规加热制备得到的壳聚糖并进行胍乙酸化,研究了胍乙酸壳聚糖涂膜处理后的黄瓜失重率,总叶绿素含量及维生素C含量等随着贮存时间的变化关系,类似研究目前尚未见报道。经胍乙酸壳聚糖接枝物涂膜处理,黄瓜贮存35 d后失重率仅为0.7%,不到文献[6]报道的一半;贮存20 d后,总叶绿素含量仍然可达1.34 mg/g,维生素C含量可达到0.18 mg/g,而文献[6]报道的脱乙酰度为90%的壳聚糖涂膜处理,黄瓜贮存20 d后总叶绿素含量仅有0.7 mg/g,维生素C含量仅有0.11 mg/g。
1 材料与方法
1.1 仪器和试剂
WP-750A型微波炉,WNZK-01温度控制仪,NDJ-1型旋转式粘度计,将干燥试样溶解于0.1 mol/L NaCl溶液中,按一点法进行特性粘度的测定;76型电动搅拌机,AL104数字式电子天平(德国梅特勒公司),BRUKER EQUINDX-55型红外光谱仪(德国 BRUKER公司),KBr压片;JEOL JNMECP600M型核磁共振仪(日本JEOL公司),溶剂D2O,TMS为标样;Y-4Q型X-射线衍射仪(荷兰飞利浦公司);PHS-25型PH计(上海雷磁仪器厂); DDS-L型电导率仪(深圳市统奥科技有限公司); Waters(Model510)凝胶渗透色谱仪(GPC)(美国Waters公司),流动相为THF(四氢呋喃),用窄分布的聚苯乙烯样品作为标样。
1-氯胍乙酸、NaOH、HCl、草酸、高锰酸钾、甘氨酸、丙酮、甲醛、冰乙酸、溴乙烷、硫脲、红磷和乙醚均为分析纯。
1.2 实验方法
1.2.1 壳聚糖的制备
将10 g经过水洗后的虾壳用200 mL 2 mol/L NaOH溶液浸泡,用320W功率的微波辐照5 min后,冷至室温浸泡12 h,再用质量分数为10%NaCl溶液浸泡4 h后冲洗,除去虾壳中的蛋白质,重复此步骤3~4次后用水洗至中性,再用250 mL 2 mol/L HCl溶液在室温下浸泡24 h,使碳酸钙转化为氯化钙,用水洗至中性,干燥,粉碎后,加入质量分数为2%的高锰酸钾溶液,浸泡1 h脱色,水洗后以质量分数60%~70%草酸处理20 min,得白色片状结晶甲壳素。
将甲壳素在35%的NaOH溶液中用500W功率微波辐照10 min,得到脱乙酰基的壳聚糖,再加入质量分数2%稀醋酸将其溶解,过滤去除杂质后,滤液中加入碱,析出壳聚糖。粗甲克素按上述步骤处理不同时间可得不同脱乙酰度的壳聚糖:处理时间分别为4.3、5.2、6.4、7.9和9.4 h时可分别得到脱乙酰度为30、50、70、90和96%的壳聚糖。
农村经济是社会经济稳步发展的主要推动力,在新农村建设中,群众的生活水平得到了显著提高,但也出现了影响新农村建设的不利因素,其中农村人畜用水安全就是影响新农村建设的主要因素之一。现阶段我国农村普遍存在水资源短缺的现象,虽然我国农村地区已经修建了一些人畜饮水工程,但是由于管理不力等方面的因素,人畜饮水工程的效益并没有得到充分发挥。
1.2.2 胍乙酸壳聚糖合成
按文献[8]方法合成。合成步骤简述如下:称取约3.8 g干燥壳聚糖固体,加入10 mL质量分数为50%的NaOH溶液碱化,再依次加入约20 mL异丙醇及1-氯胍乙酸3.0 g,室温反应2 h,并不时搅拌,待壳聚糖固体缓慢溶解后再加热2 h(温度保持在70℃),搅拌下冷却至室温(约30 min),加无水冰醋酸调pH至中性,有白色粘稠状固体生成,充分搅拌,加无水乙醚搅拌,抽滤,于80℃烘箱内干燥,研碎得白色胍乙酸壳聚糖粉末(以不同脱乙酰度的壳聚糖为原料与1-氯胍乙酸反应可得不同脱乙酰度的胍乙酸壳聚糖)。
1.2.3 脱蛋白质量的测定
采用甲醛滴定氨基氮法[9]用pH计测得微波脱蛋白液中氨基氮含量为1.642 g/L。
1.2.4 脱乙酰度的测定
以电导率为纵坐标,NaOH溶液的消耗量(mL)为横坐标作图,通过一阶,二阶微分求拐点,按文献[10]方法求出壳聚糖的脱乙酰度。
1.2.5 失重率测定
称取不同脱乙酰度的GAAC各1.0000 g,加入100 mL质量分数为1.5%的稀醋酸溶液,搅拌溶解后得10 g/L的GAAC溶液。将黄瓜随机分组,每组5个,分别将配好的涂膜液覆于黄瓜表面,涂抹均匀,然后把黄瓜放在通风处,自然风干,称重,用保鲜袋装好,室温下贮藏。
1.2.6 叶绿素含量测定
按下式[11]求得总叶绿素含量:

式中A为吸光度,m为所用鲜黄瓜表皮质量(g),V为叶绿素丙酮提取液的体积(mL)
1.2.7 维生素C含量测定

图1 壳聚糖脱乙酰度随处理时间的变化关系Fig.1 Relation between chitosan deacetylation and disposal durance
用微波消解不同脱乙酰度的壳聚糖涂膜液处理过的黄瓜,用间接碘量法[12]测定其中维生素C含量。
2 结果与讨论
2.1 胍乙酸壳聚糖(GAAC)的结构分析
壳聚糖的脱乙酰度测定结果如图1所示。由图1可以看出:在起始的4 h内,反应很慢,随着处理时间的延长,脱乙酰度迅速增加,10 h以后甲壳素上的乙酰基已经基本上被脱除。
GAAC:IR(KBr)υ/cm-1:3480(N-H);1425,1621(COO-);1560(guanyl);924(sugar ring,C1-H)。1H NMR δ:3.4~4.2(m,5H,sugar ring 2,3,4,5,6-H);4.46~5.06(m,3H,sugar ring-OH);9.70 (d,J=9.0 Hz,1H,NH);4.56(t,J=9.3 Hz,1H,sugar C1-H)。壳聚糖的XRD图谱中2θ为10°、18°、45°、66°和79°处有5个强结晶峰。GAAC的XRD图谱上,只有20°和47°的2个弱峰,其强度只有壳聚糖XRD图谱中与之相接近的18°和45°峰强度的31%和44%;壳聚糖的其余结晶峰全部消失,说明引入的胍基破坏了壳聚糖的结晶结构,这也是GAAC水溶性增高的原因。
按照文献[13]方法测得由脱乙酰度为96%的壳聚糖制备的 GAAC的聚合度为8.51,取代度为0.43,炭化点≥186℃,测得粘度为292 mPa.s,由GPC测得分子量为5287,分子量分布指数为2.31,GAAC在水中的溶解度(25℃)为:0.41 g·L-1。其分子结构如图2所示:
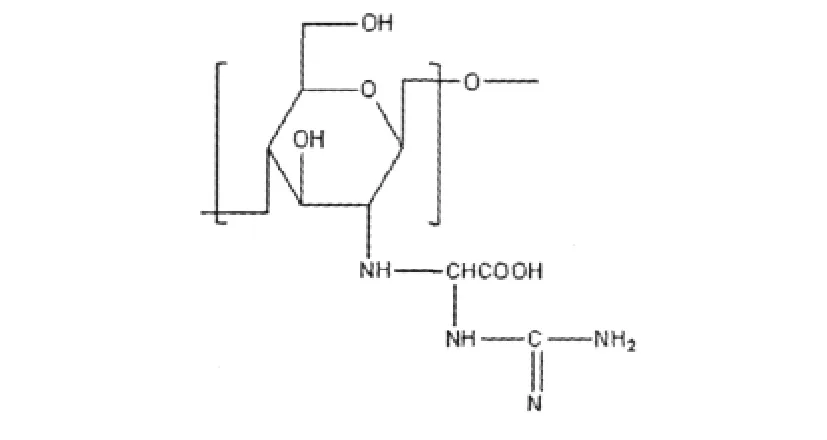
图2 GAAC分子结构图示Fig.2 Diagram of GAAC molecular structure
2.2 黄瓜的质量损失率
黄瓜失重率计算方法公式:质量损失%=(mo–mt)/mo×100%。式中mo和mt分别为黄瓜的原始质量和每天称重的质量(g),实验结果见图3。
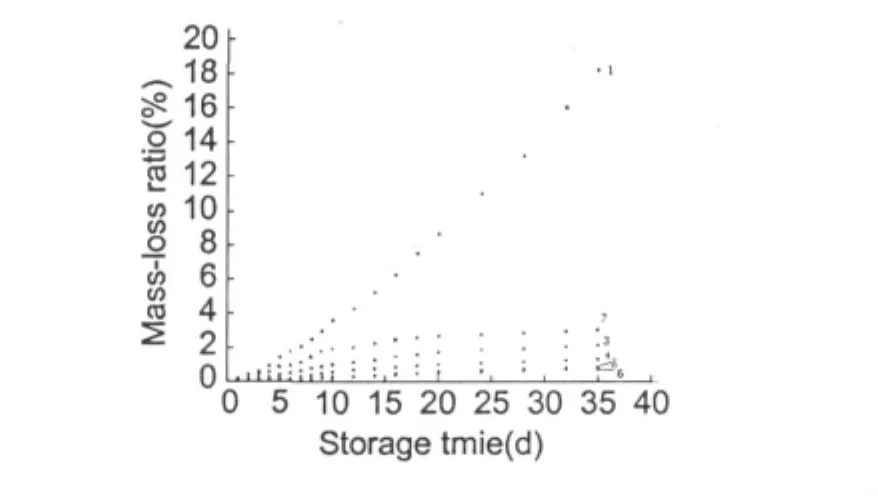
图3 黄瓜失重率与贮存时间的关系Fig.3 Relation between storage durance and weightloss.Deacetylation/%:1.0,2.30,3.50,4.70,5.90,6.96
由图3可以看出:各涂膜组黄瓜的失重率均低于对照组,其中经脱乙酰度高的涂膜液处理的黄瓜失重率最低。在低临界溶解温度和动态接触浓度之下,GAAC分子可以有效地吸附在细胞表面而不会被细胞吸收,达到抑制水分流失的作用。此外,GAAC的抑菌作用也增强了保鲜效果[14]。文献[6]报道以脱乙酰度为85%的壳聚糖涂膜的黄瓜贮存20 d后失重率可达1.6%,而本文合成的胍乙酸壳聚糖(其中作为原料的壳聚糖脱乙酰度为96%)作保鲜剂给黄瓜涂膜,贮存35 d后的失重率仅为0.7%。
2.3 黄瓜中叶绿素含量的变化

图4 贮存时间对黄瓜叶绿素含量的影响Fig.4 Influence of storage durance on total concentration of Chlorophyll in cucumber.Deacetylation/%:1∶0,2∶30,3∶50,4∶70,5∶90,6∶96
黄瓜叶绿素含量随贮存期的变化见图4,可以看出随着贮藏时间增长,对照组的叶绿素含量逐渐减少,而经涂膜处理过的黄瓜中的叶绿素含量则会先显著上升而后逐渐下降。这是因为黄瓜在用GAAC涂膜保鲜时,类似于微环境下的MA(Modified atmosphere)保藏,膜内的CO2含量随时间延长而增加,从而减缓叶绿素的降解。叶绿素酶活性中心与GAAC可能通过螯合或氢键作用相结合使酶活性中心构象发生扭曲,导致酶活力下降(与GAAC结合后的叶绿素酶的活性降低为游离叶绿素酶活性的30%[14-16]);同时这种酶和GAAC的选择性结合也增大了底物叶绿素与酶空间上的分隔,从而阻止了叶绿体膜的崩溃瓦解,这意味着单位时间和体积内叶绿素降解速度显著减慢,表观上测定的叶绿素浓度便“上升”了。文献[6]报道当以脱乙酰度为90%的壳聚糖涂膜黄瓜表面,贮存20 d后测得的总叶绿素含量下降到0.7 mg/g,而以胍乙酸壳聚糖(其中作为原料的壳聚糖的脱乙酰度为96%)作为保鲜剂给黄瓜涂膜贮存20 d后,总叶绿素含量为1.34 mg/ g。
2.4 黄瓜中维生素C含量的变化

图5 黄瓜中维生素C含量与贮存时间的关系Fig.5 Relation between storage durance and content of Vitamin C in cucumber.Deacetylation/%∶1∶0,2∶30,3∶50,4∶70,5∶90;6∶96
黄瓜中维生素C含量随贮存时间的变化见图5。可以看出:随着贮藏时间的延长,涂膜组和对照组的维生素C含量都明显减少,但经GAAC涂膜后黄瓜中维生素C含量的降低速率明显低于对照组。这是由于GAAC涂膜显著地减少了黄瓜体内外的气体交换,从而使维生素C的损失减少。覆盖于细胞表面的GAAC分子可形成有效的保护膜,部分抑制了电子在细胞膜内外的迁移并导致维生素C的峰电流下降,电位也发生相应的变化[16]。综上所述,随着壳聚糖的脱乙酰度提高保鲜剂的保鲜效果增强,这可以解释为:一方面是由于脱乙酰度的提高使游离NH2基团增多,从而可连接更多的胍乙酸基。胍乙酸基团中C=N键对邻近N原子的强烈吸电子作用,使其更容易被亲核性细胞膜吸附,另一方面则是因为连接的胍乙酸基越多,改变了叶绿素酶的空间结构,使其翻译后修饰步骤受到阻碍,导致降解速度下降从而起到保鲜作用[15,16]。另外,此种保鲜剂的保鲜效果要超过文献[6]报道的同样条件下脱乙酰度为90%的壳聚糖对黄瓜的保鲜效果大约50%。文献[6]报道的以脱乙酰度为90%的壳聚糖涂膜黄瓜表面,贮存20 d后测得的维生素C含量仅为0.11 mg/g,而以脱乙酰度为96%的壳聚糖为原料制备的胍乙酸壳聚糖作保鲜剂给黄瓜涂膜后贮存20 d后,测定的黄瓜中维生素C含量为0.18 mg/g。这是因为:一方面GAAC分子可以凭借多个基团的氢键,静电引力等作用相对于壳聚糖分子而言更稳定地吸附于细胞膜表面;另一方面则是胍乙酸基与叶绿素酶基因中N端的序列发生作用,改变了叶绿素酶翻译后修饰的历程,从而改变了叶绿素的降解速度[15,16]。
1Sun XL(孙晓丽),Xin MH(辛梅华),Li MC(李明春). Preparation of N,N-dilauryl chitosan.Chem Ind Eng Prog (化工进展),2006,25:1095-1097.
2 Garcia MA,Pinotti A,Martino M.Electrically treated composite FILMS based on chitosan and methylcellulose blends. Food Hydrocoll,2009,23:722-728.
3 Molvinger K,Quignard F,Brunel D.Porous chitosan-Silica hybrid microspheres as a potential catalyst.Chem Mater,2004,16:3367-3372.
4 Höhne S,Frenzel R,Heppe A.Hydrophobic chitosan microparticles:heterogeneous phase reaction of Chitosan with hydrophobic carbonyl reagents.Biomacromolecules,2007,8:2051-2058.
5 Ling PX(凌沛学),Rong XH(荣晓花),Zhang TM(张天民).Medical developments of chitosan and its derivates. Foods&Drugs(食品与药品),2008,10(9):69-71.
6 Ou CY(欧春艳),Li SD(李思东),Yang L(杨磊).The effect of different deacetylation of chitosan on cucumbers preservation.Guangzhou Chem Ind(广州化工),2008,36: 31-33.
7Cao YJ(曹玉娟),Gao HX(高海翔),Lu RH(鲁润华). Progressing in the synthesis of guanidines.Chin J Synth Chem(合成化学),2003,3:193-202.
8 Zeng H(曾涵),Zhang L(张雷).Synthesis of guanidyl acetic acid chitosan and measurement of its hydroscopic and moisture retention.J Xinjiang Norm Univ,Nat Sci(新疆师范大学学报,自科版),2008,27:83-86.
9 Yang JS(杨继生),Zhang M(张明).Preparation of chitosan with microwave technology.Chem Eng(化学工程师),1995 (5):14-15.
10 Tea Indest,Janne Laine,Leena-Sisko Johansson,et al.Adsorption of fucoidan and chitosan sulfate on chitosan modified PET films monitored by QCM-D.Biomacromolecules,2009,10:630-637.
11 Wu ZJ(吴仲几).Experiment of Food Chemistry(食品化学实验),Guangzhou:The Press of Jinan University,1995.85-88.
12 Wang YX(王云霞),Zhang HQ(张会轻).The discussion of titrimetric method of vitamin C content.Hebei Chem Eng Ind (河北化工),2008,31(8):72-73.
13 Su ZF(苏志锋),Yu XL(于晓琳),Zhao YM(赵耀明). Study of the graft copolymer of cellulose diacetate with L-lactide.Chem Res Appl(化学研究与应用),2008,20:1101-1104.
14 Shi HF(史合方),Cao LH(曹玲华).Synthesis and biological activity of N-Alkyl/aryl-N'-(4-arylthiazol-2-yl)-N"-glycosyl Guanidines.Chin J Org Chem(有机化学),2005,25: 1066-1070.
15 Yang XT(杨晓棠),Zhang ZQ(张昭其),Xu LY(徐兰英),et al.Plant chlorophyll degradation.Plant Physiol Commun (植物生理学通讯),2008,34:7-14.
16 Harpaz-Saad S,Azoulay T.Chlorophyllase is a rate-limiting enzyme in chlorophyll catabolism and is posttranslationally regulated.Plant Cell,2007,19:1007-1022.
Synthesis of Guanidyl Acetic Acid Chitosan And Preservation Effect of Cucumbers
ZENG Han1*,ZHAO Shu-xian1,ZHANG Lei2,WANG Yong-jiang11College of Life Science and chemistry,Xing Jiang Normal University,Urumuqi 830054,China;2Accessory Middle School of Xin Jiang Agricultural School,Urumuqi 830052,China
Guanidyl acetic acid chitosan(GAAC)has been synthesized by self-made chitosan and chloro-guanidinyl acetate as raw materials and was used as cucumber preservative.The results from experiment indicated average molecular weight of guanidyl acetic acid chitosan prepared from chitosan with deacetylation of 96%was 5287 g/mol.Effects of coating with a series of different deacetylation of GAAC as fresh-keeper for cucumber stored at room temperature had been examined.Weight-loss rate slowed down gradually with increase of chitosan deacetylation.Consistency of total chlorophyll increases first and then decreases gradually while storage period lapses.In contrast,concentration of vitamin C declines slightly while storage duration prolongs.When storage duration of GAAC prepared from chitosan with deacetylation of 96%is 35 d,weight-loss rate is about 0.7%;storage duration:20 d,concentration of total chlorophyll still amounts to 1.34 mg/g;while consistency of vitamin C can retain 0.18 mg/g,storage duration 20 d.
guanidyl acetic acid chitosan(GAAC);cucumber;coating film;fresh-keeping
1001-6880(2011)03-0504-05
2010-01-05 接受日期:2010-04-27
*通讯作者 E-mail:zenghan1289@163.com
O636.1
A

