卵巢特异启动子调控白介素24基因真核表达载体的构建
祝 贺,崔满华,杜珍武,张 勇,邹颖刚
(吉林大学1.第二医院妇产科吉林长春130041;2.中日联谊医院中心研究室;3.白求恩医学院病理生理教研室)
随着分子生物学和基因技术的发展,基因治疗为卵巢癌患者带来了希望,而基因靶向治疗成为当今卵巢癌基因治疗的新热点。卵巢特异启动子-1(Ovarian-specific promoter,OSP-1)在卵巢癌中的特异表达已得到证实[1]。白细胞介素-24(Interleukin-24,IL-24)是一种新型的细胞因子,既能选择性地诱导肿瘤细胞凋亡,又能参与机体的免疫调节系统,是一个理想的治疗功能基因。本实验旨在构建OSP-1调控下的IL-24基因表达载体,为探讨IL-24靶向基因治疗卵巢癌提供实验基础。
1 材料与方法
1.1 质粒与菌株
OSP-1基因启动子片段由上海生工生物工程技术服务有限公司合成并克隆入 PUC57质粒,pcDNA3.0真核质粒载体由吉林大学中日联谊医院中心研究室惠赠;DH-5α大肠杆菌感受态细胞购自北京天根生化科技有限公司。
1.2 主要试剂
TaqDNA酶、T4DNA 连接酶、dNTP、PMD-18T载体试剂盒、DNA Marker及各种限制性内切酶均购自大连宝生物工程有限公司;RNA提取试剂盒、逆转录试剂盒、质粒小量抽提取试剂盒购自上海生工生物工程技术服务有限公司;DNA琼脂糖凝胶回收试剂盒购自杭州维特洁生化技术有限公司。
1.3 IL-24基因扩增引物的设计
根据Genbank中发表的 IL-24基因cDNA序列(NM-006850.2),利用Primer5.0引物设计软件设计引物 ,上游引物:5’-GGA TCC GCC ACC ATG AAT TTTCAA CAGAGC-3’,下游引物:5’-CTC GAG TCA GAGCTTGTA GAA TTTC-3’,扩增的IL-24片段长度为639 bp。上游引物5’端添加BamH Ⅰ酶切位点、Kozak序列及ATG起始密码子;下游引物5’端添加XhoⅠ酶切位点。
1.4 IL-24基因克隆
取新鲜的人外周血5 ml,应用淋巴细胞分层液进行单个核细胞分离,刀豆蛋白刺激72 h后,提取全细胞mRNA,逆转录成为cDNA。以cDNA为模板,应用设计的IL-24基因扩增引物进行PCR扩增。反应条件为58℃退火30 s,循环35次。产物1%琼脂糖凝胶电泳并观察结果。IL-24基因PCR产物应用DNA琼脂糖凝胶回收试剂盒进行回收纯化。回收后与PMD-18T质粒载体连接,转化DH5α感受态大肠杆菌,调取阳性克隆,提取质粒,应用BamH Ⅰ和XhoⅠ酶切鉴定。酶切鉴定正确的质粒送上海生工进行测序鉴定。构建的载体命名为PMD-18T-IL-24。
1.5 OSP-1基因启动子调控基因表达的真核表达载体的构建
将含有OSP-1基因启动子片段的PUC57质粒与pcDNA3.0载体应用MluⅠ和 HindⅢ进行双酶切,酶切获得的OSP-1基因启动子片段与pcDNA3.0载体片段应用DNA凝胶试剂盒回收。T4DNA连接酶连接回收产物,转化DH-5α感受态大肠杆菌,筛选阳性克隆,提取质粒,应用MluⅠ和 HindⅢ进行酶切鉴定。酶切鉴定正确的质粒送上海生工进行测序鉴定。构建的载体命名为pcDNA3.0-OSP-1。
1.6 OSP-1基因启动子调控IL-24基因表达载体的构建
将pcDNA3.0-OSP-1载体质粒与PMD-18T-IL-24载体应用BamHⅠ和XhoⅠ进行双酶切,酶切获得的IL-24与pcDNA3.0-OSP-1载体片段应用DNA凝胶试剂盒进行回收。T4DNA连接酶连接回收产物,转化DH-5α感受态大肠杆菌,筛选阳性克隆,质粒小量抽提取试剂盒提取质粒,应用BamHⅠ和XhoⅠ进行酶切鉴定。构建的载体命名为pcDNA3.0-OSP-1-IL-24。
2 结果
2.1 IL-24基因cDNA的PCR扩增结果
PCR产物经1%琼脂糖凝胶电泳,在639 bp处可见特异性扩增条带,与IL-24基因cDNA大小一致(639 bp),见图 1。
2.2 PMD-18T-IL-24载体酶切鉴定及测序结果
PMD-18T-IL-24载体酶切后琼脂糖凝胶电泳可见在639 bp左右有一条带,与 IL-24基因片段大小一致,见图2。将此质粒送上海生工进行测序。结果表明IL-24成功克隆入T载体。
2.3 重组质粒pcDNA3.0-OSP-1的酶切鉴定及测序结果
质粒pcDNA3.0、pcDNA3.0-OSP-1分别经BamHⅠ和XhoⅠ双酶切后,琼脂糖凝胶电泳可见在466 bp左右有一条带,与OSP1基因启动子片段大小一致,在670 bp左右有一条带,与CMV启动子与增强子片段大小一致,见图3。将重组质粒送上海生工进行测,结果表明OSP-1基因启动子片段成功克隆入pcDNA3.0中并替换CMV启动子与增强子片段,OSP-1基因启动子调控基因表达的真核表达载体的构建成功。
2.4 重组质粒pcDNA3.0-OSP-1-IL-24的酶切鉴定结果
重组质粒pcDNA3.0-OSP-1-IL-24经BamHI和Xho I双酶切后,琼脂糖凝胶电泳可见在639 bp左右有一条带,与 IL-24基因片段大小一致,见图4。表明IL-24基因成功克隆入pcDNA3.0-OSP-1中,OSP-1基因启动子调控IL-24基因表达的真核表达载体构建成功。
3 讨论
肿瘤基因治疗时,外源基因可非特异性转染正常细胞并进行表达,引起一系列毒性反应,严重限制了其在临床上的应用。如何提高其靶向性成为近年研究新热点,目前主要集中于对特异启动子及靶向基因的研究。OSP-1是Selvakumaran等[1]从小鼠卵巢中提取的卵巢特异启动子,它可以激活正常卵巢细胞、卵巢癌细胞的基因表达,体外实验证实OSP-1能有效促进卵巢起源的上皮细胞系基因的表达。Bao等[2]应用OSP-1调控 HSV-tk基因,实验结果显示能该系统使自杀基因在卵巢肿瘤细胞中选择性地表达,具有强大的抗肿瘤活性。
有了特异的启动子,我们还需要一个理想的外源基因。IL-24又称黑色素瘤分化相关基因-7(melanoma differentiation associated gene-7,MDA-7),是Jiang[3]等于1995年利用差式杂交技术在黑色素瘤细胞株HO-1中分离的,属于IL-10家族成员。其主要阅读框架编码一种由206个氨基酸组成的蛋白质,分子量为23.8KD。主要在脾、胸腺、外周血白细胞、单核细胞等免疫组织和分化的黑色素细胞中表达,是一种重要的免疫因子,有抗肿瘤免疫功能。Sarkar等[4]研究证明 IL-24通过复制缺陷型腺病毒为载体的MDA-7基因(Ad-mda-7)介入不同的人类肿瘤细胞可引起这些肿瘤细胞的凋亡,而对正常的成纤维细胞和上皮细胞没有毒副作用。Su等[5]发现IL-24可产生抗肿瘤-旁观者效应,这种能力使mda-7/IL-24不仅能直接治疗肿瘤局部,而且对远处转移的病灶也可能起效。
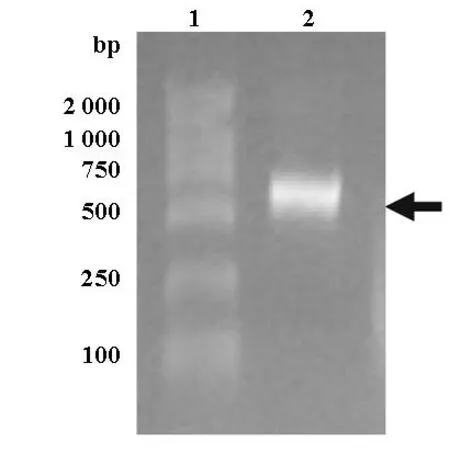
图1 IL-24基因PCR产物1%琼脂糖凝胶电泳图
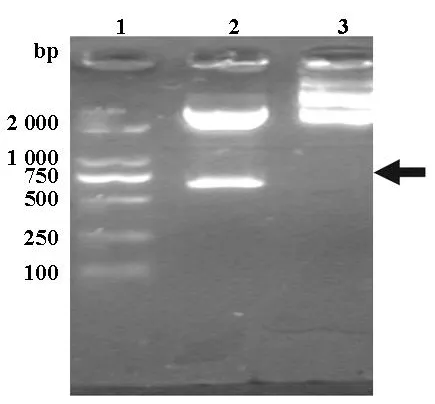
图2 PMD-18T-IL-24载体酶切1%琼脂糖凝胶电泳图

图3 pcDNA3.0-OSP-1的酶切1%琼脂糖凝胶电泳图
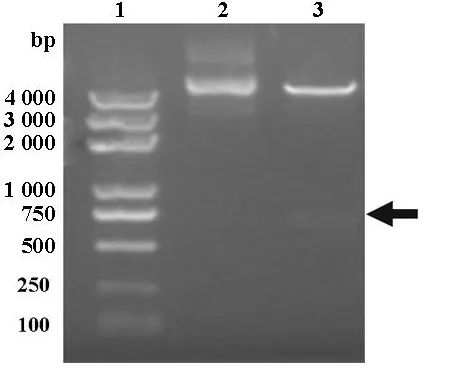
图4 pcDNA3.0-OSP-1-IL-24的酶切1%琼脂糖凝胶电泳图
IL-24是通过诱导肿瘤细胞凋亡、抗肿瘤-旁观者效应及刺激免疫系统应答三者协调作用的方式来发挥抗肿瘤效应。mda-7/IL-24良好的选择性抗肿瘤能力使其成为一种十分理想的抗癌基因药物。如何巩固及加强它的抗肿瘤能力以及联合其它常规肿瘤治疗手段来增强其临床效能,将持续成为研究热点。现有许多研究发现,有一些方法或制剂能增强mda-7/IL-24的抗肿瘤能力,包括:联合放疗、化学制剂和药物、单克隆抗体、基因联合和靶向基因运送等。本实验根据文献报道及 GenBank中OSP-1和IL-24基因序列查询结果,化学合成了OSP-1启动子片段及IL-24的扩增引物,并加入相应的酶切位点。通过PCR方法从人外周血基因组中钓取了IL-24基因。以pcDNA3载体为骨架,将OSP-1启动子片段克隆入pcDNA3.0中并替换CMV启动子,使该载体具有靶向卵巢癌细胞表达的能力。在此基础上,又将IL-24基因克隆入pcDNA3.0-OSP-1中,成功构建了卵巢特异启动子OSP-1调控下的肿瘤特异性靶向基因 IL-24的真核表达载体pcDNA3.0-OSP-1-IL-24。该载体体现了基因治疗主动靶向和被动靶向的结合,为加强IL-24特异性抗肿瘤能力及实现卵巢癌基因治疗的针对性和安全性提供实验基础。
[1]Selvakumaran M,Bao R,Crijns AP,et al.0varian epithelial cell lineagespecific gene expression using the promoter of a retrovirus-like element[J].Cancer Res,2001,61(4):1291.
[2]Bao R,Selvakumaran M,Hamilton TC,et al.Targeted gene therapy of ovarian cancer using an ovarian-specific promoter[J].Gynecol Oncol,2002,84(2):228.
[3]Jiang H,Lin JJ,Su Z Z,et al.Subtraction hybridization identifiesa novel melanoma differentiation associated gene,mda-7,modulated during human melanoma differentiation,growth and progression[J].Oncogene,1995,11(12):2477.
[4]Sarkar D,Su Z Z,Lebedeva IV,et al.MDA-7(IL-24)mediates selective apoptosis in human melanoma cells by inducing the coordinated overexpression of the GADD family of genes bymeansof P38MAPK[J].Proc Natl Acad Sci USA,2002,99(15):10054.
[5]Su Z,Emdad L,Sauane M,et al.Unique aspectsof mda-7/IL-24 antitumor bystander activity:establishing a role for secretion ofmda-7/IL-24 by normal cells[J].Oncogene,2005,24(51):7552.

