临床分离大肠埃希菌耐药机制和基因分型研究
王凤平,陈 清,吴奎海,俞守义,王 前,芮勇宇*
(南方医科大学1.南方医院检验科;2.公共卫生与热带医学学院流行病学系,广东广州510515)
大肠埃希菌是临床分离最常见的病原菌之一。近年来由于抗生素的广泛应用及滥用,大肠埃希菌的耐药情况越来越严重,多重耐药的菌株越来越多[1,2],给临床治疗带来了极大的困难。为此,本研究对临床分离大肠埃希菌药敏进行分析,并对其耐药机制进行研究,如整合子、插入序列共同区(insertion sequences common regions,ISCR/orf513)和产超广谱β-内酰胺酶(extended-spectrumβ-lactamases,ESBLs)等,同时用肠杆菌科间的重复序列(Entrobacter repetive intergenic consensus,ERIC)-PCR对菌株基因多态性进行研究。
1 材料与方法
1.1 材料
1.1.1 菌株 2008年7月-2009年6月从本院患者送检标本中分离出535株大肠埃希菌,经BD pheonix 100全自动微生物分析仪进行鉴定及药敏实验。从中选出99株进行整合子、ISCR、ESBLs(TEM、SHV、CTX)研究及分析,阳性对照为预实验中 PCR阳性并经测序验证的菌株,菌株号为NF813152(I类整合酶),NF511434(ISCR),NF601074(TEM),NF5274(SHV)和NF512990(CTX),阴性对照为大肠埃希菌标准株ATCC25922。
1.1.2 试剂 dNTPs、TaqDNA聚合酶、蛋白酶 K和DNA Marker由大连瑞真生物技术有限公司提供;引物由上海英潍捷基贸易有限公司提供;Tris饱和酚、氯仿、10%十二烷基硫酸钠(SDS)等由广州鼎国生物技术有限公司提供。
1.1.3 仪器 Eppendorf公司的DNA扩增仪;Bio-Rad公司的凝胶成像仪。
1.2 方法
1.2.1 药敏分析 用WHONET5.4分析535株大肠埃希菌的药敏情况,用SPSS13.0统计软件进行χ2检验。
1.2.2 菌株基因组DNA的抽提 用SDS-蛋白酶 K-酚-氯仿方法进行提取。
1.2.3 PCR检测整合子、ISCR、ESBLs(TEM、SHV、CTX)基因 引物见表1,反应体系总体积20μl,其中10×PCR缓冲液 2μl,MgCl21.25μl,dNTP 1.6μl,引物各0.5μl,DNA模板0.5μl,TaqDNA聚合酶1 U,灭菌双蒸水14μl。I类整合酶的反应条件为95℃预变性5min;94℃变性30 s,50℃退火40 s,72℃延伸40 s,30个循环;72℃延伸5 min。ISCR的反应条件为95℃预变性5min;94℃变性30 s,55℃退火30 s,72℃延伸30 s,30个循环;72℃延伸5min。ESBLs的反应条件为95℃预变性5 min;94℃变性30 s,60℃退火30 s,72℃延伸1 min,35个循环;72℃延伸5 min。PCR产物在1.5%的琼脂糖凝胶中(含0.5μg/ml溴化乙锭),电压5 V/cm,电泳20分钟,凝胶成像仪观察结果。

表1 研究整合子、ISCR、ESBLs所用引物
1.2.4 PCR阳性株的测序验证 对 PCR阳性的TEM、CTX各随机抽取3株,及1株SHV进行测序,在GenBank上比对分析。
1.2.5 用ERIC-PCR对99株大肠埃希菌的基因进行扩增并进行同源性分析 引物序列为 ERIC-2(5’-aagtaagtgactggggtgagcg-3’)[6]。PCR 反应体系如前所述,而反应条件为94℃预变性5 min;94℃变性30 s,52℃退火45 s,72℃延伸4 min,35个循环;72℃延伸10min。PCR产物在1.5%的琼脂糖凝胶中(含0.5 μg/ml溴化乙锭),电压5 V/cm,电泳90 min,凝胶成像仪观察结果,并用SPSS13.0进行聚类分析。聚类分析所用主要参数为:Cluster:Variables;Plots:Dendrogram;Cluster Method:Between-groups linkage;Measure:Interval:Pearson correlation。
2 结果
2.1 535株大肠埃希菌的药敏结果 535株大肠埃希菌中有305株产ESBLs,230株不产 ESBLs,两组耐药情况比较见表2。
2.2 整合子、ISCR、ESBLs基因的检测结果 99株大肠埃希菌中有72株产 ESBLs,27株不产 ESBLs。整合子、ISCR、ESBLs电泳结果见图1-3,阳性结果分析见表3。
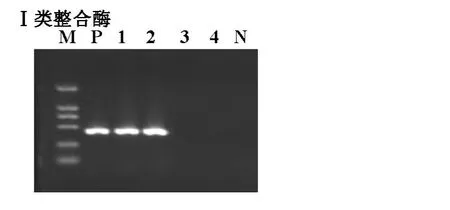
图1 I类整合酶电泳结果
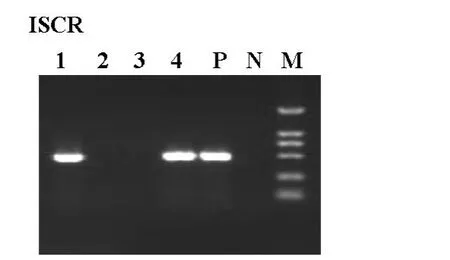
图2 ISCR电泳结果blaTEM
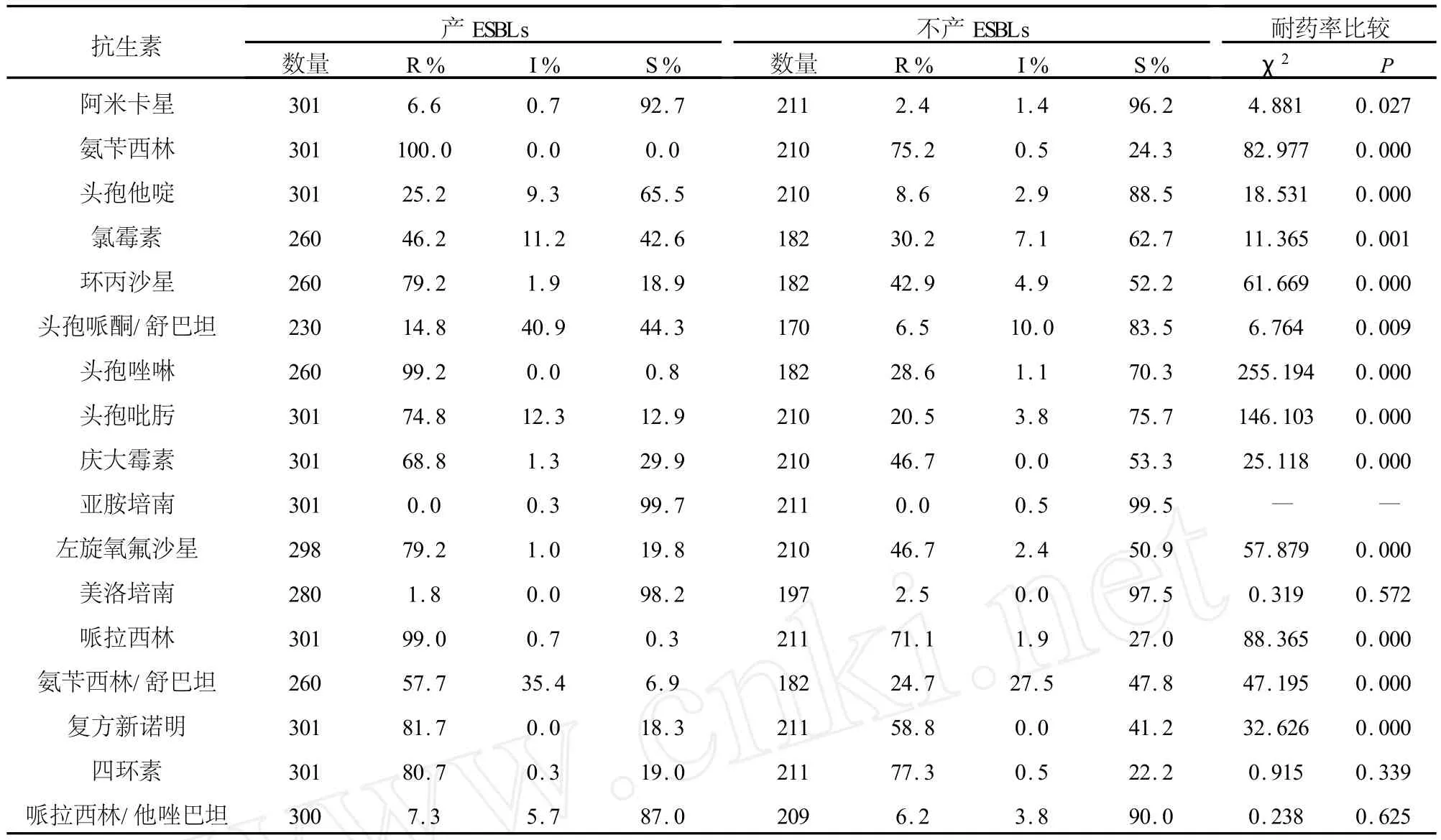
表2 产与不产ESBLs大肠埃希菌药敏结果比较
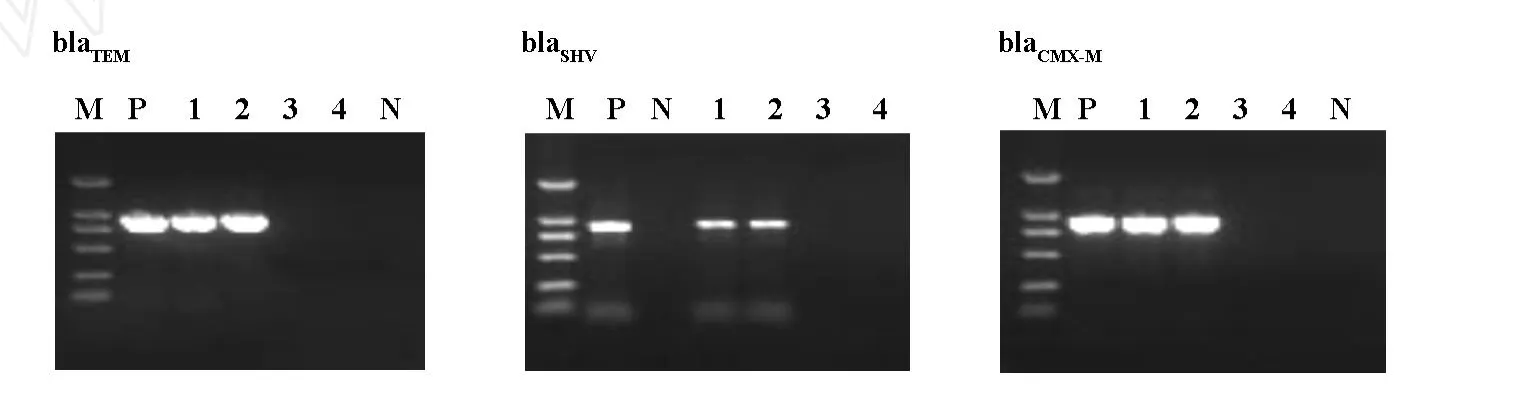
图3 ESBLs电泳结果
表3 I类整合酶、ISCR、ESBLs基因检测结果
2.3 基因分型结果 ERIC-PCR对99株大肠埃希菌的基因分型结果见图4。均能扩增出清晰的DNA指纹图谱。72株产 ESBLs菌株扩增出条带2-14条,27株不产 ESBLs菌株扩增出条带4-12条,两者条带均集中分布在300-3 000 bp。
2.4 系统聚类结果 99株大肠埃希菌的基因型分为79种,经SPSS分析,归为18个大类。按指纹图的18类进行比较,具体见表4。另外10株ISCR阳性株分别属于 2、3、4、7、8、10、15、16 和 18 类。
3 讨论
图4 99株大肠埃希菌ERIC-PCR结果
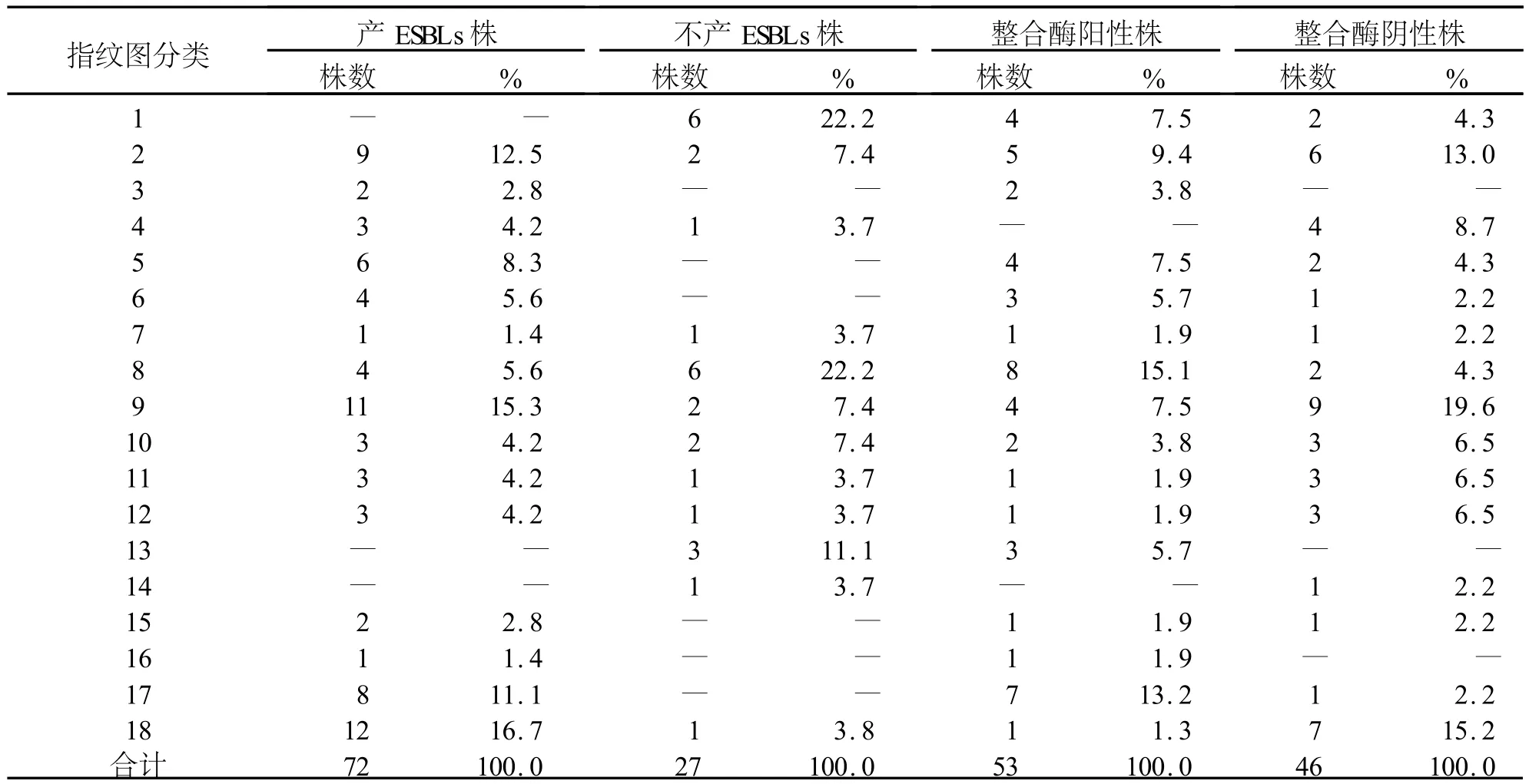
表4 99株大肠埃希菌指纹图系统聚类结果
近年来,大肠埃希菌多重耐药情况越来越严重,其耐药机制如整合子、ISCR、ESBLs等研究的比较多。整合子作为一种可移动基因元件,不仅可通过位点特异性重组系统在细菌间播散,而且具有捕获耐药基因盒的功能,使细菌具有耐药性,甚至是多重耐药[7]。整合子的分类主要是根据整合酶的不同来分,因此,一般通过检测整合酶来区分整合子类型。ISCR的名字是由“common regions”(CRs)和“insertion sequences”(ISs)得来的,目前为止,国内尚无统一的定义[8]。ISCR是一类传播耐药基因元件,其中研究最多的是ISCR1,研究表明它与多种耐药基因相关,其还能解释耐药基因移动的实质和耐药基因亚种的增长[8]。大肠埃希菌是主要的产 ESBLs革兰氏阴性杆菌[9]。国内,有报道 ESBLs以SHV和CTX-M为主要基因型,不同亚型的酶也呈区域性分布[10]。这种ESBLs基因型差异可能与不同国家、地区和医院使用第三代头孢菌素的种类、数量及时间不同而造成细菌对ESBLs的诱导产生不同有关。本研究中,产ESBLs株的I类整合酶阳性率明显高于不产 ESBLs株;同时含有I类整合酶和ISCR的有9株,提示整合子和 ISCR可能形成串联关系,共同存在于细菌基因组中,可能共同介导细菌的多重耐药,这还须进一步的研究证明。分析535株大肠埃希菌是否产ESBLs两组的药物敏感性:除亚胺培南、美洛培南、四环素和哌拉西林/他唑巴坦,产 ESBLs菌的耐药率明显高于不产ESBLs菌(P<0.05)。两者对碳青霉烯类药物(亚胺培南和美洛培南)的耐药率最低,说明碳青霉烯类抗生素是目前治疗产ESBLs大肠埃希菌最有效的药物。另外,本研究产ESBLs菌TEM阳性率为80.6%,SHV为0%,CTX-M为36.1%;而不产ESBLs菌TEM阳性率为81.5%,SHV为3.7%,CTX-M为3.7%。从PCR结果可以看到本院产ESBLs菌以TEM和CTX-M为主。但目前为止,我国流行的ESBLs主要是以水解头孢噻肟为主的CTX-M型ESBLs,TEM型ESBLs的报道很少。为了验证本实验的TEM阳性是TEM-1(广谱β-内酰胺酶,非 ESBLs类)还是其它 TEM型 ESBLs,随机抽取三个标本进行测序,在GenBank上比对后发现均为TEM-1,表明我院产ESBLs大肠埃希菌以CTX-M基因型为主。
现在细菌分型用的最多是分子生物学分型方法,如质粒图谱、限制性核酸内切酶图谱、脉冲场凝胶电泳(PFGE)、随机引物 PCR(RAPD)、重复基因外回文序列-聚合酶链式反应(REP-PCR)及 ERIC-PCR等。其中,PFGE的分辨率最好,被誉为基因分型的“金标准”,但由于PFGE需要特殊设备且价格很昂贵,在我国临床实验室广泛应用PFGE进行基因分型及流行病学调查较困难。ERIC-PCR分型技术是在REP-PCR的基础上,以 ERIC为引物进行 PCR的方法,能扩增出多态性的DNA图谱。这种PCR能产生多种独特的扩增产物,可根据扩增产物的电泳条带来区分细菌型别。本研究中,99株大肠埃希菌的分型率为100%,而且各条带能很好的区分出来,分辨率较高。根据结果显示,按是否产 ESBLs来分成两组,产 ESBLs组特有3,5,6,15和16类;而不产 ESBLs组特有1,13和14类,说明是否产 ESBLs的大肠埃希菌的基因型存在一定的差异,产ESBLs株的基因多态性比不产酶株多。虽然ERIC-PCR分型的分辨率虽不及PFGE的高,但其操作简单、经济、简便、重复性较好,在具备进行PCR条件的实验室就可以进行基因分型,是较为理想的流行病学调查方法[11]。从本研究的ERIC-PCR结果来看,99株大肠埃希菌的基因型分为79种,我院大肠埃希菌主要是散发存在。ERIC-PCR的分型率高、分辨率强及重复性好,是一种效果较好的基因分型方法,适合用于临床实验室进行大量标本的基因分型。
[1]魏 东,周洪波,芮勇宇,等.我院近3年临床分离细菌的耐药性变迁分析[J].中国实验诊断学,2008,12(6):733.
[2]芮勇宇,耿穗娜,王 前,等.5504株临床分离细菌和念珠菌的分布及耐药性分析[J].中国实验诊断学,2007,11(12):1651.
[3]顾 兵,童明庆,刘根焰,等.整合子介导大肠埃希菌和克雷伯菌多重耐药机制的研究[J].中华检验医学杂志,2006,29(8):725.
[4]QuirogaM P,Andres P,Petroni A,etal.Complex class1 integronswith diverse variable regions,including aac(6’)-Ib-cr,and a novel allele,qnrB10,associated with ISCR1 in clinical enterobacterial isolates from Argentina[J].Antimicrob Agents Chemother,2007,51(12):4466.
[5]Kiratisin P,Apisarnthanarak A,Laesripa C,etal.Molecular characterization and epidemiology of extended-spectrum-beta-lactamase-producing Escherichia coli and Klebsiella pneumoniae isolates causing health care-associated infection in Thailand,where the CTX-M family is endemic[J].Antimicrob Agents Chemother,2008,52(8):2818.
[6]Munoz M A,Welcome FL,Schukken YH,etal.Molecular epidemiologyof two Klebsiella pneumoniaemastitisoutbreakson a dairy farm in New York State[J].JClin Microbiol,2007,45(12):3964.
[7]Mazel D.Integrons:agentsof bacterial evolution[J].Nat Rev Microbiol,2006,4(8):608.
[8]Toleman M A,Bennett PM,Walsh T R.ISCR elements:novel gene-capturing systems of the 21st century[J].Microbiol Mol Biol Rev,2006,70(2):296.
[9]姜 森,张 正,杨 朵,等.2062株大肠杆菌 ESBL测定及耐药分析[J].中国实验诊断学,2008,12(9):1134.
[10]Oksuz L,Gurler N.Typing of extended-spectrum beta-lactamases in Escherichia coli and Klebsiella spp.strains and analysisof plasmid profiles[J].Mikrobiyol Bul,2009,43(2):183.
[11]Wardak S,JagielskiM.Evaluationof genotypic and phenotypicmethods for the differentiation of Campylobacter jejuni and Campylobacter coli clinical isolates from Poland.II.PFGE,ERIC-PCR,PCR-flaA-RFLP and MLST[J].Med Dosw Mikrobiol,2009,61(1):63.

