结缔组织生长因子和金属蛋白酶组织抑制因子-1 RNA干扰靶位的筛选*
蒋玉凤 黄 飞 张建军 刘加群 孙华丽
肝纤维化是多种原因引起的慢性肝损伤所共有的病理学改变,是细胞外基质(extracellular matrix,ECM)合成增多、降解不足而在肝内过量沉积的结果[1]。TGF-β及其信号传导途径在肝纤维化发生机制中起着关键作用,TGF-β信号诱导结缔组织生长因子(connective tissue growth factor,CTGF) 的表达而促进ECM的合成,诱导金属蛋白酶组织抑制因子-1(tissue inhibitor of metalloproteinase-1,TIMP-1)表达,阻断基质金属蛋白酶(matrix metalloproteinase,MMPs)对 ECM 的降解[2~4]。RNA 干扰是目前最有效的基因沉默技术,能特异性抑制靶基因的转录,进而下调相应蛋白水平及功能。RNAi靶序列的选择很关键,所以,RNA干扰实验通常需要针对一个基因设计多个靶序列的小干扰RNA(small interfering RNA,siRNA),以找到最有效的 siRNA 序列[5,6]。本研究旨在针对CTGF和TIMP-1目的基因分别设计3条siRNA,通过转染肝星状细胞(hepatic stellate cell,HSC)以筛选有效的抑制序列,为进一步研究CTGF和TIMP-1在肝纤维化发生中的作用以及探索肝纤维化的基因治疗奠定基础。
材料与方法
一、细胞与试剂 大鼠HSC-T6由我院中心实验室冻存;新生小牛血清购自杭州四季青公司;RNA抽提试剂TRIZOL购自上海生工公司;CTGF、TIMP-1RNA干扰序列由上海生工公司合成;CTGF、TIMP-1、GAPDH、I型前胶原(Procol-α1)、无关序列(silence)引物由上海博尚生物技术有限公司合成;逆转录试剂盒和荧光定量PCR试剂盒购自FINNZYMES公司;转染试剂KeyGenTransIII购自凯基生物科技发展公司;III型前胶原、粘连蛋白、透明质酸放射免疫分析试剂盒购自上海海研医学生物技术有限公司;TGF-β1购自美国Cytokines公司。
二、大鼠CTGF和TIMP-1基因干扰靶位设计 在NCBI Gen Bank数据库中,在线查询大鼠CTGF和TIMP-1基因序列。CTGF基因序列的Accession number为 AF120275;TIMP-1基因序列的Accession number为NM-053819。然后,在晶赛公司网站在线设计RNA干扰靶位,通过计算机软件,各选取3段,同时设计阳性对照(GAPDH/r基因干扰靶位)和阴性对照(无关干扰序列),见表1。

表1 基因靶序列
三、PCR引物的设计 ①大鼠CTGF(预计产物483bp):上游引物:5’-GCCTCGCCTTGGTGCTCCTCCTCT-3’;下游引物:5’-TGCGGTCCTTGGGCTCATCACAC-3’;②大鼠 TIMP-1(预计产物 308bp):上游引物:5’-GCGCCCTTTGCATCTCTGG-3’,下游引物:5’-TCGCTGCGGTTCTGGGACTT-3’;③大鼠看家基因GAPDH(预计产物 570bp):上游引物:5’-CATAGACAAGATGGTGAAGG-3’,下游引物:5’-TCCACAGTCTTCTGAGTGGC-3’;④大鼠 Procol-α1(预计产物409bp):上游引物:5’-AGCCCCTCAACCCCCAGCCTACTT-3’,下游引物:5’-CCCACCCCACCCCTTCACAGAGAT-3’。
四、dsRNA转染TGF-β1活化的HSC 分组转染已经TGF-β1刺激活化的HSC:每组5μg dsRNA分别与490μl无血清无抗生素的低糖DMEM培养液混匀后,再加入10μl转染试剂KeyGenTrans III,最终获得500μl的转染复合物,加入细胞培养液中,37℃、5%CO2孵育、转染细胞 48h。分组:CTGF-1、CTGF-2、CTGF-3、TIMP-1-1、TIMP-1-2、TIMP-1-3、CTGF-1/TIMP-1-1、CTGF-1/TIMP-1-2、CTGF-1/TIMP-1-3、CTGF-2/TIMP-1-1、CTGF-2/TIMP-1-2、CTGF-2/TIMP-1-3、CTGF-3/TIMP-1-1、CTGF-3/TIMP-1-2、CTGF-3/TIMP-1-3、阴性对照组(no-sense)和空白对照组(不加dsRNA)。每组设3个复孔,取均值。
五、HSC总RNA的抽提与逆转录成cDNA 分别进行细胞裂解和RNA的分离、沉淀、洗脱、再溶解,并逆转录成cDNA。
六、目的基因相对表达量的检测 采用荧光定量 PCR法,反应体系如下:DyNAmo YBRGreenMastermi×25μl,上下游引物各 2μl,cDNA 5μl,灭菌水 16μl,总体积 50μl。各反应管放入荧光定量PCR仪(iCycler,BIO-RAD),按以下条件扩增:94℃,5min→(94℃,30s→60℃,30s→72℃,45s)×40个循环→72℃,10min。在PCR循环第2步72℃时收集荧光信号,由计算机软件自动分析、计算出Ct值。采用比较阈值法[7]计算待测目的基因的相对表达量,设阴性对照目的基因的表达量为1,则所得比值为实验组相对于阴性对照组基因表达量的倍数。然后,按照下列公式计算抑制率。

七、肝纤维化指标检测 收集转染48小时后HSC培养上清液,检测III型前胶原(procollagen type-III,PCIII)、透明质酸(hexadecenoic acid,HA)、粘连蛋白(laminin,LN)含量,使用智能放免测量仪(SN-695B)完成定量分析。
结果
一、RNA干扰对靶基因及其下游产物Procolα1mRNA表达的影响 见表2。

表2 各干扰组对靶基因和procol-α1mRNA表达的抑制作用
二、肝纤维化指标的变化 见表3。
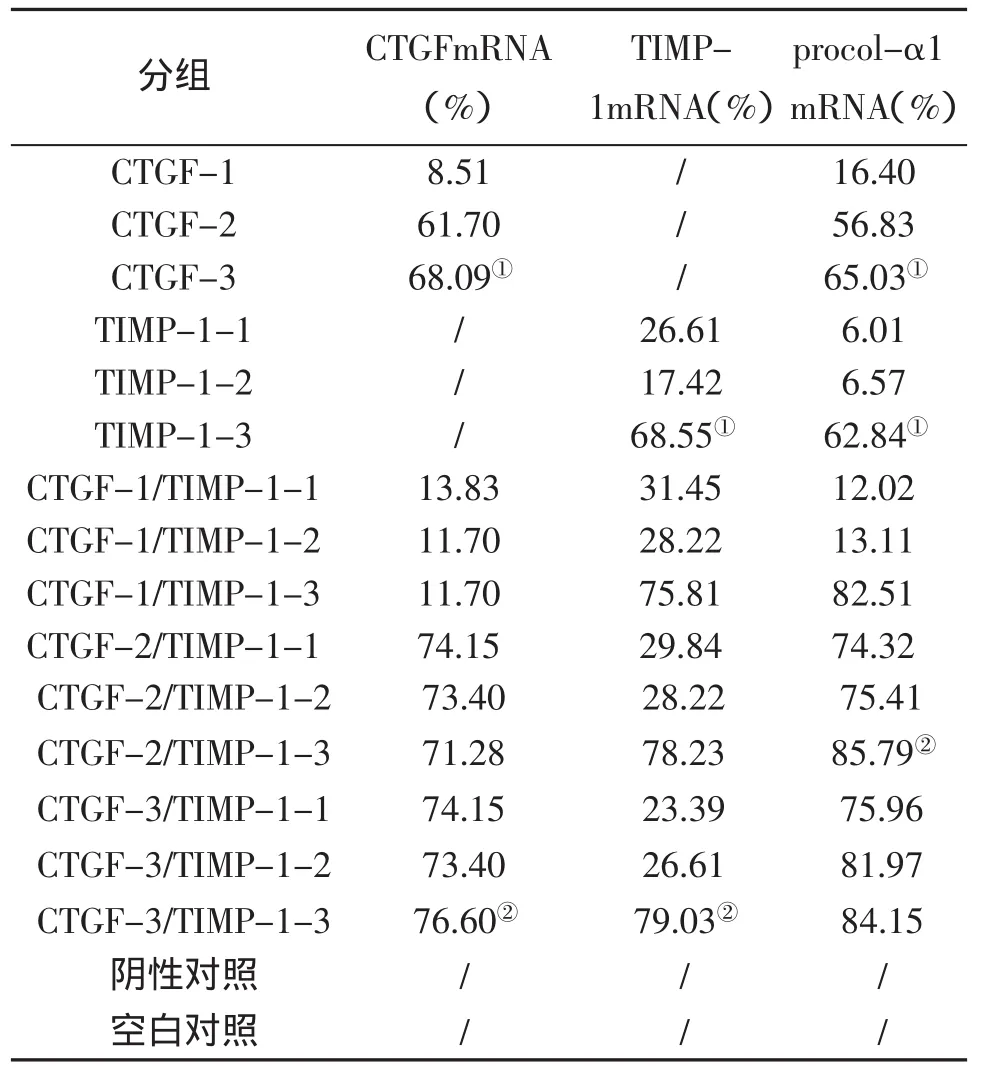
表3 各干扰组PCIII、HA和LN水平(ng/ml)的变化
讨论
TGF-β及其信号转导途径在肝纤维化发生机制中起着关键作用[8~10]。CTGF 和 TIMP-1 是 TGF-β 信号通路之下游分子,前者促进ECM合成,后者抑制ECM降解,在肝纤维化发生过程中发挥协同促进作用。
本实验目的在于采用针对介导HSC活化的关键因子CTGF和TIMP-1的siRNA双重干扰,阻断CTGF和TIMP-1的促肝纤维化形成作用,以探讨肝纤维化的发病机制和防治方法。
我们针对每条目的基因分别设计了3个siRNA干扰候选靶位,分别转染或不同组合后转染经TGF-β1刺激活化的大鼠肝星状细胞,结果显示每组CTGF-dsRNA可高效抑制CTGF及其下游产物procol-α1的表达,每组TIMP-1-dsRNA也可高度抑制TIMP-1及其下游产物procol-α1的表达,但不同的干扰靶位干扰效果有较大差异。CTGF和TIMP-1不同靶位RNA联合干扰后,对 CTGFmRNA、TIMP-1mRNA 和 procol-α1mRNA 表达的抑制效果较单独干扰的抑制效果更强,说明联合应用针对一个基因的多个siRNA,或同时干扰几个基因,阻断其生命周期的多个环节,能产生协同作用,并有可能减少由于点突变造成的对iRNA治疗的耐受。另外,我们发现联合干扰后,CTGF-3/TIMP-1-3组对CTGFmRNA和TIMP-1mRNA的抑制作用最强,而对procol-α1mRNA的抑制作用最强的却是CTGF-2/TIMP-1-3组,可能与iRNA抑制的靶基因有关,尚需以后做进一步的研究证实。肝纤维化指标检测也提示CTGF-3组和TIMP-1-3组单独抑制PC III型、HA、LN最佳,而联合干扰时,以CTGF-2/TIMP-1-3组对III型胶原、HA、LN的抑制作用最强。
由于机体的复杂性,ECM的合成和降解还受到许多因素的影响。因此,应进一步观察CTGF和TIMP-1与TGF-β信号转导的关系,不仅有助于进一步阐明CTGF和TIMP-1在肝纤维化发生中的作用机制,也可能为肝纤维化的防治研究提供重要的途径。
[1]丁宁.肝纤维化形成机制的研究进展[J].临床肝胆病杂志,2009,25(1):73-77.
[2]王燕艳.转化生长因子-β与肝纤维化[J].实用医技杂志,2010,17(5):436-437.
[3]罗丽卿,吴平.肝星状细胞结缔组织生长因子靶向siRNA与肝纤维化治疗的研究进展[J].广东医学院学报,2009,27(3):305-306.
[4]孙华丽,张建军.组织金属蛋白酶及其抑制因子与肝纤维化[J].西南军医,2010,12(1):81-83.
[5]MIYAGISHI M,TAIRA K.U6 promoter-driven siRNAs with four uridine 3'over-hangs efficiently suppress targeted gene expression in mammalian cell[J].Nat Biotechnol,2002,20(5):497-500.
[6]REYNOLDS A,LEAKE D,BOESE Q,et al.Rational siRNA design for RNA interference[J].Nat Biotechnol,2004,22(3):326-330.
[7]余蓉,陈汉平,严小芳.单细胞实时荧光定量PCR结合比较阈值法在诊断唐氏综合征中的应用[J].中华医学遗传学杂志,2007,24(2):200-202.
[8]中华医学会肝病学分会和感染病学分会.慢性乙型肝炎防治指南[J].实用肝脏病杂志,2006,9:8-18.
[9]LIU X,HU H,YIN JQ.Therapeutic strategies against TGF-beta signaling pathway in hepatic fibrosis[J].Liver Int,2006,26(1):8-22.
[10]CHEN MH,CHEN JC,TSAI CC,et al.The role of TGF-beta 1 and cytokines in the modulation of liver fibrosis by Sho-saikoto in rat's bile duct ligated model[J].J Ethnopharmacol,2005,97(1):7-11.

