64层螺旋CT对门静脉海绵样变性的诊断价值*
李金平 赵德利 王彦民 李大庆 李艳英 姜慧杰
随着各种先进的影像学诊断技术的临床应用,曾被认为是罕见和疑难的门静脉海绵样变性(Cavemous transformation of portal vein,CTPV)现已越来越多地被诊断出来。64层螺旋CT因时间和空间分辨力的极大改进以及血管三维重建技术的实现,能直观、全面、准确、清晰地显示血管的起止和走行路线、毗邻关系及病变情况[1],在诊断CTPV方面具有其他影像学检查无法比拟的价值。我们使用64层螺旋CT门静脉成像技术诊断了22例CTPV患者,现对资料进行分析、报道如下。
资料与方法
一、一般资料 我科2008年10月~2010年11月诊断的继发性CTPV患者22例,男15例,女7例,年龄35~68岁,平均年龄45岁。经CT检查并经DSA和(或)手术后组织病理学检查证实。原发病为原发性肝癌并发门静脉癌栓10例(8例有肝硬化基础),肝硬化4例,肝门区胆管细胞癌1例,胆囊癌1例,肝动静脉畸形2例,胰腺癌2例,病因不明2例。
二、检查方法 使用GE Lightspeed VCT 64层螺旋CT扫描仪,检查前禁食6~12h,口服温水600~800ml,充盈胃肠道,但急性出血患者不饮水。在扫描时,嘱患者屏住呼吸。扫描参数:电压120kV,电流220~280mAs,层厚 5mm,Pitch 0.984,旋转时间 0.5s。患者仰卧位,先行常规平扫,扫描范围从膈肌顶至髂骨翼上缘水平。增强扫描:使用Medrad双筒高压注射器,经肘正中静脉团注非离子型碘对比剂碘海醇(300mgI/m1),剂量为 1.5ml·kg-1,速率 3.0~3.5ml/s,随即用生理盐水20ml以同样速率注入。采用Smartprep测腹主动脉腹腔干水平对比剂浓度。设肝动脉期启动阈值为150HU,肝动脉期与门静脉期间隔时间为18s,门静脉期与肝静脉期间隔时间为19~36s。
三、图像分析 采用软组织函数重建法,层厚1.25mm,重建间隔0.625mm,所有图像均传送到GE ADW 4.3工作站,用3D后处理软件最大密度投影(maximum intensity projection,MIP)、容积再现(volume rendering,VR)、多平面重建(multi-planar reconstruction,MPR)等技术对门静脉期图像进行血管成像,并根据需要对病变区进行任意旋转和切割。所有患者的CT资料均经两名影像科医师进行独立诊断。对诊断结果有分歧者,再经过全科讨论,达到一致。正常门静脉系统血管未见显示或其内有栓塞、周围见到大于3个以上的血管断面者,则诊断为CTPV。
结果
一、后处理成像表现 本组22例CTPV均进行了最大密度投影(MIP)和多平面重建(MPR)图像后处理,均能清楚地显示CTPV及其与周围脏器的关系。调节阈值后,9例(40.91%)CTPV在VR上显示,其余13例(59.09%)因门静脉期侧支血管内对比剂密度与增强后肝实质CT值差异较小,门静脉系统及其侧支血管难以进行VR成像。
二、门静脉CT表现 22例CTPV患者在平扫片上见肝门区正常门静脉结构消失11例,增粗11例,周围代之以多发纡曲的团块状和结节状软组织影。在门静脉期及重建图像上,11例患者门静脉主干和(或)左右分支增粗,主干最大径约2.65cm,2例门静脉主干、右支在正常范围内,其内均可见条状或类圆形充盈缺损;4例门静脉因栓塞广泛而致正常结构消失,形态显示不清;4例门静脉主干变细(图1),其最大直径约为0.9cm;1例门静脉主干受侵致管腔狭窄,管壁增厚。

图1 门静脉系VR像 门静脉主干及其分支不明原因广泛狭窄,主干变细(箭头)
三、侧支循环CT表现
(一)门-门侧支血管22例:胆管周围静脉丛曲张19例(图2);胆囊静脉丛曲张17例(图3),向肝内门静脉左支供血的胃左静脉曲张2例。
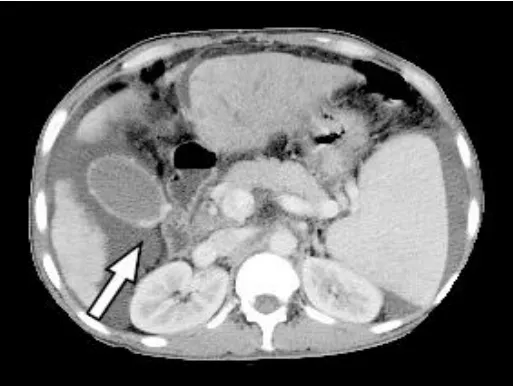
图2 门静脉系MPR像 胆管周围静脉明显扩张迂曲胆管管腔受压变窄(白箭头),食管静脉扩张,致下纵隔增宽(黑箭头)
(二)门-体侧支血管17例:向食管胃底供血的胃左静脉曲张13例(图4),食管胃底静脉曲张17例,食管旁静脉曲张9例(图2),腹膜后椎体旁静脉曲张2例,脐静脉伴腹壁静脉曲张14例,腹膜后静脉曲张5例(图6),脾静脉扩张10例(图4),合并脾动脉瘤2例。
四、其他表现 3例肝固有动脉管径增粗、僵直或扭曲,远端分支显示增强,于肝周边区域可见增粗的肝动脉分支;6例肝实质灌注异常,动脉期肝脏实质边缘局部斑片状、带状异常强化区,肝门区密度偏低,门静脉期均呈等密度。肥大萎缩综合征7例;5例患者胆总管和(或)左右肝管不同程度的扩张。1例胆囊壁不规则偏心性增厚,17例患者胆囊壁锯齿样不均匀增厚(图3),3例胆管壁增厚,管腔轻中度狭窄(图2)。8例腹水,12例脾肿大,20例见不同强化的原发性肿瘤的CT表现。
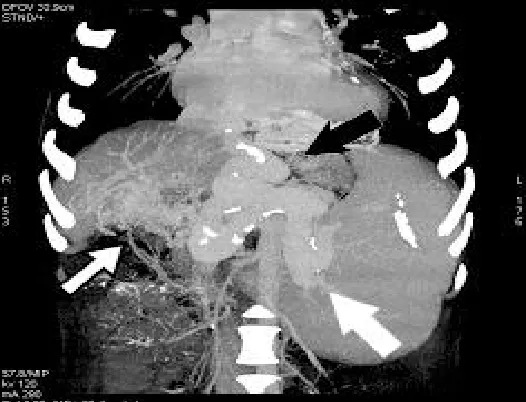
图4 门静脉系MIP像 门静脉主干及其分支变细,肝门区胆管静脉扩张(细箭头);脾静脉及胃左静脉明显曲张(粗头箭)
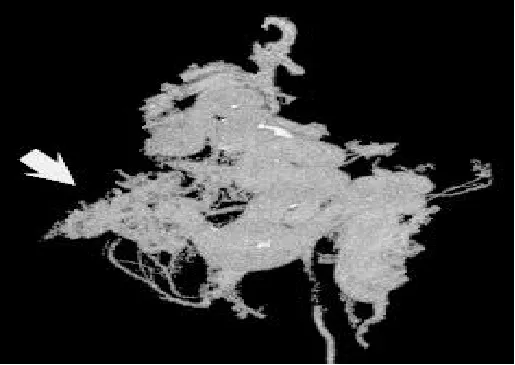
图5 门静脉系VR像 门静脉及肝内分支显示清晰(箭头),脾静脉及胃左静脉走行迂曲,形象、立体、直观

图6 轴位像 腹膜后可见结节状、串珠状增粗的血管影(箭头)
讨论
1869年,Balfour最早提出了CTPV的概念,曾被称为肝门海绵状血管瘤(portal cavernoma)[2],定义为门静脉主干和(或)其分支完全或部分阻塞后,在其周围形成大量侧支静脉或阻塞的再通,是门静脉系统在肝脏血供长期异常时,为恢复或增加向肝灌注,通过自体调节机制而形成的病理性代偿。CTPV的病理过程为[3]门脉或其分支完全或部分堵塞后,门脉压力增高,正常关闭的门脉旁小静脉或毛细血管丛压力增高,一方面促成其向肝性静脉形成侧支通路,以补偿门脉血供不足,即其内血流方向为向肝性的;另一方面,为缓解门脉高压,降低门脉系统压力,侧支循环也可分流一些门脉血流至体循环,即形成门-体侧支循环,其内血流方向为离肝性的。
CTPV的病因分为原发性和继发性。原发性较少,以儿童相对多见,病因至今尚有争论,多数学者认为原发性CTPV由先天性畸形所致。继发性以成人多见,引起门静脉栓塞的最常见原因是癌栓,约占57%,癌栓多来自肝、胆、胰、胃肠道肿瘤及肝转移性肿瘤,本组癌栓约占59.09%;其次是脾切除、肝移植等手术,门静脉炎、肝门周围纤维组织炎、血栓形成,凝血疾病(红细胞增多症)、胰腺炎、肝静脉阻塞性疾病等也可引起[4,5];少数由门静脉腔外病变推挤和(或)侵犯门静脉所致,CT表现为门静脉走行区异常软组织病灶侵犯门静脉,造成门静脉狭窄或闭塞,本组仅见1例。继发于妊娠的海绵样变性也有报道[6],此种病因少见。本组20例为继发性,2例病因不明。
门脉海绵样变开放的侧支循环有门-门侧支及门-体侧支两大体系[7]。门-体侧支常见的主要有胃底食管静脉、腹壁静脉、食管旁静脉丛、腹膜后椎体旁静脉丛、脾肾分流静脉、脐静脉及肠系膜下静脉的侧支血管如直肠周围静脉丛等[8]。
本组肝实质灌注异常6例(27.27%),这可能与门静脉和/或分支的栓塞范围、狭窄程度有关,也可能与肝脏肿瘤本身血供特点有关[9]。Valerie等[10]曾报道肥大萎缩综合征,即肝尾叶肥大,左叶外侧段萎缩和Ⅳ段正常或萎缩,此即肝实质灌注异常的结果。
CTPV伴发的胆系改变,其病理基础为CTPV形成侧支循环中的胆囊周围静脉丛紧贴胆囊及胆总管,扩张、纡曲的静脉丛引起胆囊、胆管壁增厚及胆总管受压呈波浪状甚至结节状,并可致胆管不规则狭窄,形成所谓的“假性胆管癌征”,少数可引起阻塞性黄疸[11]。
门脉海绵样变是一种继发于门脉闭塞性疾病的病理改变,由于其缺乏特异性的临床征象[12],目前对其诊断主要依靠医学影像学检查。64层螺旋CT采用超薄层厚扫描,并利用软件对图像的后处理三维重建、重组技术,能准确显示CTPV的部位、范围,可优化门静脉侧支循环的显示,有助于观察侧支静脉的立体概貌,可作为诊断CTPV的首选方法。
[1]殷小平,李彩莫,封海龙,等.多层螺旋CT对门静脉海绵样变的诊断价值[J]. 放射学实践,2008,23(2):175-178.
[2]BALFOUR GW,STEWART G.Case of enlarged spleen complicated with ascites,both depending upon varicose dilatation and thrombosis of the portal vein[J].Edinb Med J,1869,14:589-599.
[3]杨大为,周诚,杨正汉,等.多层螺旋CT评价门静脉海绵样变的血流动力改变[J].实用放射学杂志,2009,25(9):1282-1285.
[4]CHANG YS,MIN SY,JOO SH,et al.Septic thrombophlebitis of the porto-mesenteric veins as a complication of acute appendicitis[J].World J Gastroenterol,2008,14(28):4580-4582.
[5]FERGUSON JL,HENNION DR.Portal vein thrombosis:an unexpected finding in a 28-year-old male with abdominal pain[J].J Am Board Fam Med,2008,21(3):237-243.
[6]WAX JR,PINRTTR MG,CARTIN A,et a1.Cavernous transformation of the portal vein complicating pregnancy[J].Obstet Gynecol,2006,108(3):782-784.
[7]GALLEGO C,VELASCO M,MARCUELLO P,et al.Congenital and acquired anomalies of the portal venous system[J].Radiographics,2002,22(1):141-159.
[8]KANG HK,JEONG YY,CHOI JH,et al.Three dimensional multi-detector row CT portal venography in the evaluation of portosystemiccollateralvesselsin livercirrhosis[J].Radiographics,2002,22(5):1053-1061.
[9]刘于宝,胡道予,夏黎明,等.门静脉海绵样变性的MRI诊断[J].临床放射学杂志,2004,23(4):305-308.
[10]VALERIE V,BERTRAND C,CHRISTOPHE B,et a1.Atrophyhypertrophy complex in patients with cavernous transformation of the portal vein:CT evaluation[J].Radiology,2006,241(1):149-155.
[11]RUSZINKO V,KOVACS M,SZONYI L,et a1.Cavernous transformation of the portal vein causing jaundice,presenting in the form of Wilson’s disease[J].Acta Chir Belg,2004,104(4):457-458.
[12]SHEEN CL,LAMPARELLI H,MILNE A,et al.Clinical features,diagnosis and out come of acute portal vein thrombosis[J].QJM,2000,93(8):531-534.

