RT-PCR联合检测早期非小细胞肺癌中多基因表达在评估术后化疗疗效的意义
陈瑜 杨立 潘泓 刘德森 茅乃权 黄耀元
广西医科大学附属肿瘤医院胸外科,广西 南宁530021
肺癌已经成为全球癌症患者的首要死因,非小细胞肺癌 (non-small cell lung cancers,NSCLC)占肺癌的85%,其中主要为腺癌、鳞状细胞癌和大细胞癌。Chen等[1]关于中国肺癌流行病学趋势的研究结果显示,2005年我国新增肺癌病例和死亡病例分别为536 407和475 768例,男性多于女性;1988年—2005年期间年均增长1.6%。尽管肺癌的5年生存率从上个世纪60年代早期的8%提高到了90年代早期的15%,但仍有相当大的上升空间。目前,早期NSCLC患者完全切除术后是否需要进行常规辅助化疗仍存在较大的争议。随着分子生物学的发展,人们认识到肿瘤组织细胞表达的改变、结构的改变以及蛋白功能的改变是影响其生物学活性的最根本因素。由于NSCLC进行辅助化疗能否获益是由其分子机制决定的,所以如果有生物标记作为标准来帮助筛选患者进行治疗,不仅能提高疗效,还可避免不必要的药物不良反应。潘泓等[2]从30种化疗相关蛋白中筛选出ERCC1、survivin、bax、VEGF 4个基因,发现其联合检测对早期NSCLC术后化疗疗效的预测特异度达96.5%。本研究在此基础上进一步应用荧光定量PCR技术检测ERCC1、survivin、bax、VEGF基因在早期NSCLC中的表达及其对术后化疗疗效的价值。
1 资料和方法
1.1 临床资料
2004年12月—2009年9月在我院住院并采用肺叶切除+淋巴结清扫手术治疗的87例肺癌患者,年龄35~77岁,均经病理组织学证实为NSCLC。其中鳞癌42例,腺癌26例,腺鳞癌18例,其他癌1例。临床分期采用国际肺癌研究协会(IASLC)2009年第七版分期标准(IASLC 2009),Ⅰ期23例,Ⅱ期64例。所有患者均为首次发现肺癌,术前未行任何化疗和放疗。患者于术后3~4周开始使用以铂类为主的化疗方案,共化疗3~4个周期,疗程结束后,定期随防。根据生存期将87例患者分为2组,存活3年或长于3年者为预后好组(n=41),中位生存期为46个月;存活短于3年者为预后差组(n=46),中位生存期为27个月。
1.2 材料
TRIzol试剂(美国Invitrogen公司);逆转录酶试剂盒(美国Promega公司);PCR试剂(Genstar公司);胶回收试剂盒(杭州BioFlux公司);SYBR Green I 染料(中国Generay公司)。根据GenBank所发布的ERCC1、bax、survivin、VEGF、GAPDH基因序列,应用引物设计软件Primer 5.0设计引物序列,并经GenBank Blast检索无显著同源性。PCR引物合成(上海生物工程技术有限公司),选用GAPDH作为内参。多通道PCR仪(美国MJPT-220);紫外分光光度计(日本岛津SHIMADIU UV-1700);凝胶电泳成像分析系统(美国Bio-Rad公司GelDoc2000型);实时荧光定量PCR仪(美国Bio-Rad公司)。
1.3 方法
1.3.1 引物的设计与合成
NCBI搜索目的基因的序列,用Primer 5.0设计基因的引物。ERCC1上游引物:5’-CCCTGGGAATTTGGCGACGTAA -3’,下游引物:5’-CTCCAGGTACCGCCCAGCTTCC-3’,产物长度:223 bp;survivin上游引物:5’-GCCAGATTTGAATCGCGGGA-3’,下游引物:5’-GCAGTGGATGAAGCCAGCCT-3’,产物长度:1 8 5 b p;b a x上游引物:5’-CCTTTTGCTTCAGGGTTTCAT-3’,下游引物:5’-AGTCTGTGTCCACGGCG-3’,产物长度:188 bp;VEGF上游引物:5’-AAGATCCGCAGACGTGTAAATGTT-3’,下游引物:5’- CGGCTTGTCACATCTGCAAG-3’,产物长度:100 bp;GAPDH上游引物:5’-GAAGGTGAAGGTCGGAGT-3’,下游引物:5’-GAAGATGGTGATGGGATTTC-3’,产物长度:225 bp。
1.3.2 组织RNA的提取与鉴定
分别取液氮冻存的肺癌组织,加TRIzol后按试剂说明书操作步骤进行 RNA提取,测定D260nm,计算RNA浓度。
1.3.3 逆转录反应
取2 μL RNA模板做逆转录反应,反应体系:组织RNA 2 μL,OligoDT18 (0.5 μg/μL)1 μL,dNTP (10 mmol/L) 1 μL,MMLV(1 ×107U/L) 0.5 μL,RNA enzyme inhibitor 0.5 μL,DEPC水13 μL,总体积为22 μL,反应条件为37 ℃ 1 h,然后95 ℃ 3 min。
1.3.4 荧光定量标准品的制备
取经检验后可表达ERCC1、bax、Sur vivin、VEGF和GAPDH基因的模版,用普通PCR反应进行大量扩增,回收PCR产物,连接到E-ZT载体上。同样方法制作GAPDH标准品。
1.3.5 SYBR Green Ⅰ荧光实时定量PCR 测定
根据D值确定浓度,将标准品梯度稀释为6个梯度(109、108、107、106、105和104),作为模板进行Real-time PCR并制作标准曲线。20 μL反应体系包括:10×PCR buffer 2 μL,上游引物为(10 μmol/L) 0.4 μL,下游引物为(10 μmol/L) 0.4 μL,dNTPs (2.5 mmol/L)0.8 μL,SYBR Green Ⅰ 0.5 μL,Taq酶0.2 μL,cDNA 1 μL,ddH2O 14.7 μL。反应条件为:94 ℃ 5 min;94 ℃ 30 s;59 ℃ 30 s;72 ℃ 30 s,读板1次,升温到90 ℃ 0.02 s,读板1次,共40个循环。最后是72 ℃ 10 min延伸。56~100 ℃,每隔0.4 ℃读板1次,获得熔解曲线。
1.4 数据整理
目的基因与内参基因同时在荧光定量PCR仪上反应。每个基因设立空白对照(不含模板的反应体系)、标准品、样本同时进行扩增,每个样品均设3个平行管,扩增反应至少重复2次。PCR扩增反应完成后,仪器自行进行数据分析,给出各个样品的Ct值(达到样品荧光阈值的循环数)与SQ值(Starting Quantity起始模板数)。Ct值与SQ值的对数值之间存在着线性关系,以质粒的拷贝数对数为横坐标,以Ct值为纵坐标,可得标准曲线,再根据各个样品的Ct值,读取标准曲线中对应的起始拷贝数,以此对每个样品cDNA进行定量分析。定量结果以SQ值表示。为了消除每个样品反应时cDNA量的不同,根据公式F=目的基因平均SQ值/GAPDH基因平均SQ值来进行校正,得到样本各个基因的相对表达量。
1.5 统计学处理
采用SPSS 13.0统计软件进行分析处理。患者年龄、性别、组织学类型、TNM分期和ERCC1、survivin、bax、VEGF表达采用COX模型进行多因素回归分析;ERCC1、survivin、bax和VEGF基因的mRNA在肺癌组织中表达相关性采用相关分析(秩相关),预后好组和预后差组两组样本各个基因拷贝数的比较采用秩和检验,4种基因在不同病理类型和分期中表达的比较采用秩和检验,生存分析的比较用Kaplan-Meier生存曲线和log-rank检验。P<0.05为差异有统计学意义。
2 结 果
2.1 质粒测序结果
重组基因质粒经PCR和测序核实,VEGF有1个碱基突变,为无意突变,重组基因质粒构建成功。
2.2 阳性标准品实时荧光扩增标准曲线
通过ERCC1、survivin、bax、VEGF、GAPDH质粒初始拷贝数与实时荧光定量检测的Ct值建立的标准曲线相关系数>0.995,可以作为检测本组基因的良好标准品。
2.3 实时荧光扩增熔解曲线
荧光定量PCR的熔解曲线显示,采用荧光染料进行各浓度质粒ERCC1、survivin、bax、VEGF、GAPDH基因实时荧光定量检测,均出现单一的熔解峰,结果特异性好。
2.4 两组患者临床病理资料的对比分析
两组患者的病理类型、临床分期和化疗方案的差异无统计学意义(P>0.05),而两组患者的生存时间差异有统计学意义(P<0.05,表1)。
2.5 COX多因素回归分析结果
COX模型多因素回归分析发现,患者年龄、性别、组织学类型、TNM分期和ERCC1、survivin、bax、VEGF表达均不是影响患者预后的独立因素,并且ERCC1、survivin、bax、VEGF的表达量之间没有明显相关性。
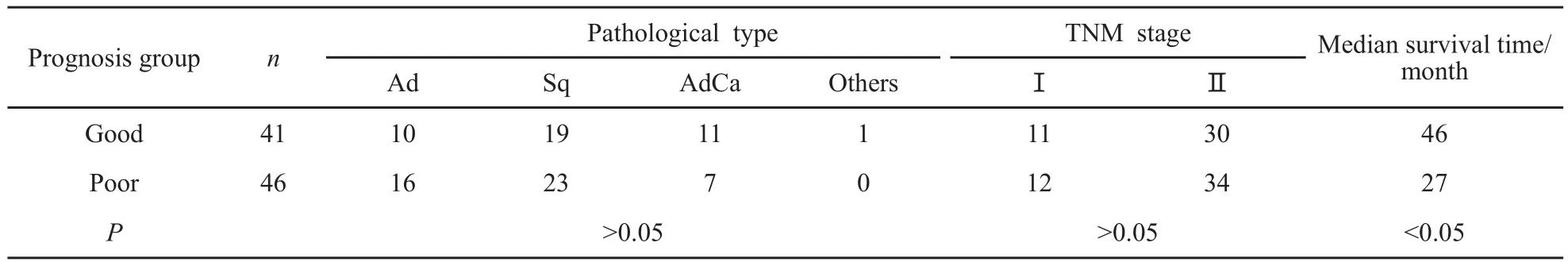
表l 两组患者临床病理资料的对比分析Tab.1 Comparative analysis of clinical and pathological data of two groups of patients
2.6 ERCC1、survivin、bax、VEGF的表达量在预后好组和预后差组的比较
表达量的比较:ERCC1在两组比较中,腺癌、鳞癌预后好组与预后差组的比较其差异有统计学意义(P=0.010;P=0.021),腺鳞癌其两组比较差异无统计学意义(P=0.061);Ⅰ期其两组比较差异有统计学意义(P=0.033),Ⅱ期差异无统计学意义(P=0.051)。survivin在两组比较中,腺癌、鳞癌其两组的比较差异有统计学意义(P=0.012;P=0.023),腺鳞癌其两组的比较差异无统计学意义(P=0.135);Ⅰ期和Ⅱ期其两组的比较差异均有统计学意义(P=0.041;P=0.037)。bax在两组比较中,腺癌、腺鳞癌其两组比较的差异均有统计学意义(P=0.009;P=0.032),而鳞癌其两组比较差异无统计学意义(P=0.54);Ⅰ期和Ⅱ期其两组比较差异均有统计学意义(P=0.034;P=0.012)。VEGF在两组比较中,腺癌、鳞癌和腺鳞癌3组比较差异均有统计学意义(P=0.009;P=0.016;P=0.003);Ⅰ期和Ⅱ期其两组比较差异有统计学意义(P=0.013,P=0.008)。本研究结果发现ERCC1、survivin、bax、VEGF在总的预后好组和预后差组各病理分型与分期表达量比较差异均有统计学意义(表2)。
2.7 ERCC1、survivin、bax、VEGF的表达与生存期的关系
在87例肺癌组织中,将ERCC1、survivin、bax、VEGF的表达量分高、低表达者。ERCC1以中位数8.56为界,≤8.56为低表达者,>8.56为高表达者,高表达者的中位生存期为41个月,低表达者的中位生存期为38个月,差异无统计学意义(P=0.037,图1A);survivin以中位数6.26为界,≤6.26为低表达者,>6.26为高表达者,高表达者的中位生存期为37个月,低表达者中位生存期为45个月,差异无统计学意义(P=0.138,图1B);bax以中位数5.07为界,≤5.07为低表达者,>5.07为高表达者,高表达者的中位生存期为45个月,低表达者的中位生存期为39个月,差异无统计学意义(P=0.562,图1C);VEGF以中位数4.05为界,≤4.05为低表达者,>4.05为高表达者,高、低表达者的中位生存期为41个月,低表达者的中位生存期为40个月,差异无统计学意义(P=0.114,图1D)。将符合ERCCl和survivin低表达、bax和VEGF高表达的15例与ERCCl和survivin高表达、bax和VEGF低表达的10例作生存分析,符合ERCCl和survivin低表达、bax和VEGF高表达的15例中位生存期为48个月,而ERCCl和survivin高表达、bax和VEGF低表达的10例中位生存期为18个月,差异有统计学意义(P=0.029,图1E)。
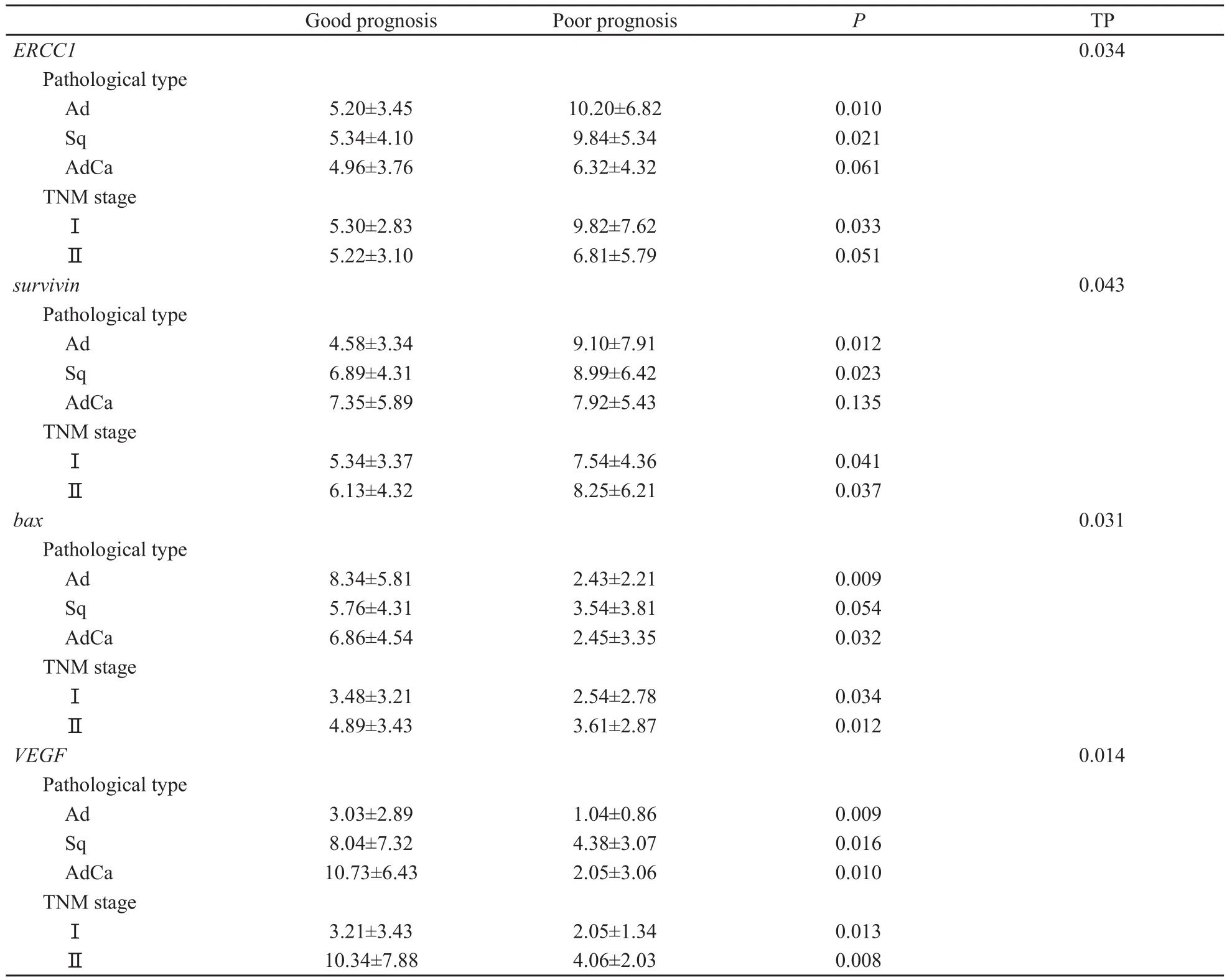
表2 ERCC1、survivin、bax、VEGF的表达量在预后好组和预后差组的比较Tab.2 The comparison of the expression of ERCC1, survivin, bax and VEGF between the good prognosis group and the relatively poor prognosis group
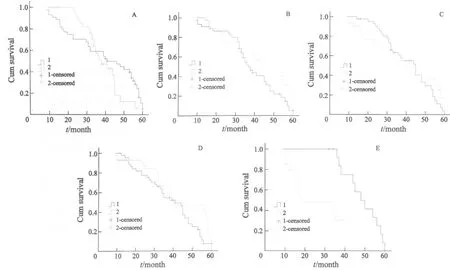
图1 不统基因表达情况下的患者生存分析Fig.1 Survival curves of patients with different genes expression
3 讨 论
肿瘤分期是预测NSCLC患者生存率最有力的指标,这一点已广为认同。如能将判断预后的分子标志作为选择治疗方法的标准,既可以提高疗效,又能使不能受益的患者积极采取其他干预措施避免不必要的化疗引起的不良反应。张楠等[3]的研究表明,与肿瘤化疗相关的基因有:药物动力学相关基因、各种生物酶相关基因、DNA损伤与修复相关基因、凋亡相关基因、致癌和抑癌基因、细胞增殖和转移相关基因等。目前有不少前瞻性的研究正在评估这些颇具希望的预后标志物未来的应用价值,但尚未找到可指导临床治疗的标志物。NSCLC术后化疗效果不佳是多因素、多基因参与的复杂过程,各个机制间存在相互交叉、相互依赖的关系,制定一个有效的、指导NSCLC术后化疗的分子指标需要进行多因素分析,因此本研究选择了一组基因进行预测早期NSCLC术后化疗疗效,并指导临床。
ERCC1基因是第一个克隆而得的人类DNA损伤修复基因[4],定位于19号染色体上,属于核切除修复基因家族,编码一种蛋白质,这种蛋白质能与修复复合体的其他成员协同通过修复核苷酸的化学变化和结构改变以确保基因组的完整性。ERCC1在维持组织修复功能中占有重要地位,有研究表明,肺癌中ERCC1高表达,往往导致癌细胞对铂类制剂耐药从而导致化疗疗效差,影响生存率,这可能与ERCC1在修复损伤并维持基因组稳定性中发挥重要作用有关[5-6]。Survivin又名生存素,是细胞凋亡抑制蛋白家族(inhibitor of apoptosis proteins,IAPS)成员[7]。近来有研究表明,survivin是内在肿瘤抑制网络的通用靶位,survivin位点被认为是抗肿瘤药物的新型靶点[8]。bax是Bcl-2家族中的促凋亡成员,Bcl-2和bax通过阻断凋亡信号通路中的最后共同通道而抑制细胞凋亡[9]。新的观点认为,对不同的肿瘤bax所起的作用可能不同;同一种肿瘤在不同的阶段,bax所起的作用也可能不同。VEGF是一种分子质量为46×103的高度糖基化的碱性蛋白,为血小板源生长因子(PDGF)家族的一个成员,可由正常细胞和肿瘤细胞产生和分泌,VEGF可刺激血浆纤维蛋白等外渗并沉积在细胞外基质,作为肿瘤基质和毛细血管网形成的基础[10]。本实验发现ERCC1、survivin、bax、VEGF在预后好组和预后差组各病理分型和临床分期中表达量的比较差异并非均有统计学意义,但是87例早期NSCLC患者总的癌组织中ERCC1、survivin、bax、VEGF这一组基因的表达量在预后好组和预后差组的比较差异均有统计学意义,表明ERCC1、survivin、bax、VEGF是一组可以判断早期NSCLC术后化疗效果的指标。本研究将符合ERCC1和survivin低表达、bax和VEGF高表达的15例与ERCC1和survivin高表达、bax和VEGF低表达的10例作生存分析,发现差异有统计学意义,表明ERCC1和survivin低表达、bax和VEGF高表达的早期NSCLC患者术后化疗的效果好,而ERCC1和survivin高表达、bax和VEGF低表达的早期NSCLC患者术后化疗的效果较差,与潘泓等[2]对早期NSCLC的研究相一致。
总之,ERCC1和survivin高表达、bax和VEGF低表达的NSCLC患者,术后生存期较短,对化疗可能不敏感,术后化疗意义不大,应采取以靶向治疗和生物治疗为主的治疗方法;而对ERCC1和survivin低表达、bax和VEGF高表达的NSCLC患者,行术后辅助化疗可取得更好的效果。因此,ERCC1、survivin、bax、VEGF联合检测可成为判断早中期肺癌化疗疗效及生存期的检测手段,有助于确定治疗方案,以提高术后生存率。
[1] CHEN W, ZHANG S, ZOU X, et al.Evaluation on the incidence, mortality and tendency of lung cancer in China[J].Thoracic Cancer, 2010, 1(1): 35-40.
[2] 潘泓, 李力, 左传田, 等.多基因蛋白表达判断早期非小细胞肺癌术后化疗疗效的价值 [J].中华肿瘤杂志, 2008,30: 528-531.
[3] 张楠, 魏素菊.肺癌多药耐药及生物逆转[J].实用肿瘤学杂志, 2007, 2l: 486-489.
[4] SIMON G R,SHARMA S,CANTOR A, et a1.ERCCl expression is a predictor of survival in resected patients with non-small cell lung cancer [J].Chest, 2005, 127(3): 978-983.
[5] CROTEAU D, PENG Y, VAN B H, et al.DNA repair GETS physical mapping an XPA-binding site on ERCC1[J].DNA Repair, 2008, 7(5): 819-826.
[6] AZUMA K, KOMOHARA Y, SASADA T, et al.Excision repair cross complementation group 1 predicts progressionfree and overall survival in non-small cell lung cancer patients treated with platinum-based chemo therapy [J] .Cancer Sci, 2007, 98(9): 1336-1343.
[7] SHANKAR S I, MANI S, O'Guin K,N, et al.Survivin inhibition induces human neural tumor cell death through caspase independent and dependent pathways [J].J Neurochem,2001, 92(2): 426-429.
[8] RYAN B M, O'DONOVAN N, DUFFY M J.Survivin: a new target for anti-cancer therapy [J].Cancer Treat Rev, 2009,35(7): 553-562.
[9] BERRIEMAN H K, SMITH L, O'KANE S L, et al.The expression of Bcl-2 family proteins differs between non-small cell lung carcinoma subtypes [J].Cancer, 2005, 103(7):1415-1419.
[10] BREKKEN R A, THORPE P E.Vascular endothelial growth factor and vascular targeting of solid tumors [J].Anticancer Res, 2001, 21(6B): 4221-4229.

