新疆不同民族前列腺癌患者内分泌治疗的预后及影响因素分析
热合曼·衣明 胡尔西旦·尼牙孜 赵化荣 包永星
新疆医科大学第一附属医院肿瘤中心,新疆 乌鲁木齐830054
前列腺癌(prostate cancer,PCa)是雄激素依赖性的肿瘤,60多年来以去势治疗为主的内分泌治疗是PCa临床治疗的主要方法之一[1]。由于早期前列腺癌无明显临床表现,确诊时大多数患者已属中晚期,故临床上很多患者选择内分泌治疗作为主要的初始治疗手段。临床上不同内分泌治疗模式的疗效可能不同,不同患者对同一种内分泌治疗模式的敏感性也不同,为提高PCa患者内分泌治疗疗效,改善患者预后,学者们一直在研究治疗方案的个体化以及影响患者预后的因素。本文采用目前国际上对肿瘤预后因素分析常用的Cox比例风险模型,回顾分析新疆不同民族228例以内分泌治疗为初始治疗的PCa患者,对可能影响PCa患者预后的因素进行了单因素和多因素分析,以期评价不同民族PCa患者内分泌治疗的疗效,了解其主要的预后影响因素,为改善PCa患者预后提供理论依据。
1 资料和方法
1.1 临床资料
收集本院2002年1月—2010年10月经前列腺穿刺活检或经尿道前列腺电切术(TURP)后病理确诊为PCa患者的资料共242例,其中14例因失访被剔除,纳入分析的共228例,查阅病历采集项目包括:患者的民族、年龄、职业、文化程度、居住情况、诊断时ECOG体力状况(EPS)评分、肿瘤临床分期、Gleason评分、治疗前1周内总前列腺特异抗原(total prostate specific antigen,tPSA)、血清碱性磷酸酶(alkaline phosphatase,ALP)、血红蛋白(hemoglobin,HGB)水平以及内分泌治疗方式等。患者年龄50~88岁,平均(71.53±0.48)岁,其中汉族162例,其他少数民族66例(维吾尔族57例、哈萨克族9例),均在病理确诊后1周内开始接受内分泌治疗。临床分期采用2002年AJCC分期系统,病理分级采用Gleason分级系统。
1.2 内分泌治疗及分组
根据患者年龄、临床分期、分级及病情等,首次均接受内分泌治疗,患者按不同内分泌治疗方案分组:⑴最大限度雄激素阻断(maximal androgen blockade,MAB)治疗164例、其中84例采取双侧睾丸切除手术加口服氟他胺(0.25 g,tid)或比卡鲁胺(50 mg,qd);80例采取皮下注射LHRH类似物曲普瑞林(3.75 mg,每28 d 1次)或戈舍瑞林(3.6 mg,每28 d 1次)加口服氟他胺(0.25 g,tid)或比卡鲁胺(50 mg,qd),其中28例最终接受双侧睾丸切除术;⑵单纯去势或单纯抗雄激素药物治疗组64例,其中应用皮下注射LHRH类似物22例,双侧睾丸切除术25例,单纯抗雄激素(口服氟他胺或比卡鲁胺)治疗17例。本研究随访截止日期为2011年05月27日,患者的生存时间以初始治疗日为起点,死亡为终点。所有患者均获随访,中位随访时间为31个月(表1)。
1.3 统计学处理
采用SPSS 19.0软件,计量资料比较采用t检验及秩和检验,等级资料采用秩和检验,计数资料采用χ2检验,生存资料采用Kaplan-Meier乘积极限法进行计算。对可能影响生存的因素进行log-rank单因素分析,并对符合Cox比例风险模型的变量做多因素分析,P<0.05为差异有统计学意义。
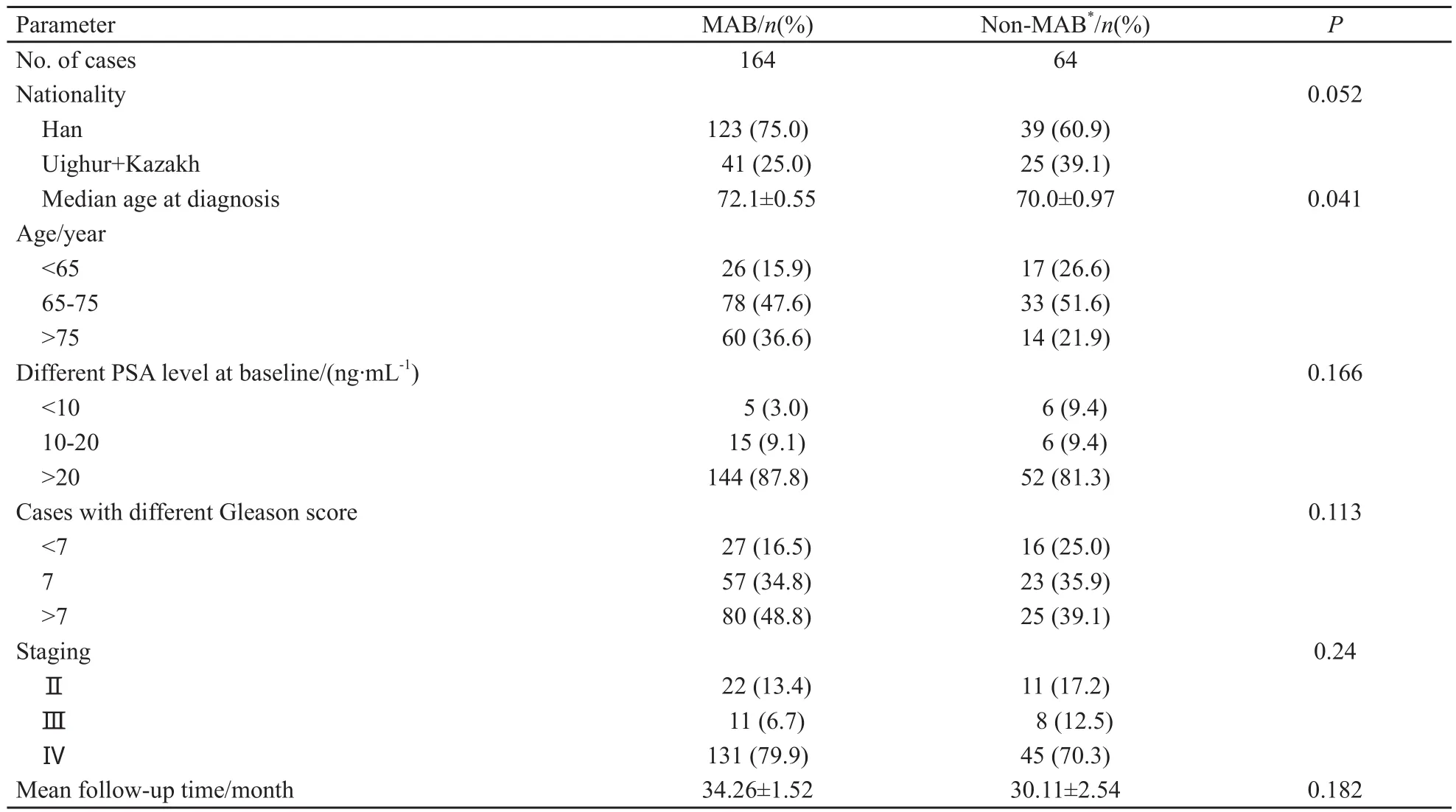
表1 两种治疗方法患者的临床特征Tab.1 Characteristics for two different treatment methods
2 结 果
2.1 总生存情况
至随访截止日期,228例患者共存活131例(57.5%),死亡97例(42.5%);平均随访时间33.17个月。其中直接死于PCa者91例(39.9%),死于其他疾病者6例(2.6%)。本组患者1、3和5年总生存率分别92.7%、66.8%和37.2%,疾病特异性生存率分别93.2%、68.3%和40.1%。
2.2 单因素分析结果
对各临床病理因素不同分组的生存率差异行log-rank检验,发现患者民族、治疗前EPS评分、肿瘤TNM分期、Gleason评分、治疗前tPSA、ALP、HGB水平以及内分泌治疗方案在单因素分析中是内分泌治疗后生存率的影响因素(表2)。
对不同民族、临床分期、Gleason评分、内分泌治疗方案的疾病特异性生存曲线进行比较发现,PCa患者的疾病特异生存率呈TNM分期越高、生存率越低(P=0.000,图1A),Gleason评分为低(1~6分)、中(7分)、高(8~10分)级别患者的生存率呈分级越高生存率越低的趋势(P=0.000,图1B)。采用不同内分泌治疗方案各组的3年疾病特异性生存率分别为:MAB组72.2%,单纯去势或单纯抗雄激素药物治疗组56.3%(P=0.004,图1C)。汉族和少数民族(维吾尔、哈萨克)患者内分泌治疗的3年疾病特异性生存率分别为73.6%和54.2%,差异有统计学意义(P=0.025,图1D),但少数民族(维吾尔、哈萨克)患者3年疾病特异性生存率分别为50.6%、53.2%,差异无统计学意义(P=0.202)。
2.3 多因素分析结果
多因素Cox比例风险模型分析结果表明,患者民族、肿瘤临床分期、Gleason评分、诊断时HGB水平、治疗前EPS评分以及MAB治疗方案是影响PCa患者预后的独立因素(表3)。
3 讨 论
近年来,由于人口老龄化和诊断技术的提高,我国PCa的发病率和病死率也呈逐年上升趋势。根据国际肿瘤研究机构(IARC)的数据,2007年中国PCa的年龄标准化发病率为1.7/10万[2]。尽管应用直肠指 检、血 PSA、直肠彩超、前列腺穿刺等手段使早期PCa检出率大大提高,但许多患者就诊时已有转移发生。据统计在我国PCa的初诊患者中50%以上发生转移失去治愈机会[3]。本研究228例PCa患者中138例已发生转移(局部淋巴结及远处转移),占60.5%。

表2 病例分组及各影响因素的单因素分析结果Tab.2 Grouping and univariate analysis for factors impacting on survival

图1 不同临床分期、Gleason评分、内分泌治疗方案、不同民族患者生存曲线的比较Fig.1 Comparison of survival curves among patients with different clinical stages, Gleason scores, endocrine therapies and ethnic groups
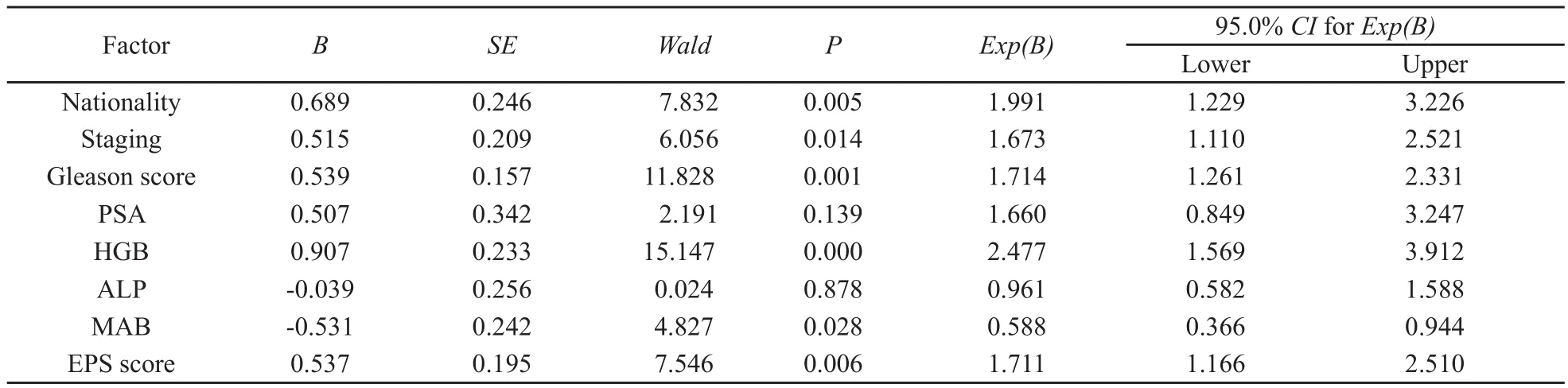
表3 多因素 Cox比例风险模型分析结果Tab.3 Results of multivariate Cox proportional hazard analysis
大量研究显示,影响PCa预后的因素包括一般情况(PS评分)、肿瘤分期、Gleason评分、诊断时PSA水平、年龄、ALP、HGB、血清睾酮水平、雌二醇水平和骨扫描情况等[4-6],其中肿瘤分期、分级以及PSA水平是公认的重要的预后因素,而肿瘤分期是影响PCa预后的最危险因素[7]。本研究单因素分析结果显示,患者民族、初诊时EPS评分、临床分期、Gleason评分、治疗前tPSA、ALP、HGB水平以及内分泌治疗方法等因素对PCa患者预后有影响,而患者年龄、职业、文化程度、居住地等因素对PCa的预后无影响。运用Cox模型多因素分析结果表明,患者民族、治疗前EPS评分、临床分期、Gleason评分、治疗前HGB水平以及MAB治疗均是影响PCa患者预后的重要独立因素,此结果与国外文献报道大致相似[4-6]。从本研究Cox模型分析结果可见,TNM分期之间差异具有统计学意义 (P=0.014),即临床分期越晚,生存率越低,说明PCa的早期发现、早期诊断、早期治疗是提高患者生存率的关键。Gleason评分是PCa很好的预后指标之一,患者一般根据GS分组为<7 分(低危组),7 分(中危组)和 >7分(高危组) ,本研究结果显示 ,Gleason 评分的相对危险度为1.714,是影响PCa预后的主要因素之一,与其他文献报道相似[8]。
目前PCa内分泌治疗方式主要有去势治疗、抗雄激素治疗、MAB,其中去势治疗包括手术去势(双侧睾丸切除)、药物去势(皮下注射LHRH类似物); MAB又称联合雄激素阻断治疗(combined androgen blockade,CAB)是指去势治疗的基础上加口服抗雄激素药物。本研究228例患者临床分期为Ⅱ~IV,均接受内分泌治疗,大多数患者首诊时均存在不同程度的下尿路梗阻症状, 经内分泌治疗后,排尿症状得到不同程度改善或症状完全消失,部分既往存在严重尿潴留和反复尿潴留患者能够较长时间内保持较好的排尿状态。228例患者中141例接受MAB治疗,无一例因MAB不良反应而终止治疗。统计分析结果显示,MAB的疾病特异生存率明显优于单纯去势或单纯抗雄激素药物治疗组治疗(P=0.000)。因此, MAB是晚期尤其是转移性PCa患者较安全可靠的治疗方法,此结果与既往国外文献报道结果大致相似[9-10]。本研究结果显示,HGB<120 g/L和≥120 g/L两组患者的3年疾病特异性生存率分别为44.4%、79.1% (P=0.004),多因素分析结果显示,贫血(HGB<120 g/L)的相对危险度为2.477,说明治疗前血红蛋白水平是否正常也是主要的预后因子之一,此结论与国外一些报道相似[11-12]。本研究患者中汉族和少数民族(维吾尔、哈萨克)患者不同治疗组间分布无显著差异(P=0.052)的条件下,内分泌治疗后生存率差异有统计学意义(P=0.025),可能与以下因素有关:⑴少数民族(维吾尔、哈萨克)因宗教信仰等原因,对生命的重视程度不同,到疾病晚期,大多数患者放弃进一步抗癌治疗或最佳支持治疗,从而影响总生存时间;⑵汉族与少数民族之间生活方式不同,尤其是饮食习惯方面,维吾尔族和哈萨克族食用富含胆固醇的动物脂肪类食物,胆固醇在体内转化成雄激素,雄激素促进PCa进展、影响患者生存率。本研究分析认为,PCa患者通过改变生活方式、特别是饮食方面减少肉类,可以延缓PCa的进展,国外也有相似的结论报道[13]。当然PCa的种族差异与不同民族患者的遗传学差异以及其基础生存环境、行为、卫生保健等因素共同作用有关,消除PCa全球性的差异,就要全面了解上述因素对PCa的病因和结局的影响[14]。总之,本研究结果表明,接受内分泌治疗的进展期尤其是转移性PCa患者而言,MAB的疾病特异性生存率优于单纯去势或抗雄激素治疗,影响不同民族PCa患者内分泌治疗的重要预后因素包括:民族、治疗前EPS评分、肿瘤TNM分期、Gleason评分、治疗前HGB水平以及MAB治疗等。
[1] SUZUKI H, KAMIYA N, IMAMOTO T, et al.Current topics and perspectives relating to hormone therapy for prostate cancer [J].Int J Clin Oncol, 2008, 13(5): 401-410.
[2] HAAS G P, DELONGCHAMPS N, BRAWLEY O W, et al.The worldwide epidemiology of prostate cancer: perspectives from autopsy studies [J].Can J Urol, 2008, 15(1): 3866-3871.
[3] 方海伟, 程跃.前列腺癌内分泌治疗中的热点探讨 [J].现代泌尿生殖肿瘤杂志, 2009, 4(1): 128.
[4] MATZKIN H, PERITO P E, SOLOWAY M S.Prognostic factors in metastatic prostate cancer [J].Cancer, 1993,72(12): 3788-3792.
[5] MIKKOLA A, ARO J, RANNIKKO S, et al.Prognostic grouping of metastatic prostate cancer using conventional pretreatment prognostic factors [J].Scand J Urol Nephrol,2009, 43(4): 265-270.
[6] NAKASHIMA J, KIKUCHI E, MIYAJIMA A, et al.Simple stratification of survival using bone scan and serum C-reactive protein in prostate cancer patients with metastases [J].Urol Int, 2008, 80(2): 129-133.
[7] JOLY F, HENRY-AMAR M.Prognostic factors of localized,locally advanced or metastatic prostate cancer [J].Bull Cancer, 2007, 94(7 Suppl): 35-43.
[8] SWANSON G P, BASLER J W.Prognostic factors for failure after prostatectomy [J].J Cancer, 2010, 7(2): 1-19.
[9] AKAZA H, YAMAGUCHI A, MATSUDA T, et al.Superior anti-tumor efficacy of bicalutamide 80 mg in combination with a luteinizing hormone-releasing hormone (LHRH) agonist versus LHRH agonist monotherapy as first-line treatment for advanced prostate cancer: interim results of a randomized study in Japanese patients [J].Jpn J Clin Oncol, 2004, 34:20-28.
[10] ARAI Y, AKAZA H, DEGUCHI T, et al.Evaluation of quality of life in patients with previously untreated advanced prostate cancer receiving maximum androgen blockade therapy or LHRHa monotherapy: a multicenter, randomized, doubleblind, comparative study [J].J Cancer Res Clin Oncol,2008, 134(12): 1385-1396.
[11] NIEDER C, HAUKLAND E, PAWINSKI A, et al.Anemia and thrombocytopenia in patients with prostate cancer and bone metastases [J].BMC Cancer, 2010, 10: 284.
[12] ARKENAU H T, OLMOS D, ANG J E, et al.Clinical outcome and prognostic factors for patients treated within the context of a phase I study: the Royal Marsden Hospital experience [J].Br J Cancer, 2008, 98(6): 1029-1033.
[13] ORNISH D, WEIDNER G, FAIR W R, et al.Intensive lifestyle changes may affect the progression of prostate cancer [J].J Urol, 2005, 174(3): 1065-1069; discussion: 1069-1070.
[14] ZEIGLER-JOHNSON C M, SPANGLER E, JALLOH M, et al.Genetic susceptibility to prostate cancer in men of African descent: implications for global disparities in incidence and outcomes [J].Can J Urol, 2008, 15(1): 3872-3882.

