顺铂联合不同化疗方案初始治疗晚期非小细胞肺癌的生存研究
王虹 石军年 万毅新 王晓平 魏海东 陶红艳 黄晖蓉 李芳伟 武虹艳
兰州大学第二医院呼吸内科,*VIP内科,甘肃 兰州 730030
上个世纪90年代长春瑞滨、紫杉醇、吉西他滨等药物与顺铂联合用于Ⅱ期临床试验时,晚期非小细胞肺癌(non-small cell lung cancer,NSCLC)患者1年生存率接近50%[1],两药联合方案在客观指标有效率方面有很显著的提高,但并没有明显延长患者生存期或缩短疾病的进展时间[2]。本科室自2005年1月—2010年5月共诊治晚期NSCLC患者192例,采用前瞻性随机对照研究,比较3种顺铂联合化疗方案的临床有效率,评估其对生存期的影响和不良反应,为个体化治疗提供依据。
1 资料和方法
1.1 临床资料
1.1.1 研究对象
确诊为晚期NSCLC患者(Ⅲb~Ⅳ期)共192例,其中男性106例,女性86例,年龄36~68岁;Ⅲb期46例,Ⅳ期146例;鳞癌102例,腺癌78例,腺鳞癌6例,大细胞癌3例,肺泡细胞癌3例。在进入此研究前患者均没有经过化疗、放疗和(或)免疫学治疗;ECOG为0~2分,预计存活期长于12周;骨髓造血功能正常(WBC≥3.5×109/L,PLT≥100×109/L,HB≥110 g/L或红细胞压积≥30%);肝、肾功能正 常,并签署知情同意书。本研究亦获得院临床伦理委员会的认证,且遵循临床实践的标准。
1.1.2 排除标准[3]急性感染
有症状的神经系统转移需行紧急放疗和(或)肾上腺皮质激素治疗;患有第二种原发恶性肿瘤;怀孕及哺乳期妇女。
1.2 治疗方法
采取前瞻性、开放性方法,将入组患者随机分为NP、TP、GP共3个治疗组,3组患者临床资料经统计学处理未见显著性差异,符合随机分组结果。全部患者均随访1年以上,随访率为98.5%。
NP组:长春瑞滨25 mg/m2,第1、8天,顺铂75 mg/m2,第2天,28 d为1个周期;TP组:紫杉醇175 mg/m2,第1天,顺铂75 mg/m2,第1天,21 d为1个周期;GP组:吉西他滨1 250 mg/m2,第1、8天,顺铂75 mg/m2,第1天,21 d为1个周期;每组方案至少应用2个周期,达到疾病稳定状态的患者可再接受2~4个周期的化疗。若连续治疗达疾病缓解的患者可增加2个周期,达到6个周期的化疗。
在每个治疗周期前,患者均须完成EORTC QLQ-C30-LC13生活质量量表的测评,每个治疗周期均需对治疗药物进行不良反应的评价。所有患者均需进行至少2个周期的化疗,并对治疗效果进行客观的评估[4]。
1.3 疗效评定标准及不良反应的评定
按照RECIST统一评价标准,疗效分为完全缓解(complete remission,CR)、部分缓解(partial remission,PR)、稳定(stable disease,SD)和进展(progressive disease,PD)。评价近期疗效以CR+PR计算有效率(response rate,RR),以CR+PR+SD计算疾病控制率(disease control rate,DCR)。总生存期(overall survival,OS)是指从随机化开始至因任何原因引起死亡的时间,是评价肿瘤临床试验中最佳的疗效终点。疾病进展时间(time to progrcssion,TTP)的定义是指从随机化开始至出现疾病进展或死亡的时间。治疗失败时间(time to treatment failure,TTF)是指从随机化开始至出现疾病进展、死亡、由于不良事件退出、患者拒绝继续进行研究或者使用了新治疗的时间。不良反应的评定根据NCI常见毒性分级标准(第2版)评价。
1.4 统计学处理
数据处理应用SPSS 11.5统计软件,事件终止时间的评估采用Kaplan-Meier法,疗效评估采用Person χ2检验,基线因素(PS、脑转移、鳞癌、转移灶数目、疾病分期)对于终点事件的评估运用Cox’s危险因素模型,对不良反应的评估运用logistic分析,这些因素在单因素模型中表现为独立预后因素,在多因素模型建立中将加入治疗因素,P<0.05为差异有统计学意义。
2 结 果
2.1 临床资料及疾病特征分析
3组的临床资料符合随机分组结果,差异无统计学意义(P>0.05),患者的生物学特性和疾病特征是平衡的(表1)。
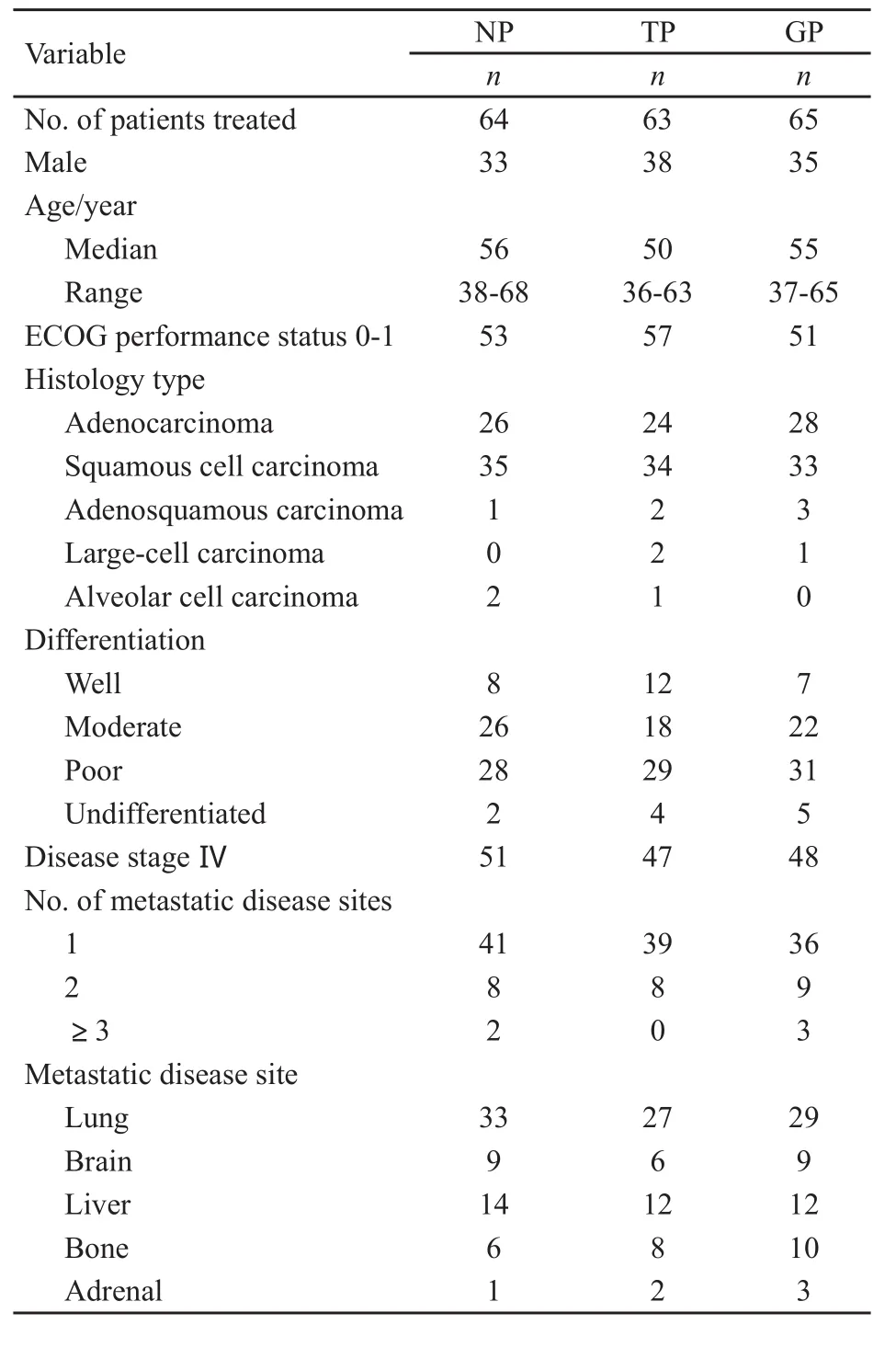
表1 患者临床资料统计表Tab.1 Patient demographics and disease characteristics
2.2 3组治疗有效率和生存曲线
全部患者均随访1年以上,随访率为98.5%。3组治疗的有效率差异无统计学意义(P>0.05,表2)。
所有患者均完成至少2个周期的化疗,达疾病稳定状态并完成4个周期化疗的患者NP组58%、TP组65%、GP组68%。达到疾病缓解状态并完成6个周期化疗的患者NP组28%、TP组36%、GP组41%。在Ⅲb期患者中,GP、TP和NP组化疗后总的有效率分别为39%、24%和26%。有脑转移的Ⅳ期患者对化疗总的有效率3组分别为32%、52%和25%。在生存期、疾病进展时间和治疗失败时间方面3组的差异无统计学意义(图1)。本研究结束时,有138例患者死亡(GP组45例、TP组44例、NP组49例),存活率分别为30.7%、30.1%和23.4%。
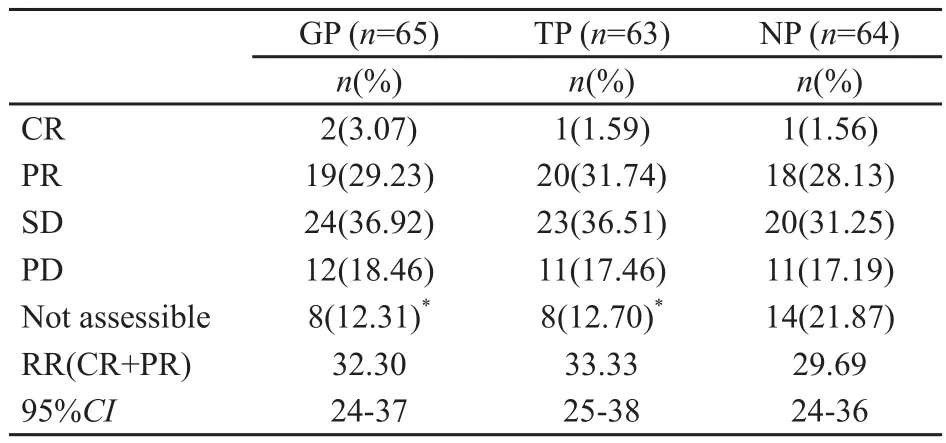
表2 肿瘤治疗的有效率Tab.2 Response rate after treatiment
多因素分析显示,ECOG中PS(生活质量评分)为2、疾病转移灶超过2个是总生存期、疾病进展时间和治疗失败时间的阴性预后因素。当调整了这些因素后,GP组和TP组生存期(GP组HR为0.91,TP组HR为0.89)、疾病进展时间(GP组HR为1.03,TP组HR为0.93)以及治疗失败时间(GP组HR为0.92,TP组HR为0.89)与NP组之间差异无统计学意义(P>0.05,表3)。脑转移是一个独立的阴性预后因素。
2.3 不良反应
因白细胞减少而发热GP组1例,TP组2例,NP组4例,然而输注红细胞TP组明显低于GP和NP组(P<0.01)。接受血小板输注患者的比例GP组8%,TP组2%,NP组8%,并且分别有3、4级血小板减少症的发生(表4、5)。
在NP组中白细胞减少症发生率明显升高(NP组每周期45%、TP组32%、GP组18%,P<0.001),GP组血小板减少症发生率明显升高(GP组16%、NP组1.5%、TP组3.1%,P<0.001),然而贫血仅在TP组与NP组相比差异有显著统计学意义(P<0.001)。恶心、呕吐症状NP组(13%)较其他两组更为常见(GP组7%、TP组1.5%,P<0.05)。脱发(1、2级)及周围神经毒性(1~3级)发生率TP组较高(52%和30%),明显高于NP组(11%和7%,P<0.05,表6)。
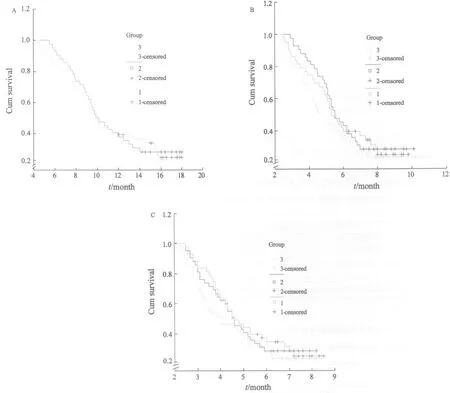
图1 总生存期、疾病进展时间及治疗失败时间的Kaplan-Meier曲线Fig.1 Kaplan-Meier curves of overall survival (OS), time to progress (TTP) and time to treatment failure (TTF)
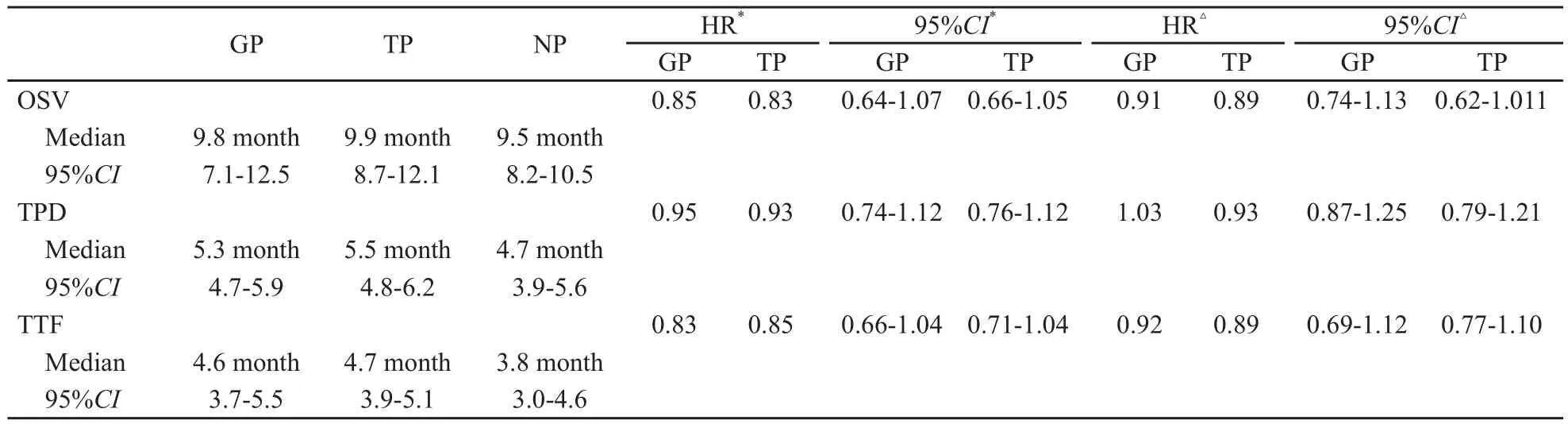
表3 3组化疗方案事件发生时间的结果总结Tab.3 Summary of time-to-event outcomes
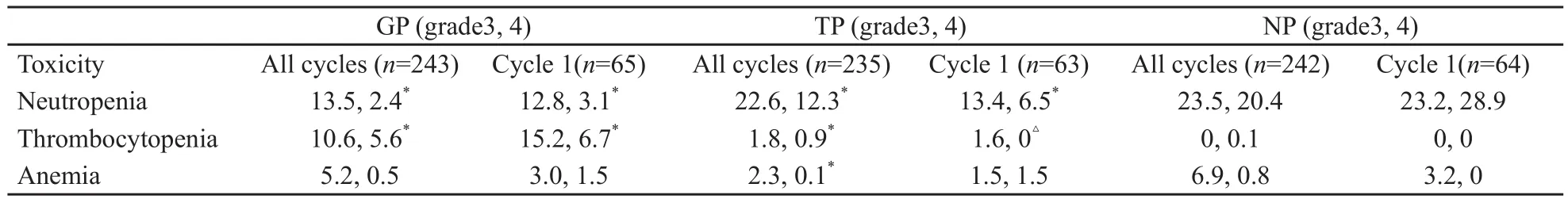
表4 不同化疗周期出现3、4级血液学毒性反应的患者百分比Tab.4 Grade 3, 4 hematologic toxicity by percentage of cycles(%)
在最初两个周期的治疗中,7例患者死亡,4例死于非药物相关性疾患(GP组1例,TP组2例,NP组1例),3例死于药物相关性并发症(GP组1例,TP组1例,NP组1例)。

表5 出现3、4级血液学毒性反应的患者百分数Tab.5 Grade 3, 4 hematologic toxicity by percentage of patients(%)
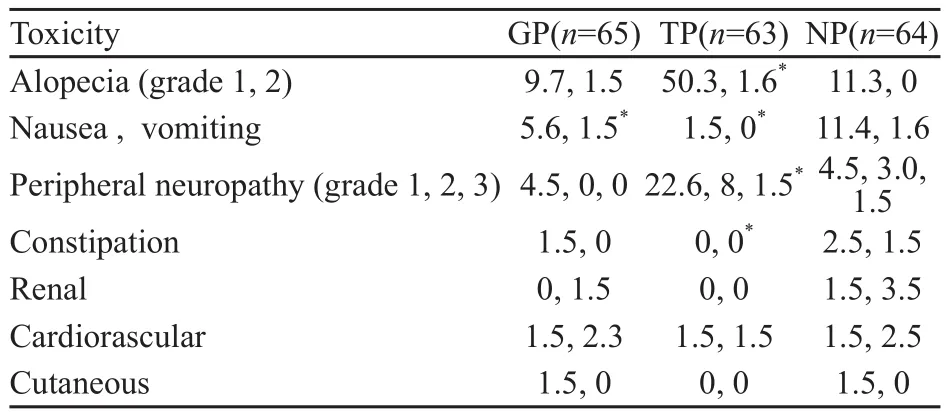
表6 3、4级非血液学毒性患者的百分数Tab.6 Grade 3, 4 nonhematologic toxicity by percentage of patients(%)
2.4 生活质量量表
2个周期治疗后,从EORTC QLQ-C30-LC13量表中患者参加工作和娱乐的能力、劳累度、恶心或者呕吐、食欲减退、周围神经毒性、脱发等6个方面分析,GP和NP组之间无显著性差异,然而TP组患者工作和娱乐能力、劳累感、恶心或呕吐、食欲减退都较NP组轻微,而周围神经毒性和脱发则在TP组较明显。4个周期治疗后再做同样的分析,胃肠道不良反应NP组明显高于GP组;疼痛、周围神经毒性和脱发的发生率TP组明显高于NP组。
3 讨 论
以顺铂为基础的化疗可以减轻晚期NSCLC患者的症状,延长患者的生存期,并且经济有效。尽管有令人鼓舞的临床研究报道,但临床医生仍然认为化疗远没有达到一个标准的治疗。
本研究采取前瞻性、随机对照的方法,对比了3组以铂类为基础的NSCLC一线化疗方案,结果表明疗效较好,中位生存期比ECGO试验[5]和SWOG[6]试验长2个月,可能与本研究Ⅳ期患者的比例相对较小有关(本研究Ⅳ期患者占76%,ECGO试验占91%,SWOG试验占89%)。本研究结果显示,3组在治疗失败时间、疾病进展时间、总的生存期等方面都是相似的,与国内外研究一致[7-8]。COX多因素模型分析结果亦显示,化疗近期疗效是影响晚期NSCLC患者生存的独立预后因素,与丛蕾等[9]的研究结果相同。病理类型、性别、临床分期对晚期NSCLC患者预后均有一定的影响,但不能作为独立预后因素, NP组的总不良反应发生率明显高于其他两组,在第4个周期,无法评估治疗有效率的患者百分数明显高于其他两组(NP为21.87%、GP为12.31%、TP为12.70%,P<0.02),与药物不良反应使治疗无法继续和(或)疾病进展有关。生活质量量表(QoL)结果NP组和GP组有一些不同。尽管在2个周期的化疗结束后,TP组不良反应大于NP组,但是4个周期后再评价,则NP组不良反应更大。最后1个周期的生活质量量表问卷调查很难反映药物的不良反应。另外,没有严格遵守问卷调查也降低了其统计学意义,特别是在后面的几个治疗周期。其他的随机研究结果也是如此[10-11]。
总之,化疗在晚期NSCLC患者中达到了一个平台期,增加第3种药物或者改变可利用的活性药物的序列能否取得更好的疗效还不明确。在现阶段治疗中,应充分评估患者的个体耐受能力,了解化疗方案的预期疗效和不良反应,制定个体化的最佳治疗方案,以期达到最好的治疗效果。
[1] YOSHIMURA N, KUDOH S, MUKOHARA1 T, et al.PhaseⅠ/Ⅱ study of cisplatin combined with weekly paclitaxel in patients with advanced non-small cell lung cancer [J].Brit J Cancer, 2004, 90(6): 1184-1189.
[2] RAMALINGAMA S, BELANIB C.Chemotherapy for advanced non-small cell lung cancer: recent advances and future directions [J].Oncologist, 2008, 13 (1): 5-13.
[3] SCAGLIOTTI G V, DE MARINIS F, RINALDI M, et al.PhaseⅢ randomized trial comparing three platinum-based doublets in advanced non-small cell lung cancer [J].J Clin Oncol,2002, 20(21): 4285-4291.
[4] BEZJAK A, TU D, SEYMOUR L, et al.Symptom improvement in lung cancer patients treated with erlotinib: Quality of life analysis of the National Cancer Institute of Canada clinical trials group BR.21 [J].J Clin Oncol, 2006, 24(24): 3831-3837.
[5] SCAGLIOTTI G V, PARIKH P, VON PAWEL J, et al.PhaseⅢ study comparing cisplatin plus gemcitabine with cisplatin plus pemetrexed in chemotherapy-native patients with advanced-stage non-small cell lung cancer [J].J Clin Oncol, 2008, 26(21): 3543-3551.
[6] OHE Y, OHASHI Y, KUBOTA K, et al.Randomized phaseⅢ study of cisplatin plus irinotecan versus carboplatin plus paclitaxel, cisplatin plus gemcitabine, and cisplatin plus vinorelbine for advanced non-small-cell lung cancer: Four-Arm Cooperative Study in Japan [J].Annal Oncol, 2007,18(2): 317-322.
[7] KUBOTA K, KAWAHARA M, OGAWARA M, et al.Vinorelbine plus gemcitabine followed by docetaxel versus carboplatin plus paclitaxel in patients with advanced nonsmall-cell lung cancer: A randomised, open-label, phase Ⅲstudy, [J].Lancet Oncol, 2008, 12: 1135-1142.
[8] 黄普文,束永前,卢凯华,等.紫杉醇联合卡铂治疗晚期非小细胞肺癌 [J].中国癌症杂志, 2004,14(4): 360-362.
[9] 丛蕾, 崔言刚, 王维博, 等.晚期非小细胞肺癌化疗预后因素的COX回归分析 [J].中国癌症杂志, 2009, 19(4):280-283.
[10] GRØNBERG B H, SUNDSTRØM S, KAASA S, et al.Influence of comorbidity on survival, toxicity and healthrelated quality of life in patients with advanced non-smallcell lung cancer receiving platinum-doublet chemotherapy[J].Eur J Cancer, 2010, 46(12): 2225-2234.
[11] VAN DER VOORT VAN ZYP N C, PRÉVOST J B, VAN DER HOLT B, et al.Quality of life after stereotactic radiotherapy for stage Ⅰ non-small cell lung cancer [J].Int J Radiat Oncol Biol Phys, 2010, 77(1): 33-37.

