Wnt/β-catenin信号通路在胰腺癌中的研究进展
潘岩 综述 花永强 刘鲁明 审校
复旦大学附属肿瘤医院中西医结合科,复旦大学上海医学院肿瘤学系,上海 200032
胰腺癌是一种难治性疾病,常规化疗疗效有限。靶向治疗(即针对性地杀灭肿瘤细胞而最低程度影响正常细胞功能)在肿瘤治疗中取得了诱人的结果。大量研究证实,Wnt/β-catenin信号通路在胰腺发育中起着重要作用,成人胰腺组织中该信号通路表达下降[1]。然而,异常激活的Wnt/β-catenin信号通路对胰腺导管腺癌发生、转移有重要影响[2-3]。深入探讨该信号通路有可能为靶向治疗提供新的方案。Wnt信号通路包括经典Wnt/β-catenin信号通路、非经典Wnt/β-catenin信号通路及Wnt/Ca2+通路。其中对经典Wnt/β-catenin信号通路的研究最透彻。
1 Wnt/β-catenin信号通路
Wnt/β-catenin信号通路是生物早期发育过程中一个非常保守的信号通路,通过某些特定基因调节胚胎组织的发育和组织功能的维持。该信号通路调控不同组织中的众多细胞功能,如细胞增殖、细胞死亡、上皮-间质转化、细胞生物学反应等。因此,部分异常激活的Wnt/β-catenin信号通路可导致细胞无限制增殖、生长,并促使肿瘤发生。
经典Wnt/β-catenin信号通路大体如图1所示。该信号通路成员较为复杂,Wnt分泌蛋白家族与靶细胞上的膜受体复合物[Frizzled(Fzd)和LRP5/6]结合后,信号蛋白Dsh高度磷酸化,使APC、GSK-3β、Axins等组成的β-catenin降解复合物解离。细胞质内的β-catenin脱离降解复合物的束缚之后,不再被蛋白酶降解,在细胞质中聚集并进一步入核,通过与转录T细胞因子/淋巴细胞增强因子(TCF/LEF)结合,从而开启下游基因的转录。在未激活细胞中,一方面Wnt蛋白与Fzd受体的结合受细胞外基质中(如sFRP等)各种Wnt拮抗剂和激动剂的影响 ,使配体/受体正常结合,适度激发该信号通路,另一方面细胞质中与APC、Axins等组成降解复合物的β-catenin,被激酶CK-1及GSK-3β磷酸化,进一步泛素化后被蛋白酶降解,这一过程使细胞质中的β-catenin维持在低浓度状态。以上种种负性调节作用维持了正常细胞中Wnt/β-catenin信号通路的稳定性,从而保持细胞正常的生物学功能。
2 Wnt/β-catenin信号通路与胰腺发育
Wnt/β-catenin信号通路参与众多正常组织发育过程,包括皮肤、大脑、乳腺、肝脏等,是细胞增殖、细胞凋亡和细胞分化等特性的重要调节因素。对于胰腺而言,β-catenin在胰腺腺泡细胞及内、外分泌细胞发育过程中的作用至关重要,但是却不影响胰岛发育及成人腺泡功能的维持[1,6-7]。Dessimoz等[8]对Wnt/β-catenin信号通路在胰腺器官发育中的作用做了详细研究,发现敲除β-catenin编码基因的胰腺上皮细胞和十二指肠细胞的Pdx1-Cre小鼠中可见胰腺内分泌细胞减少,进一步影响胰腺外分泌组织的发育。围产期该小鼠常常由于腺泡结构被破坏而出现急性水肿性胰腺炎。后者可通过其他正常细胞修复因胰腺炎损伤的组织,并可产生新的胰腺组织及十二指肠绒毛。
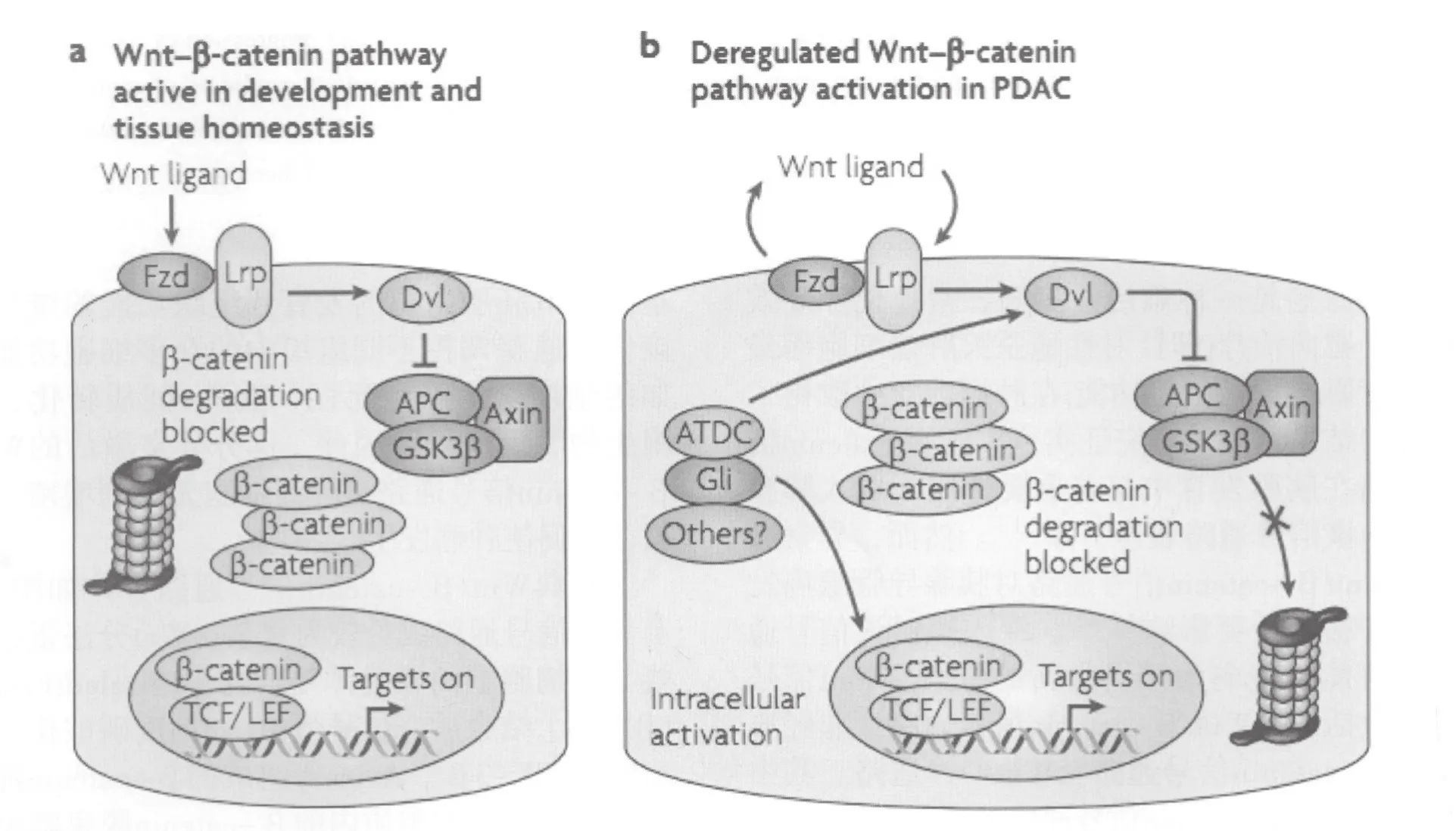
图1 胰腺导管腺癌经典Wnt/β-catenin信号通路[5]Fig.1 Canonical Wnt/β-catenin signaling in pancreatic ductal adenocarcinoma
3 异常激活Wnt/β-catenin信号通路与胰腺癌
胰腺非导管腺癌中普遍可见细胞质和细胞核中β-catenin升高,Dessimoz等[7]阐述了Wnt/β-catenin信号通路在胰腺非导管腺癌中的作用。同样,异常激活的Wnt/β-catenin信号通路在胰腺导管腺癌发生、转移有重要作用[2-3]。但目前的一些研究结果存在争议。一项关于111例胰腺癌患者的研究中未检测到CTNNB1基因突变及细胞核β-catenin蛋白聚集[9]。日本学者检测的20例胰腺癌组织,未见β-catenin基因突变;在102例组织增生、35例不典型增生、73例胰腺导管腺癌及正常胰腺组织中没有检测到β-catenin在细胞质及细胞核中聚集[10]。而另一些研究持相反观点,应用免疫组化技术检测胰腺癌,结果提示部分胰腺癌中可检测到β-catenin蛋白表达[2,11]。Pasca等[12]在26个人胰腺癌细胞系及3种胰腺癌动物模型中均观察到Wnt/β-catenin信号通路有不同程度的激活,阻断Wnt/β-catenin信号通路可抑制细胞增殖,促进细胞凋亡。Zeng 等[3]检测了31例进展型胰腺癌,发现65%胰腺癌患者β-catenin蛋白表达增强,主要是Ser45/Thr41磷酸化β-catenin蛋白,只有2例患者CTNNB1存在突变。另外,Wnt-1、frizzled-2和GSK-3β表达也增多。正常胰腺组织与胰腺癌中APC和Axin表达无明显差异。由此可见,胰腺癌中Wnt/β-catenin信号通路增强,但少见CTNNB1基因突变。另有研究表明胰腺癌CTNNB1,即β-catenin蛋白编码基因突变率为24%;APC突变率约16%[13-14]。
综上所述,Wnt/β-catenin信号通路在胰腺癌中的研究结论并不一致。因此,仍需对胰腺癌Wnt/β-catenin信号通路进行更全面、综合的检测及分析。
4 针对Wnt/β-catenin信号通路的胰腺癌靶向治疗
4.1 针对Wnt/Fzd 配体/受体复合物的靶向治疗
肿瘤微环境对信号通路的激活起着至关重要的作用,包括各类肿瘤相关细胞与细胞因子。其中与胰腺癌细胞关系最为密切的胰腺星形细胞可旁分泌激活Wnt/β-catenin信号通路,加速胰腺癌恶化。Froeling等[15]的研究结果显示,维生素A酸能够稳定胰腺星形细胞,减缓上述过程。肿瘤微环境中的细胞因子sFRPs是Wnt配体拮抗剂,在胰腺癌中呈低表达。经视黄醛酸处理后,细胞外sFRP4增多,抑制Wnt/β-catenin信号通路,导致细胞核β-catenin减少,从而降低胰腺癌细胞的侵袭[5]。DKK蛋白是另一种Wnt蛋白的拮抗剂,通过与frizzled受体结合参与肿瘤的发展和恶化。Takahashi等[16]对43个胰腺癌细胞系进行DKK蛋白表达筛选结果显示,DKK-1表达在各细胞系中均升高,未发现DKK-3表达增加,DKK-2、DKK-4在大多数细胞系中未见表达。同样,DKK-1蛋白过表达在23例胰腺癌手术切除组织中被检测到。敲除胰腺癌SUIT-2细胞系和转移癌S2-CP8细胞系中的DKK-1基因,可导致胰腺癌SUIT-2细胞系侵袭能力下降、动物移植瘤块生长受抑制。Zhong等[17]的研究表明,在胰腺发育过程中起重要作用的GATA6可负向调控Wnt拮抗剂DKK-1,促进细胞增殖,从而加速胰腺癌的发生及进展,因此归于癌基因一族。细胞外硫酸酯酶是一种Wnt信号通路激动剂,包括硫酸酯酶-1和硫酸酯酶-2,在胰腺癌组织和细胞系中呈高表达,其与Wnt受体结合可激活Wnt/β-catenin信号通路[18]。
因此,采用增加或促进sFRPs、DKK分泌,干扰或抑制硫酸酯酶分泌的方法可有效抑制Wnt/β-catenin信号通路,可成为胰腺癌靶向治疗的靶点。
4.2 针对β-catenin降解复合物的靶向治疗
干扰半乳糖凝集素-3基因表达可以促进β-catenin降解,从而降低胰腺癌细胞的侵袭和转移[19]。Cho等[20]研究发现,胰腺导管腺癌上调因子(PAUF)能使处理后的胰腺癌细胞细胞质中的β-catenin特异性地在Ser-33/37/Thr-41和Ser-675位点磷酸化,保持β-catenin的稳定性,从而导致β-catenin靶基因cyclin-D1和c-jun高表达,胰腺癌细胞呈快速增殖。用β-catenin抑制剂六氯酚处理后,不管PAUF是否存在,胰腺癌细胞的增殖能力均减弱。糖原合成激酶3β(GSK-3β)第9位丝氨酸磷酸化,可导致降解复合物解离、β-catenin聚集并与核内转录因子结合[21]。毛细血管扩张性共济失调细胞互补基因(ATDC),即TRIM29,其蛋白表达与β-catenin表达一致。ATDC蛋白作用于糖原合成激酶GSK-3负性调控蛋白Dvl-2,从而稳定β-catenin[22]。钙周期结合蛋白或Siah-1互动蛋白在胰腺癌组织中表达高于病灶周围正常组织(28/68, 41.2%),且与病理分级、临床分期呈正相关,主要机制可能是参与β-catenin的降解[23]。
鉴于胰腺癌中β-catenin及GSK-3蛋白异常较为常见,也可成为靶向治疗的靶点。
4.3 针对β-catenin/LEF-TCF转录复合物的靶向治疗
胰腺癌中β-catenin蛋白表达异常通过Wnt/β-catenin信号通路调控下游基因cyclinD1,c-myc和MMP-7转录,导致肿瘤进展及转移,影响胰腺癌患者预后[24]。因此,针对性地阻断LEF/TCF与β-catenin的结合位点即可阻断下游靶基因的转录,从而逆转肿瘤细胞的恶性生物学特性。
5 结语
Wnt/β-catenin信号通路在胰腺癌发生、发展中发挥重要作用。在65%胰腺癌病灶及绝大多数胰腺癌细胞系中β-catenin蛋白表达均显著增高,其编码基因突变少见,其余信号通路成员也有不同程度的改变。Wnt/β-catenin信号通路与胰腺癌的生长、转移密切相关,但目前仍有许多问题有待阐明,如为什么出现β-catenin蛋白表达增加,但编码基因CTNNB1却少见突变?Wnt/β-catenin信号通路对胰腺癌生长、转移到底有多少影响?该信号通路是否与其他信号通路存在重要的网络联系?此外,Wnt/β-catenin信号通路对胰腺癌化疗耐药、肿瘤干细胞影响等方面尚缺乏相关研究,值得进一步探讨。Wnt/β-catenin信号通路存在自身重要的调节机制,如sFRPs、DKK、硫酸酯酶,β-catenin降解复合物等,都有可能成为治疗靶点。相信随着对该信号通路认识的不断深入,必将深化对胰腺癌形成和发展的认识,促进Wnt/β-catenin信号通路靶向药物开发及临床应用研究。
[1] WELLS J M, ESNI F, BOIVIN G P, et al.Wnt/beta-catenin signaling is required for development of the exocrine pancreas[J].BMC Dev Biol, 2007, 7: 4.
[2] LOWY A M, FENOGLIO-PREISER C, KIM O J, et al.Dysregulation of beta-catenin expression correlates with tumor differentiation in pancreatic duct adenocarcinoma [J].Ann Surg Oncol, 2003, 10(3): 284-290.
[3] ZENG G, GERMINARO M, MICSENYI A, et al.Aberrant Wnt/beta-catenin signaling in pancreatic adenocarcinoma[J].Neoplasia, 2006, 8(4): 279-289.
[4] FROELING F E, FEIQ C, CHELALA C, et al.Retinoic acidinduced pancreatic stellate cell quiescence reduces paracrine Wnt-β-catenin signaling to slow tumor progression [J].Gastroenterology, 2011, 141(4): 1486-1497.
[5] MORRIS J P 4th, WANG S C, HEBROK M.KRAS, Hedgehog,Wnt and the twisted developmental biology of pancreatic ductal adenocarcinoma[J].Nat Rev Cancer, 2010, 10(10):683-695.
[6] MURTAUGH L C, LAW A C, DOR Y, et al.Beta-catenin is essential for pancreatic acinar but not islet development [J].Development, 2005, 132(21): 4663-4674.
[7] DESSIMOZ J, GRAPIN-BOTTON A.Pancreas development and cancer: Wnt/beta- catenin at issue… [J].Cell Cycle,2006, 5(1): 7-10.
[8] DESSIMOZ J, BONNARD C, HUELSKEN J, et al.Pancreasspecific deletion of β-catenin reveals Wnt-dependent and Wnt-independent functions during development [J].Curr Biol, 2005, 15(18): 1677-1683.
[9] GERDES B, RAMASWAMY A, SIMON B, et al.Analysis of beta-catenin gene mutations in pancreatic tumors [J].Digestion, 1999, 60(6): 544-548.
[10] KUBOZOE T, TSUJIUCHI T, MURATA N, et al.Absence of beta-catenin gene mutations in pancreatic duct lesions induced by N-nitrosobis(2-oxopropyl)amine in hamsters[J].Cancer Lett, 2001, 168(1): 1-6.
[11] KARAYIANNAKIS A J, SYRIGOS K N, POLYCHRONIDIS A, et al.Expression patterns of alpha-, beta- and gammacatenin in pancreatic cancer: correlation with E-cadherin expression, pathological features and prognosis [J].Anticancer Res, 2001, 21(6A): 4127-4134.
[12] PASCA DI MAGLIANO M, BIANKIN A V, HEISER P W, et al.Common activation of canonical Wnt signaling in pancreatic adenocarcinoma [J].PloS One, 2007, 2(11):e1155.
[13] JACKSON M A, LEA I, RASHID A, et al.Genetic alterations in cancer knowledge system: analysis of gene mutations in mouse and human liver and lung tumors [J].Toxicol Sci,2006, 90(2): 400-418.
[14] BAMFORD S, DAWSON E, FORBES S, et al.The COSMIC(Catalogue of Somatic Mutations in Cancer) database and website [J].Br J Cancer, 2004, 91(2): 355-358.
[15] FROELING F E, FEIQ C, CHELALA C, et al.Retinoic acidinduced pancreatic stellate cell quiescence reduces paracrine Wnt-β-catenin signaling to slow tumor progression [J].Gastroenterology, 2011, 141(4): 1486-1497.
[16] TAKAHASHI N, FUKUSHIMA T, YORITA K, et al.Dickkopf-1 is overexpressed in human pancreatic ductal adenocarcinoma cells and is involved in invasive growth [J].Int J Cancer, 2010, 126(7): 1611-1620.
[17] ZHONG Y, WANG Z, FU B, et al.GATA6 avtivates Wnt signaling in pancreatic cancer by negatively regulating the Wnt antagonist Dickkopf-1[J].PloS One, 2011, 6(7):e22129.
[18] NAWROTH R, VAN ZANTE A, CERVANTES S, et al.Extracellular sulfatases, elements of the Wnt signaling pathway, positively regulate growth and tumorigenicity of human pancreatic cancer cells [J].PLoS One, 2007, 2(4):e392.
[19] KOBAYASHI T, SHIMURA T, YAJIMA T, et al.Transient gene silencing of galectin-3 suppresses pancreatic cancer cell migration and invasion through degradation of β-catenin[J].Int J Cancer, 2011, 129(12): 2775-2786.
[20] CHO I R, KOH S S, MIN H J, et al.Pancreatic adenocarcinoma up-regulated factor (PAUF) enhances the expression of β-catenin, leading to a rapid proliferation of pancreatic cells [J].Exp Mol Med, 2011, 43(2): 82-90.
[21] WATSON R L, SPALDING A C, ZIELSKE S P, et al.GSK3beta and beta-catenin modulate radiation cytotoxicity in pancreatic cancer [J].Neoplasia, 2010, 12(5): 357-365.
[22] WANG L, HEIDT D G, LEE C J, et al.Oncogenic function of ATDC in pancreatic cancer through Wnt pathway activation and beta-catenin stabilization [J].Cancer Cell, 2009,15(3): 207-219.
[23] CHEN X, HAN G, ZHAI H, et al.Expression and clinical significance of CacyBP/SIP in pancreatic cancer [J].Pancreatology, 2008, 8(4-5): 470-477.
[24] LI Y J, WEI Z M, MENG Y X, et al.Beta-catenin upregulates the expression of cyclinD1, c-myc and MMP-7 in human pancreatic cancer: relationships with carcinogenesis and metastasis [J].World J Gastroenterol, 2005, 11(14):2117-2123.

