CT、MRI及PET/CT在鼻咽癌第七版UICC分期中的价值
丁忠祥 张福兴
1.浙江省人民医院放射科,浙江 杭州310014;2新加坡国立大学医院放射科,新加坡119074
鼻咽癌是一种独特的恶性肿瘤,是环境因素、遗传易感性和EB病毒相互作用的结果,中国南方和香港发病率最高,其次是新加坡和美国华裔[1]。鼻咽癌发生于结构复杂的鼻咽腔,位置隐蔽且常缺乏特异性症状,早期诊断困难。由于鼻咽癌的治疗直接取决于分期,因此准确地分期是必要的。临床检查提供黏膜受侵的情况,但不能判断深部的侵犯、颅底受侵或颅内播散的情况。2009年,国际抗癌协会(UICC)和美国癌症协会(AJCC)对2003年第六版鼻咽癌分期指南进行修改,形成了第七版鼻咽癌分期指南(表1)。与鼻咽癌第六版分期相比,第七版UICC分期将口咽和鼻腔受侵下调为T1,首次将咽后淋巴结归类为N1。指南中分期的大多数是由影像学而不是靠临床检查确定。这是因为影像学能确定关键的解剖结构有否受累。观察肿瘤的侵犯范围、有无颅底侵犯、有无颈部淋巴结受累及远处转移是精确制订治疗计划、提高鼻咽癌生存率的关键因素,这些均离不开影像学的支持。本文对CT、MRI、PET/CT在鼻咽癌TNM分期和放疗后复发再分期中的作用及各自的优缺点进行综述。

表1 鼻咽癌第七版UICC T、N分期标准Tab.1 Seventh edition of UICC staging system for nasopharyngeal carcinoma
1 影像学方法
鼻咽癌局部侵犯范围的评价主要根据CT或MRI检查, CT和MRI都能为鼻咽癌分期提供基本信息。CT具有较高的组织密度分辨力和无组织影像重叠的特点,能显示鼻咽腔及咽旁间隙等颌面深部软组织间隙的侵犯,而且CT扫描时间短,检查费用相对较低。MRI具有软组织分辨率高、多参数、多方位成像的优点,能更好地显示鼻咽癌原发灶侵犯的范围。MRI对于鼻咽癌超出鼻咽腔浸润(超腔侵犯)、咽旁间隙、口咽、咽后淋巴结、颅底骨质、海绵窦、鼻窦、颈椎和颞下窝等侵犯的检出率均明显高于CT[2]。与CT相比,MRI可使30%以上的鼻咽癌患者分期发生改变[3]。但CT、MR检查主要显示组织解剖结构,对直径< 1 cm的淋巴结难以定性,并且常遗漏远处转移灶,因此难以全面评价鼻咽癌患者的状况。
PET通过检测18F-FDG在肿瘤细胞内的摄取,能有效反映细胞的糖代谢水平,在检测肿瘤的原发灶及转移淋巴结中具有较高的灵敏度和特异度。但PET的缺点是空间分辨率低,组织结构显示较差。PET/CT是代谢影像和形态影像的有机融合,结合了PET图像的高的灵敏度和CT图像的高分辨率优点,同机CT提供的病变精确定位能辅助肿瘤原发灶或区域淋巴结转移的诊断。CT不仅具有PET图像衰减校正和病灶解剖定位的功能,且可克服PET因肌肉、脂肪、龋齿、涎腺、甲状腺和扁桃体等吸收FDG而可能导致的假阳性判断,对肿瘤淋巴转移的判断和N分期较单独PET或CT、MRI有明显优势[4]。King等[5]认为PET/CT在鉴别肿瘤原发灶、淋巴结转移及远处转移方面均优于CT、MRI等经典的分期手段。
2 影像学对TNM分期影响
2.1 T分期
鼻咽癌T分期根据鼻咽癌原发灶的大小及其对周围结构的侵犯情况分为4期。
2.1.1 T1:肿瘤局限于鼻咽、口咽部或鼻腔
鼻咽位于颅底下方,鼻咽壁自内向外由黏膜、肌肉和筋膜层组成。鼻咽顶壁为蝶窦和蝶骨基底部,后壁由枕骨基底部和上颈部构成,前壁与后鼻孔相连,侧壁由翼突内侧板、腭肌、咽鼓管咽口、咽鼓管圆枕及咽隐窝(Rosenmuller窝)构成,下壁与口咽相连。正常时鼻咽部两侧结构基本对称,鼻咽腔表面黏膜在增强CT或MRI的T2WI上呈较薄、厚度变化平缓和界面清楚的线样强化或高信号。鼻咽侧壁咽隐窝为鼻咽癌好发部位,该部位较隐蔽,早期病灶如位于黏膜下临床难以发现,CT或MRI可以观察到鼻咽的表层和周围结构,对鼻咽肿物的早期诊断有利,表现为鼻咽表面局限性隆起或黏膜下软组织肿物,当黏膜层有侵犯时表现为黏膜线模糊、局部增厚、中断或消失。MRI可清楚显示鼻咽壁黏膜、肌肉和筋膜三层结构,在诊断较小肿瘤、区分肿瘤与周围软组织方面优于CT。与肌肉相比,肿瘤在T1WI为等信号、T2WI呈稍高信号,增强后病灶明显均匀强化。
2.1.2 T2:肿瘤累及咽旁间隙
咽旁间隙内界为咽筋膜,外界为翼内肌、翼外肌的内侧缘。两侧咽旁间隙基本对称,横断图像上呈前窄后宽的三角形影像,前抵翼突内侧板,后至茎突,由外后斜向前内。咽旁间隙包括两部分:脂肪填充的茎突前咽旁间隙和容纳颈动脉鞘的茎突后咽旁间隙。在TNM分类法中咽旁间隙受累被定义为“超越鼻咽颅底筋膜的后外侧浸润”。咽颅底筋膜是鼻咽浅层和深层结构的分界线,其破坏与否是区分腔内和腔外侵犯的重要依据。该筋膜上缘附着于颅底,两侧附于翼突内板后缘,下缘与上中咽缩肌延续。其上部较厚,下部较薄,构成一个坚韧的结缔组织支架。从解剖上讲,肿瘤累及咽旁间隙首先需突破咽颅底筋膜,这在CT图像上不能直接显示,CT上一侧咽旁间隙变窄或两侧不对称可能是肿瘤累及,也可能是肿瘤的推移作用。MRI的T1WI、T2WI图像上咽颅底筋膜均表现为线状低信号,早期受累表现为线条中断,MRI能较直接地判断肿瘤的范围。在咽颅底筋膜被破坏之前,肿瘤呈弧形向外推移筋膜可导致咽旁间隙变形、狭窄(图1A),如果不伴有其他部位的超腔侵犯,此时仍应属于腔内肿瘤(T1期)。
2.1.3 T3:颅底骨质破坏和(或)副鼻窦受累
颅底骨质包括蝶骨基底部、枕骨基底部、岩骨、斜坡、蝶骨大翼、翼突内侧板及翼突外侧板等。副鼻窦则有蝶窦、上颌窦、筛窦及额窦。蝶窦骨壁是鼻咽癌最常见的骨质侵犯部位[6]。鼻咽癌常通过破坏骨壁侵入副鼻窦,蝶窦和上颌窦多见。CT的诊断优势是能够显示骨结构的详细情况,而MRI不能区分致密骨和窦腔内含气间隙,轻微的骨质侵蚀MRI容易造成漏诊。但岩骨尖、蝶骨及斜坡骨髓的侵犯在MRI上能更好地识别。MRI可以早期诊断骨髓腔受累而局部骨小梁尚未破坏的病变,表现为骨髓腔内正常高信号的脂肪组织被肿瘤组织代替,此时CT难以检出。虽然骨皮质的侵蚀常靠CT确诊,但对于骨髓的浸润MRI能更好地显示(图1B,1C)。因此,MRI对判断肿瘤骨质浸润优于CT。MRI可鉴别窦腔内是阻塞性潴留还是肿瘤的侵及,前者T1WI为低信号,T2加权呈高信号,增强后无强化,肿瘤入侵窦腔则其信号与肿瘤相同。Chong等[7]报道,以MRI为对照基准,CT可检出100%上颌窦、43%蝶窦和25%筛窦的肿瘤侵犯。
2.1.4 T4:肿瘤累及颅内、颅神经、喉咽部、眼眶或咀嚼肌间隙(颞下窝)
鼻咽癌颅内侵犯主要表现为颅内脑膜增厚、海绵窦增宽、海绵窦或颞叶下部肿块。肿瘤侵入颅内,首先侵犯脑膜,表现为脑膜增厚、强化或连续的脑膜中断。当颅内形成肿块时,大多数病例MRI增强后于冠状位或矢状位可见肿瘤穿过颅底与颅内肿块相连的强化影,这是明确诊断的可靠依据。
鼻咽癌有沿神经发展的特点,颅底骨质侵蚀常累及第Ⅲ~Ⅵ对脑神经,肿瘤侵犯茎突后间隙可导致第Ⅸ~Ⅻ脑神经麻痹。CT难以显示肿瘤累及颅神经的病变,尤其在颅底骨质无异常改变或颅底自然孔道(圆孔、卵圆孔、破裂孔及棘孔等)未见吸收扩大情况下。MRI则有明显优势,可以显示肿瘤沿颅底自然孔道内神经、血管表面浸润(图1D,1E)。三叉神经上颌支和下颌支神经周围浸润可导致鼻咽癌扩散至海绵窦,甚至更大范围。在MRI上,圆孔或卵圆孔周围脂肪消失可作为神经周围早期浸润的可靠征象。MRI可以比临床检查更早发现脑神经受累,以MRI诊断脑神经受累将使更多患者的T分期升级[8-9]。但目前UICC分期方法还没有发布正式的脑神经受累的MRI诊断标准。
眼眶的受累常发生于眶尖部,鼻咽部肿瘤可通过眶下裂、翼腭窝到达眶上裂侵犯至眶尖部或海绵窦。CT上表现为受侵部位软组织肿块并能被造影剂所强化,相应窦壁或眶壁骨质有破坏。MRI则表现为在T1WI上相应部位正常脂肪高信号消失,被异常软组织取代。
喉咽侵犯定义为肿瘤向下超过颈3椎体下缘或会厌游离缘[10],这两个解剖结构在CT或MRI上均易于定位和显示。
咀嚼肌间隙TNM分类法对咀嚼肌间隙受侵的定义为:肿瘤侵犯超出了翼外肌的前面或向侧面侵犯超出上颌窦的后外侧壁、翼突上颌裂。以翼内肌的内缘作为咀嚼肌间隙的分界比以翼外肌的前面作为分界更加合适。深部颈筋膜的浅层在下颌骨下缘区分开来以包裹咀嚼肌间隙,内层覆盖翼肌并嵌入颅底,外层覆盖咬肌并向上延续覆盖颧弓,然后沿颞肌的颅侧缘附着于颅盖骨上。翼外肌的前表面位于咀嚼肌间隙的深处。一旦肿瘤侵达咀嚼肌间隙便可发生下颌神经周围的浸润,通过卵圆孔沿神经周围的扩散是最为常见的颅内侵犯途径。咀嚼肌间隙受累的患者预后不佳可能与神经周围浸润有关。
综上所述,MRI在识别黏膜下病变、颅底骨髓浸润和颅内扩散方面优于CT,以CT分期的许多肿瘤,用MRI分期时期别会升高。CT和MRI的分期不同,将影响治疗方案的选择。
PET在检测鼻咽癌原发灶中的价值与CT或MRI相同[11]。PET可以显示病理生理特征,更容易发现早期病灶。未经治疗的鼻咽癌原发灶PET影像学特征为好发于鼻咽顶壁或侧壁、形态多变、具有侵袭转移特性的高代谢软组织肿块。同机PET/CT具有PET和CT的双重优点,在CT图像显示局部解剖结构基础上,通过对高代谢区形态及代谢活性的分析,可有效区分局部病变是肿瘤还是炎症,通过图像融合技术,也可对肿瘤的局部浸润做出有效诊断,达到对鼻咽癌进行精确T分期,较单独CT或MRI更具特异性[12-13]。T1期鼻咽癌病变可以表现为咽后侧顶壁结节状异常放射性代谢浓集影,范围局限于鼻咽腔内。而T2~T4期鼻咽癌患者表现为鼻咽壁软组织明显增厚,鼻咽腔不对称,咽腔狭窄,双侧咽旁间隙变形、移位,向前可累及蝶骨翼突、翼腭窝、后鼻孔;向上可累及枕骨斜坡、岩尖、破裂孔、蝶骨体、海绵窦,均呈高代谢状态。上述结构有无受累,均可直接改变肿瘤的TNM分期。通过PET/CT可以使鼻咽癌患者的临床T分期更准确。
2.2 N分期
影响N分期的因素主要有淋巴结受侵的部位、侧数及淋巴结的大小。N分期共有4期。
2.2.1 N0:未检测到阳性淋巴结
鼻咽是淋巴组织聚集的部位,淋巴引流丰富,故鼻咽癌有很高的淋巴转移率。鼻咽癌最常见的淋巴结转移是咽后外侧淋巴结、颈内静脉淋巴结上群(即颈上深淋巴结)。临床体检在评估淋巴结转移方面具有一定的局限性。CT和MRI是鼻咽癌淋巴结转移的主要影像检查手段。目前,多数学者认可的头颈肿瘤淋巴结转移的CT/MRI诊断标准,是颈淋巴结最短径≥10 mm(咽后≥5 mm),或淋巴结出现中心坏死、环形强化和包膜外侵犯[14-15]。
2.2.2 N1:锁骨上窝以上的单侧颈部、单侧或双侧咽后淋巴结转移,最大径<6 cm
咽后淋巴结为鼻咽癌淋巴结转移的第一站。第7版UICC分期首次在N1中加入了咽后淋巴结。MRI显示咽后淋巴结明显优于CT,有助于区分局部占位是茎突后间隙原发肿瘤的直接侵犯还是咽后淋巴结转移,从而影响鼻咽癌的T、N分期[16]。
2.2.3 N2:位于锁骨上窝以上的双侧淋巴结转移,最大径<6 cm与N1不同的是,N2强调双侧颈部淋巴结转移。鼻咽癌淋巴结转移的侧数在预后中具有重要的意义[17]。N2与N3相比,主要的区别在于淋巴结的大小和累及部位,前者淋巴结最大径<6 cm,且不累及锁骨上窝。CT可以较好地显示颈部淋巴结病变,尤其是在淋巴结坏死和包膜外浸润时。虽然评估淋巴结转移CT优于MRI[18-19],但在常规的临床实践中两者都可以胜任。
2.2.4 N3:分为N3a和N3b两个亚型,前者指转移淋巴结最大径>6 cm,后者指淋巴结转移至锁骨上窝第7版UICC分期中锁骨上区是指锁骨胸骨端上缘、锁骨肩峰端上缘及颈肩汇合点所围成的区域,中线淋巴结认为是同侧淋巴结[20]。锁骨上窝淋巴结转移关系到全身转移的危险性增加。
CT诊断鼻咽癌转移淋巴结的标准是根据淋巴结的大小,如果转移淋巴结较小,CT往往不能作出正确的判断。MRI虽在判断软组织、颅底骨质侵犯及咽后淋巴结转移等方面有优势,但在判断淋巴结性质方面与CT类似,仍依赖形态学特征,难以区分病灶良恶性。虽中心坏死、环形强化和包膜外侵犯可认为是肿瘤转移的特异性表现,但这些特征少见于小淋巴结。由于良恶性淋巴结的直径范围常存在重叠,肿大淋巴结未必是转移灶,转移淋巴结不一定都增大,以大小为标准易致假阳性和假阴性判断。18F-FDG PET是依据淋巴结的糖代谢水平判断其性质,因良恶性病灶的代谢活力常存在较大差异,故PET可检出小的阳性淋巴结,排除增大的阴性淋巴结,较准确判断淋巴结性质(图1F, 1G)。PET在评估头颈部肿瘤的颈部淋巴结转移方面优于MRI及CT,敏感性及特异性分别为90%和94%,CT为82%和85%,MRI为80%和79%[21]。PET/CT可以发现直径≤10 mm的转移淋巴结。Antoch等[4]对比研究了98例恶性肿瘤的MRI和PET/CT检查结果,两者N分期的准确率分别为79%和93%。
虽然PET/CT对淋巴结转移的定性诊断有优势,但也存在假阳性和假阴性。炎症或增生淋巴结,特别是含巨嗜细胞和粒细胞较多者,其PET常呈假阳性[22]。淋巴结坏死是肿瘤转移的特异表现,若坏死面积过大以致活力细胞过少,PET亦常不显影,但PET/CT中的融合CT会提示淋巴结存在大片低密度区,此时需结合其CT表现,而不局限于SUV值方可正确诊断。
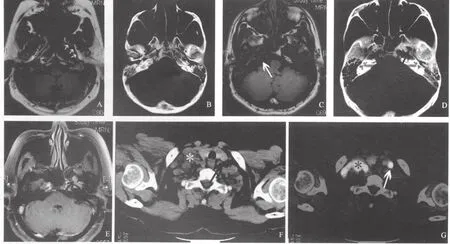
图1 CT、MRI及CT/PET在显示鼻咽癌累及范围中的应用Fig.1 Application of CT, MRI and PET/CT on nasopharyngeal carcinoma extension
2.3 M分期
纵膈淋巴结转移是鼻咽癌最常见的远处转移,其次是肺、肝和骨。约30%的鼻咽癌患者最终会发生远处转移,只有1/6的患者在确诊时检查出远处转移,10%~20%的鼻咽癌在确诊时没能发现已经存在的转移病灶[23]。尽管在某些情况下可以行全身CT或MRI检查,但临床上并不现实。由于具备全身扫描技术,PET/CT可以较易探测到远处转移灶。同机PET/CT的使用可以有效弥补单一PET或单一CT的局限性,在检测鼻咽癌远处转移中更具敏感性和特异性。
3 鼻咽癌复发时3种影像学检查的优缺点
鼻咽癌放疗后复发是指肿瘤完全消退后又再出现。肿瘤复发是鼻咽癌重要的预后因素。复发的肿瘤也是用同一种TNM分类方法进行分期。为了把复发的肿瘤分期分类法与初发肿瘤的分类法区分开来,便使用了字母“r”,如rT1或rN1。
鼻咽癌放疗后局部出现纤维组织增生和瘢痕形成,可导致鼻咽部软组织增厚、咽隐窝和咽鼓管口变平、咽侧壁僵硬、咽旁间隙闭塞等影像学改变。此类病变与鼻咽癌早期复发或侵犯颅底的异常影像常难以区别,是目前影像诊断的难点。在鼻咽癌患者的随访中,CT发现肿块明显增大,则视为病灶复发。但在CT图像上,放疗后纤维化和肿瘤复发灶均表现为软组织密度,两者难以鉴别。MRI良好的软组织分辨力有助于鉴别放疗后纤维化和肿瘤复发灶。肿瘤复发在形态上表现为肿块和占位效应,T2WI图像上呈偏高或高信号强度,Gd-DTPA增强后有中等度以上的强化,放疗后的纤维疤痕是边缘不清的弥漫性改变,随病程的长短不一而呈不同的信号强度表现。成熟的纤维疤痕在T2WI图像上呈低信号,增强后无明显强化,随访过程显示病灶是稳定的;未成熟的纤维疤痕由肉芽组织构成,其信号强度和增强后强化程度均与肿瘤复发灶相似,常规CT和MRI检查难以鉴别[24]。功能MRI,如斜坡动态MRI检查对于骨质放疗后纤维化、骨坏死与肿瘤复发的鉴别具有一定的价值[25]。
由于PET能够动态、定量地从细胞分子水平观察肿瘤组织特有的生化代谢等生物学特征,在肿瘤病变的定性诊断上不是基于病灶的大小而是基于病灶的代谢活性,因而具有较高的特异性和准确性[26]。鼻咽癌复发或残存病灶的18F-FDG的摄取较正常组织明显增高,结合同机CT影像,可区分复发的肿瘤和周围组织的纤维化。Yen等[27]研究显示,PET在检测鼻咽癌复发中优于MRI。Liu等[28]分析了1990年至2007年的21个研究,结果表明,与CT及MRI相比,PET是诊断鼻咽癌局部复发最好的手段,PET/CT则更具优势。徐国增等[29]对符合纳入标准的20篇中英文文献共971例鼻咽癌放疗后复发或残留患者的PET(PET/CT)及MRI资料进行荟萃分析,发现PET或PET/CT诊断鼻咽癌放疗后局部残留或复发的准确性高于MRI,可为临床实践提供依据。对于鼻咽癌放疗后复发再分期患者,PET/CT可以作为首选的影像学检查手段[30]。
4 小结
与鼻咽癌第六版分期相比,第七版UICC分期将口咽和鼻腔受侵下调为T1,首次将咽后淋巴结归类为N1。CT作为基本的鼻咽癌影像学评估手段,在鼻咽癌分期中发挥着重要作用。MRI具有较高的软组织分辨率,在原发肿瘤的侵犯范围、颅底骨质破坏及咽后淋巴结的界定方面明显优于CT。PET/ CT融合了功能影像和解剖成像,对原发灶的累及范围、远处转移的筛查及肿瘤复发的诊断具有独特的优势。明确这3种影像学检查手段的特点及优势、合理选用影像学检查方法对鼻咽癌分期及复发后再分期具有重要的价值。
[1] PARKIN D M, WHELAN S L, FERLAY J, et al.Cancer incidence in five continents, vol.Ⅶ[M].Lyon: IARC Scientific Publications, Number 143, 1997.
[2] 潘建基, 宗井凤.鼻咽癌UICC/AJCC分期与’92分期的研究进展[J].肿瘤学杂志, 2009, 15(7): 582-588.
[3] 孙颖, 毛燕萍, 马骏, 等.MRI在鼻咽癌分期中的作用[J].癌症, 2007, 26(2): 158-163.
[4] ANTOCH G, VOGT F M, FREUDENBERG L S, et al.Wholebody dual-modality PET/CT and whole-body MRI for tumor staging in oncology[J].JAMA, 2003, 290(24): 3199-3206.
[5] KING A D, MA B B, YAU Y Y, et al.The impact of 18F-FDG PET/CT on assessment of nasopharyngeal carcinoma at diagnosis[J].Br J Radiol, 2008, 81(964): 291-298.
[6] A1TUN M, TENEKECI N, KAYTAN E, et a1.Locally advanced nasopharyngeal carcinoma: computed tomography findings, clinical evaluation, and treatment outcome[J].Int J Oncol Biol Plays, 2000, 47: 401-404.
[7] CHONG V F, FAN Y F, KHOO J B.Computed tomographic and magnetic resonance imaging finding in paranasal sinus involvement in nasopharyngeal carcinoma[J].Ann Acad Med Singapore, 1998, 37: 800-804.
[8] CHENG S H, TSAI S Y, HORNG C F, et al.A prognostic scoring system for locoregional control in nasopharyngeal carcinoma following conformal radiotherapy[J].Int J Radiat Oncol Biol Phys, 2006, 66(4): 992-1003.
[9] 黄文瑾, 莫浩元, 邓满泉, 等.鼻咽癌伴脑神经损伤与预后关系的探讨[J].临床耳鼻咽喉与头颈外科杂志, 2009,23(21): 964-967.
[10] CHONG V F, FAN Y E.Skull base erosion in nasopharyngeal carcinoma: detection by CT and MRI[J].Clin Radiol, 1996,51: 625-631.
[11] YEN T C, CHANG Y C, CHAN S C, et al.Are dual-phase18F-FDG PET scans necessary in nasopharyngeal carcinoma to assess the primary tumour and loco-regional nodes? [J].Eur J Nucl Med Mol Imaging, 2005, 32(5): 541-548.
[12] 罗耀武, 唐安戊, 徐卫平.18F-FDG PET显像诊断原发性鼻咽癌的价值[J].中华核医学, 2003, 23(5): 271-274.
[13] CHAN S C, CHANG J T, WANG H M, et al.Prediction for distant failure in patients with stage M0nasopharyngeal carcinoma: the role of standardized uptake value[J].Oral Oncol, 2009, 45(1): 52-58.
[14] VAN DEN BREKEL M W, STEL H V, CASTELIJNS J A, et al.Cervical lymph node metastasis: assessment of radiologic criteria[J].Radiology, 1990, 177(2): 379-384.
[15] KING A D, AHUJA A T, LEUNG S F, et al.Neck node metastases from nasopharyngeal carcinoma: MR imaging of patterns of disease[J].Head Neck, 2000, 22(3): 275-281.
[16] 唐玲珑, 刘立志, 马骏, 等.咽后淋巴结转移在鼻咽癌分期中的意义[J].癌症, 2006, 25(2): 129-135.
[17] MAO Y P, LIANG S B, LIU L Z, et al.The N staging system in nasopharyngeal carcinoma with radiation therapy oncology group guidelines for lymph node levels based on magnetic resonance imaging[J].Clin Cancer Res, 2008, 14: 7497-7503.
[18] YOUSEM D M, SOM P M, HACKNEY D B, et al.Central nodal necrosis and extracapsular neoplastic spread in cervical lymph nodes: MR imaging versus CT[J].Radiology, 1992,182(3): 753-759.
[19] CURTIN H D, ISHWARAN H, MANCUSO A A, et al.Comparison of CT and MR imaging in staging of neck metastases[J].Radiology, 1998, 207(1): 123-130.
[20] LESLIE S, MARY G, CHRISTIANN W, et al.International union of against cancer TNM classification of malignant tumours[M].7th ed.Hoboken: Wiley-Blackwell, 2009:30-38.
[21] LIU M T, HSIEH C Y, CHANG T H, et a1.Prognostic factors affecting the outcome of nasopharyngeal carcinoma[J].Jpn J Clin Oncol, 2003, 33(10): 501-508.
[22] 张国义, 胡伟汉, 刘立志, 等.PET/CT与MRI在鼻咽癌淋巴结转移诊断和N分期中的比较研究[J].中华肿瘤杂志,2006, 28(5): 381-384.
[23] 黎功, 郑静晨, 于金明, 等.FDG PET在鼻咽癌分期中的作用(26例评估分析)[J].中国肿瘤, 2007, 16(12): 1015-1017.
[24] CHONG V F, FAN Y F.Detection of recurrent nasopharyngeal carcinoma: MR imaging versus CT[J].Radiology, 1997,202(2): 463-470.
[25] 丁忠祥, 梁碧玲, 沈君, 等.动态增强MRI在鼻咽癌斜坡改变中的初步应用[J].临床放射学杂志, 2005, 24(8): 684-687.
[26] AL-AMRO A, SALEEM M, BAKHEET S, et al.The Role of 18-FDG positron emission tomography (FDG-PET) in detecting post-radiotherapy loco regional relapse/residual disease in nasopharyngeal cancer[J].J Egypt Natl Cancer Inst, 2009, 21(4): 279-285.
[27] YEN R F, HUNG R L, PAN M H, et al.18-fluoro-2-deoxyglucose positron emission tomography in detecting residual/recurrent nasopharyngeal carcinomas and comparison with magnetic resonance imaging[J].Cancer, 2003, 98:283-287.
[28] LIU T, XU W, YAN W L, et al.FDG-PET, CT, MRI for diagnosis of local residual or recurrent nasopharyngeal carcinoma, which one is the best? A systematic review[J].Radiother Oncol, 2007, 85(3): 327-335.
[29] 徐国增, 朱小东, 李明耀.FDG PET或PET-CT与MRI判断鼻咽癌放疗后局部残留或复发价值荟萃分析[J].中华放射肿瘤学杂志, 2010, 19(5): 391-395.
[30] LING C C, HUMM J, LARSON S, et al.Towards multidimensional radiotherapy (MD-CRT): biological imaging and biological conformality[J].Int J Radiat Oncol Biol Phys, 2000, 47(3): 551-560.

