白藜芦醇对小鼠移植宫颈癌的抑制作用及机制研究
胡可可 谭琛 张琴 陈晓琼 邓赫男 肖斌梅
郴州市第一人民医院妇产科,湖南 郴州 423000
宫颈癌是危害妇女生命及降低妇女生活质量的主要疾病之一,发展中国家发病率高于发达国家,农村高于城市。在我国,宫颈癌发病率占妇女恶性肿瘤之首,约占女性生殖器恶性肿瘤的72.4 %~93.1%。影响中国已婚妇女宫颈癌发生的主要危险因素是:人类乳头瘤病毒感染、人工流产次数、性伴侣、被动吸烟及丈夫包皮过长等[1]。白藜芦醇(resveratrol,Res)是一类主要存在于葡萄、藜芦、虎杖等植物中的非黄酮多酚类化合物,化学名称为反式-3,4,5-三羟基-1,2-二苯乙烯,分子式C12H14O3,具有抗氧化、抗炎、 雌激素样活性、生长抑制、免疫调节、化学预防以及抗肿瘤等多种生物活性[2]。新近研究发现,Res在细胞水平可通过诱导细胞凋亡、影响信号传导通路等多途径抑制宫颈癌细胞的生长[3],但体内水平研究尚未见报道。615近交系小鼠宫颈癌U14在移植同系小鼠后具有淋巴和血道双向转移的特性,其生物学行为与临床宫颈癌患者相似[4]。因此,本实验利用该小鼠宫颈癌动物模型,研究Res对宫颈癌细胞增殖的影响,并初步探讨其抗癌机制。
1 材料和方法
1.1 药品与主要试剂
Res购于美国Sigma公司,顺铂注射液购自江苏豪森药业股份有限公司。TRIzol试剂、SuperscriptⅡ逆转录试剂盒及PCR试剂盒购于美国Invitrogen公司,PCR Marker购于上海鼎国生物公司,引物由上海生工生物工程公司合成。BCA 蛋白定量测定试剂购自Hyclone-Pierce公司。TUNEL凋亡检测试剂盒以及SABC免疫组化试剂盒购于武汉博士德生物工程有限公司。巨噬细胞移动抑制因子(macrophage migration inhibitory factor,MIF)兔抗鼠一抗购于美国Santa Cruz公司。CD34兔抗鼠一抗、DAB显色剂均购自福州迈新生物工程公司。
1.2 动物及肿瘤细胞株
615 近交系小鼠40只,6周龄,雌性,体重(20.0±2.0) g,购自中国医学科学院协和医科大学实验动物中心,并在SPF级环境下饲养。小鼠宫颈癌U14瘤细胞株由中国医学科学院肿瘤研究所提供,经常规复苏后,接种于615近交系小鼠腹腔传代。当小鼠腹水呈乳白色时,采集腹水并用磷酸盐缓冲液(PBS)稀释成5×107/mL瘤细胞悬液备用。
1.3 模型制备与分组给药
40只615 近交系小鼠均于右侧背部皮下注射瘤细胞1×107个/只(0.2 mL),每天观察小鼠及局部成瘤情况,肿瘤直径≥2.0 mm时为成瘤。皮下接种肿瘤后第6天,40只小鼠皮下移植处均成瘤,将小鼠随机分成4组:对照组、Res低剂量组、Res高剂量组、顺铂组,每组10只。根据预实验的结果,将Res低、高剂量组中每天每只小鼠Res的量定为2.5、10 mg/kg,并溶解于0.1 mL 0.9%的氯化钠溶液中,每天灌胃1次;对照组每天用同体积的0.9%氯化钠溶液灌胃;顺铂组小鼠给予3 mg/kg顺铂注射液腹腔注射,连续给药20 d。给药期间观察各组小鼠的精神、反应、活动、饮食及大小便等一般情况。第26天处死全部小鼠进行指标检测,并将肿瘤组织分为3部分,分别用于RT-PCR检测、Western blot检测和4%甲醛溶液固定后,石蜡包埋,切片,供免疫组织化学、病理学及凋亡检查。
1.4 抑瘤率测定
接种前和接种后每两天称1次体重,按体重变化调整给药。接种后每两天测量1次小鼠皮下肿瘤最长径(a)和最短径(b),计算肿瘤体积(V= a×b2/2)。第26天颈椎脱臼处死小鼠,完整剥离肿瘤称重,计算抑瘤率,抑瘤率=(1-治疗组平均瘤质量/对照组平均瘤质量)×100%。
1.5 RT-PCR检测MIF基因表达
采用TRIzol试剂抽提肿瘤组织总RNA,获得的RNA按SuperscriptⅡ逆转录试剂盒说明合cDNA,按PCR试剂盒说明书进行DNA扩增。MIF引物序列为[5]:5’-GCAAGCCCGCACAGTACA-3’和5’-CGTTCGTGCCGCTAAAAGTC-3’,扩增产物长度468 bp;内参照基因β-actin引物序列为:5’-AGGGAAATCGTGCGTGACATCAAA-3’和5’-ACTCATCGTACTCCTGCTTGCTGA-3’,扩增产物长度198 bp。PCR反应条件:94 ℃预变性5 min,然后94 ℃ 60 s、56 ℃ 30 s、72 ℃60 s进行35个循环,最后72 ℃延伸 7 min。在1.5%含溴乙锭的琼脂糖凝胶电泳,紫外灯下观察结果,以PCR Marker作为标准分子量参照进行产物鉴定。用Total lab分析软件进行条带扫描分析,测量电泳条带密度,计算MIF mRNA相对量。MIF mRNA相对量=MIF产物电泳条带密度/β-actin产物电泳条带密度。
1.6 Western blot检测MIF蛋白表达
将肿瘤组织放入液氮碾磨,三去污裂解液裂解。BCA 法测定蛋白浓度,50 μg蛋白与加样缓冲液混合,在10%不连续十二烷基硫酸钠-聚丙烯酰胺凝胶电泳胶中电泳分离,电转移至PVDF膜,温育一抗、二抗,以β-actin为内参照,用ECL发光法显色,曝光、显影、定影。胶片条带用薄层扫描仪进行扫描后,运用Imager2200软件分析各产物积分光密度值,计算MIF 蛋白相对量。MIF蛋白相对量=MIF积分光密度值/β-actin积分光密度值。
1.7 HE及免疫组织化学染色
取肿瘤组织,10%中性甲醛固定、石蜡包理,5 μm连续切片,HE染色,光镜观察。采用免疫组化SABC法检测肿瘤组织微血管密度(microvessel density,MVD)的表达,严格按照试剂盒说明书进行操作,阴性对照用PBS代替一抗。MVD的判定标准,凡与邻近的肿瘤细胞、微血管或结缔组织分开的,呈棕黄色CD34阳性染色的单个内皮细胞或内皮细胞串计为一个血管,但肌层较厚,或管腔面积大于8个红细胞直径的血管不计数。MVD计数参考Weidner[6]的方法,先在低倍镜下扫视整个组织切片,在肿瘤浸润区选择内皮细胞染色清晰,背景良好,微血管最密集的4个视野,然后在高倍镜视野范围内计数所有染色的微血管,取4个视野的计数结果均数为该切片的微血管数。
1.8 肿瘤细胞凋亡
用TUNEL原位凋亡法检测,方法步骤严格按试剂盒说明书进行,同时设立阳性对照与阴性对照。细胞核内出现棕黄色颗粒为阳性细胞。凋亡细胞半定量分析:在400高倍视野下,每张切片计数5个高倍视野,分别计算每个视野细胞核数及凋亡阳性细胞核数,取均值,计算凋亡指数(apoptosis index,AI):AI(%)=凋亡阳性的细胞核数/总计数的细胞核×100%。
1.9 统计学处理
2 结 果
2.1 移植瘤组织病理学观察
对照组癌细胞浸润周围组织呈巢状分布,细胞形状不规则,大小不一,核大深染,核浆比例增大,核异形性明显,可见病理性核分裂相。各组内均可见组织坏死区,对照组相对较少。Res低、高剂量组癌细胞皱缩,核固缩或碎裂,可见凋亡细胞,顺铂组见片状坏死的癌细胞。
2.2 Res对移植瘤生长的抑制作用
用药期间,顺铂组小鼠逐渐出现精神萎靡不振,活动减少,食欲下降,毛发干涩脱落,消瘦等表现。其余各组一般状况良好,未见明显不良反应。接种瘤细胞后各组肿瘤体积均逐渐增大。治疗初期,各组肿瘤生长速度相似。治疗5 d后,治疗组肿瘤生长速度明显慢于对照组。在治疗终点,与对照组相比,Res高剂量组和顺铂组肿瘤体积缩小,肿瘤质量明显下降(P<0.01),而Res低剂量组与对照组比较则差异无统计学意义(P>0.05)。Res高剂量组和顺铂组抑瘤率显著高于Res低剂量组(P<0.01)。Res高剂量组肿瘤体积、肿瘤质量、抑瘤率与顺铂组比较差异无统计学意义(P>0.05,表1)
2.3 Res对肿瘤组织MIF表达的影响
条带密度扫描及半定量分析显示,Res高剂量组和顺铂组MIF mRNA和蛋白表达水平较对照组显著降低(P<0.01),但低剂量Res对其表达无明显影响(P>0.05)。顺铂组MIF mRNA和蛋白表达水平明显低于Res各剂量组(P<0.05或0.01,图1、2)。
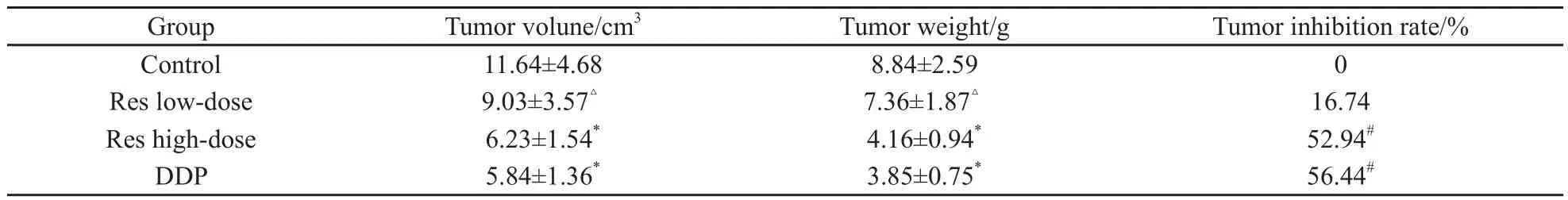
表1 Res对移植瘤生长的影响Tab.1 Effect of Res on transplanted tumor growth
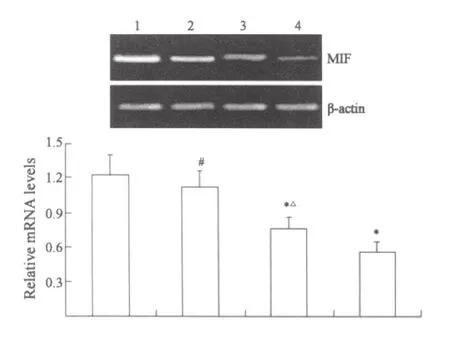
图1 各组肿瘤组织MIF mRNA表达Fig.1 Expression of MIF mRNA in tumor tissues among groups
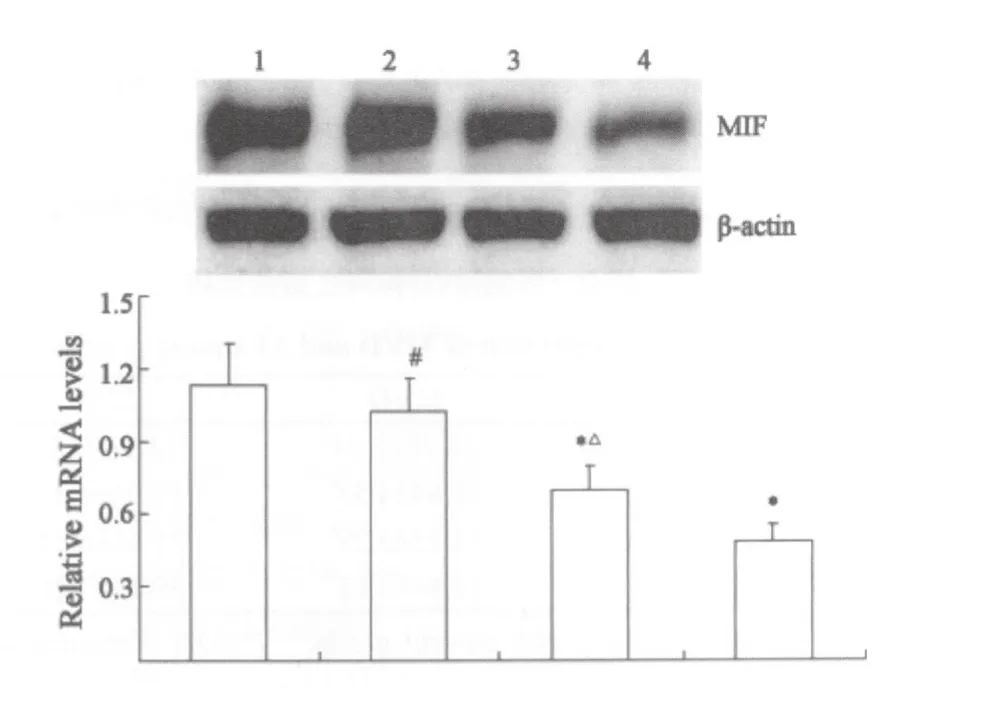
图2 各组肿瘤组织MIF 蛋白表达Fig.2 Expression of MIF protein in tumor tissues among groups
2.4 Res对肿瘤血管生长的影响
免疫组织化学染色显示,肿瘤组织切片中,微血管密集区多位于肿瘤细胞浸润的前缘部位,内皮细胞被染成棕黄色(图3)。Res高剂量组和顺铂组与对照组比较,MVD明显减少,差异有统计学意义(P<0.01),但Res低剂量组与对照组相比差异无统计学意义(P>0.05)。Res低剂量组MVD显著高于顺铂组(P<0.01),然而Res高剂量组和顺铂组比较差异无统计学意义(P>0.05,表2)。
2.5 Res对肿瘤细胞凋亡的影响
TUNEL染色显示,凋亡细胞明显固缩,核致密,深染为棕黄色多叶状或新月状颗粒,常聚集在核周边;未凋亡的细胞核呈蓝绿色(图4)。Res高剂量组和顺铂组AI显著高于对照组(P<0.01),但Res低剂量组AI与对照组比较,差异无统计学意义(P>0.05)。Res低剂量组AI显著低于顺铂组(P<0.01),但Res高剂量组和顺铂组比较差异无统计学意义(P>0.05,表2)。

图3 各组肿瘤组织CD34表达情况Fig.3 Expression of CD34 in the tumor tissues among groups
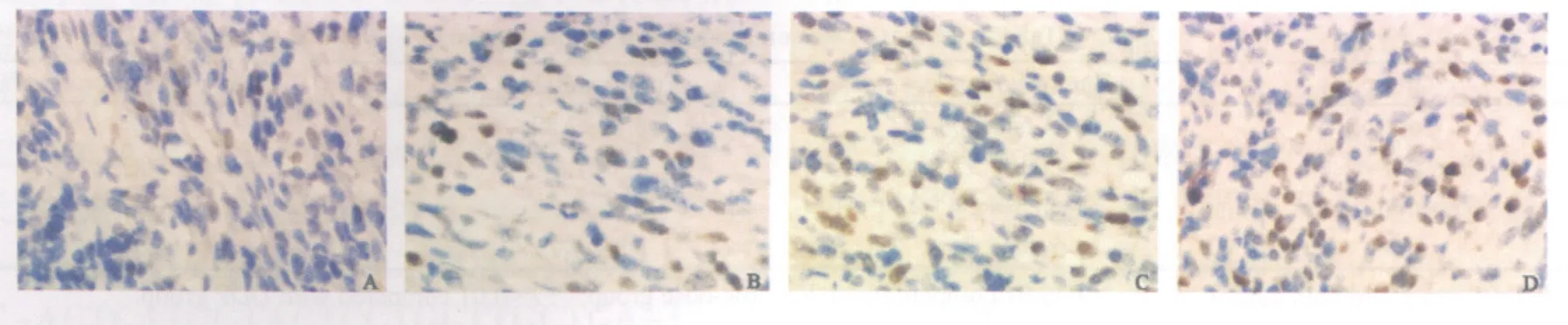
图4 各组肿瘤细胞凋亡情况Fig.4 Apoptosis of tumor cells among groups(TUNEL, ×400)
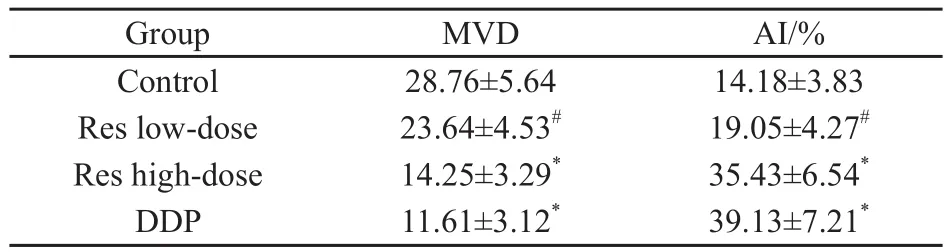
表2 各组MVD和凋亡指数比较Tab.2 Comparison of MVD and AI among groups
3 讨 论
宫颈癌是较常见的妇科肿瘤,治疗以手术为主术后多联合化、放疗。目前由于化疗药物多有较大不良反应,限制了临床应用,影响了其疗效,因而寻找抗瘤效果好而毒性低的药物是一项紧迫的任务。近年来,Res抗肿瘤的效能日益受到关注,在肿瘤发生、发展中均显示抗肿瘤功效[7]。本研究表明,Res对宫颈癌移植瘤具有显著的抑制作用,与Res抑制其它肿瘤生长的报道一致。其机制可能与Res通过清除小蛋白 RNA 还原酶的酪氨酰基来抑制 RNA 还原酶的活性有关。Res还能抑制DNA 聚合酶,对该酶的抑制可以从根本上降低DNA 的合成能力,从而达到抑制细胞增殖的作用[8]。此外,本实验过程中,Res各剂量组小鼠的一般情况较好,体质量增加,而顺铂组小鼠的一般情况较差,体质量减轻明显,说明本实验治疗剂量的Res对小鼠的重要脏器无不良反应,10 mg/kg Res的抑瘤作用与3 mg/kg顺铂相当,但不良反应更小。
MIF作为经典炎症细胞因子,不仅参与机体炎症及免疫反应,也成为独特的促肿瘤发生发展的细胞因子之一。近年来多项研究结果证明MIF直接影响正常细胞的分裂和癌基因诱导的恶性转化,或间接通过调节机体免疫反应、影响细胞抑癌基因p53的功能、促进细胞增殖和迁移、促进血管生成等多个方面影响肿瘤的发生和发展,是患者预后不良的指征[9]。本研究的前期研究发现,MIF在宫颈癌组织中高表达,而且其表达水平与宫颈癌的临床分期、病理分化程度、淋巴结转移、瘤体大小密切相关[10]。本研究结果表明,Res高剂量组MIF mRNA和蛋白表达水平较对照组显著降低,但低剂量Res对其表达无明显影响,提示适当浓度的Res在体内能明显地下调MIF的表达,从而抑制肿瘤的生长。
新生血管形成对实体肿瘤生长和转移必不可少,MVD是反映肿瘤血管生成活性或强度的重要定量指标之一,对于血管抑制药物的疗效评价十分有用,其所选取的血管内皮细胞标记物中以CD34抗原特异性最高,重复性最好。CD34能清晰地选择性地显示血管内皮细胞,其它组织不着色。这就为免疫组织化学定量研究肿瘤内血管生成提供了依据。符慧群等[11]研究发现,Res通过下调血管内皮生长因子表达抑制小鼠Lewis肺癌血管生成。本实验结果显示,对照组MVD值最高,表明宫颈癌在生长过程中形成了丰富的新生血管,从而促进了肿瘤的生长,应用Res治疗后,高剂量组MVD显著降低,而低剂量组与对照组比较差异无统计学意义,提示Res在体内能明显抑制肿瘤内血管形成,从而抑制宫颈癌的增殖。
细胞凋亡是基因控制下的细胞程序性死亡过程,凋亡受阻是包括肿瘤在内的多种人体疾病的重要发病机制,因此,诱导肿瘤细胞凋亡成为当今肿瘤治疗的热点。目前已有大量的实验证明,Res对多种肿瘤细胞具有诱导凋亡作用[12]。Bhat等[13]发现Res抑制子宫内膜癌生长的途径主要通过激活半胱氨酸蛋白酶Caspase-3,接着分解DNA修复酶中的poly-A聚合酶,最终诱导其凋亡。周学武等[3]的研究也表明,Res对人宫颈癌HeLa细胞有明显的凋亡阳性反应,且随时间延长凋亡率增加。本研究提示,适当浓度的Res能明显促进宫颈癌细胞凋亡。
综上所述,本研究表明,Res对小鼠宫颈癌的生长具有明显抑制作用,并且不良反应较低,其机制主要与下调MIF表达、抑制肿瘤内微血管生成和促进肿瘤细胞凋亡有关。深入研究Res的抗癌作用,将为宫颈癌的治疗带来新的希望。
[1] 周权, 黄民主, 黄霜, 等.中国已婚妇女宫颈癌发病影响因素Meta分析[J].中国癌症杂志, 2011, 21(2):125-129.
[2] 胡凌云, 王海钠, 裴俊俊, 等.白藜芦醇防癌抗癌作用及其分子机制研究进展 [J].山东医药, 2010, 50(5):111-112.
[3] 周学武, 陈建荣, 刘桂艳, 等.白藜芦醇对人宫颈癌 HeLa细胞凋亡、增殖影响的实验研究 [J].齐齐哈尔医学院学报, 2008, 29(20): 2457-2459.
[4] 陶光实, 杨盛波, 胡锦跃, 等.转染HPV的宫颈癌U14移植同系小鼠后生长特性和转移规律的研究[J].湖南医科大学学报, 2001, 26(6): 515-519.
[5] WONG B L, ZHU S L, HUANG X R, et al.Essential role for macrophage migration inhibitory factor in gastritis induced by Helicobacter pylori [J].Am J Pathol, 2009, 174(4): 1319-1328.
[6] WEIDNER N.Tumor angiogenesis: Review of current application in tumor prognosis [J].Semin Diagn Pathol,1999, 10(4): 302-313.
[7] BISHAYEE A.Cancer prevention and treatment with resveratrol: from rodent studies to clinical trials [J].Cancer Prev Res, 2009, 2(5): 409-418.
[8] SUN N J, WOO S H, CASSADY J M, et al.DNA polymerase and topoisomerase II inhibitors from psoralea corylifolia [J].J Nat Prod, 1998, 61(3): 362-366.
[9] CONROY H, MAWHINNEY L, DONNELLY S C.Inflammation and cancer: macrophage migration inhibitory factor (MIF)-the potential missing link [J].QJM, 2010,103(11):831-836.
[10] 胡可可, 陈晓琼, 邓赫男, 等.巨噬细胞移动抑制因子和血管内皮生长因子在宫颈癌中的表达及意义 [J].现代医药卫生, 2010, 26(7):970-971.
[11] 符慧群, 曹培国, 罗红, 等.白藜芦醇对小鼠 Lewis肺癌生长的影响及机制研究[J].肿瘤, 2007, 27(7):531-534.
[12] KO Y C, CHANG C L, CHIEN H F, et al.Resveratrol enhances the expression of death receptor Fas/CD95 and induces differentiation and apoptosis in anaplastic large-cell lymphoma cells [J].Cancer Lett, 2011, 309(1): 46-53.
[13] BHAT K P, PEZZUTO J M.Cancer chemopreventive activity of resveratrol [J].Ann NY Acad Sci, 2002, 57(3): 210-214.

