DNS法对三七总多糖含量测定
熊艺花,李 婧,黄 松,袁 捷,赖小平
(1.广州中医药大学,广东 广州510006;2.东莞广州中医药大学 中医药数理工程研究院,广东 东莞523808)
中药三七为五加科植物人参三七(Panax notoginseng(Burk.)F H.Chen)的干燥根,主产于云南、广西等地,野生或栽培,其性温,味甘、微苦,具有活血化瘀、消肿定痛的功效[1],是我国传统名贵中药材,目前多用于冠心病、心绞痛等心血管系统疾病的防治。近年来,通过对三七多糖的药理研究,发现三七多糖具有增强免疫功能等活性作用[2-3]。目前多糖的含量测定方法有苯酚-硫酸比色法、蒽酮-硫酸比色法、DNS法等。崔秀明等[4]运用苯酚-硫酸比色法测定了三七中总多糖成分的含量,但本实验发现苯酚-硫酸法在实验过程中结果不稳定,另外,硫酸具有较强的腐蚀性,给实验操作带来极大不便。DNS法操作简单,结果稳定。本文采用DNS法对三七中总多糖进行含量测定,建立三七总多糖的含量测定方法,以期为系统评价三七药材的质量提供一定的资料。
1 材料
1.1 仪器
Aquapro艾科浦u系列纯水机,CP225D十万分之一电子天平(德国sartorius公司);KQ5200DA型数控超声清洗器(昆山市超声仪器公司);Thermo Helios r紫外分光光度仪。
1.2 药材与试剂
D-无水葡萄糖对照品(批号:1108333-200503,购于中国药品生物制品检定所);三七饮片(批号:090921、091001、091125,购于广州致信饮片公司,由广州中医药大学赖小平研究员鉴定);3,5-二硝基水杨酸,NaOH溶液,酒石酸钾钠,苯酚,亚硫酸钠,HCl溶液等试剂均为分析纯。
2 方法与结果
2.1 DNS试剂的配制[5]
称取3,5-二硝基水杨酸3.15g,溶于131mL 2mol·L-1NaOH溶液中,再将其加入到250mL含91.0g酒石酸钾钠的热水溶液中,搅拌使其溶解,然后加入2.5g苯酚和2.5g亚硫酸钠,充分搅拌,溶解,冷却后定容至500mL棕色容量瓶中储存,室温放置1周稳定后使用。
2.2 三七供试品溶液的制备
2.2.1 三七总多糖样品制备
精密称取三七粉末5.0g,置250mL容量瓶中,加入蒸馏水200.0mL,超声提取2h,冷却至室温,加蒸馏水至刻度,4 000r·min-1离心10min。精密移取上清液100.0mL,置250mL茄形瓶中,减压回收至干,用蒸馏水少量多次将其溶解至10mL容量瓶中,加水定容至刻度。将浓缩液用40.0mL无水乙醇洗至100mL三角锥形瓶中,充分振摇混匀,置冰箱中冷藏放置过夜。将上述溶液转至离心管中4 000r·min-1离心5min,残渣用80%乙醇洗涤4次,每次10mL。将上述残渣用蒸馏水溶解至100mL容量瓶中,加蒸馏水定容至刻度,即得总多糖样品。每个样品平行3份。
2.2.2 三七总多糖样品水解
精密移取上述三七多糖样品溶液20.0mL,置三角锥形瓶中,加入10mL 6mol/L HCl溶液(现配),封口,于沸水浴上加热30min,取出冷却至室温,用6mol/L NaOH溶液调pH值至8.0,4 000rpm离心5min,残渣用水洗涤,上清液与水洗涤液一并置50mL容量瓶中,用蒸馏水定容至刻度,摇匀即得三七多糖水解液样品。
2.3 测定波长的选择
2.3.1 对照品溶液显色扫描
精密移取葡萄糖对照品溶液0.8mL置具塞试管中,加水至2.0mL,加入1.5mL DNS试剂,摇匀,于沸水浴中加热5min,取出后迅速冷却,随行以2.0mL蒸馏水作空白,用紫外-可见分光光度计于200~800nm进行全波长扫描,结果见图1。
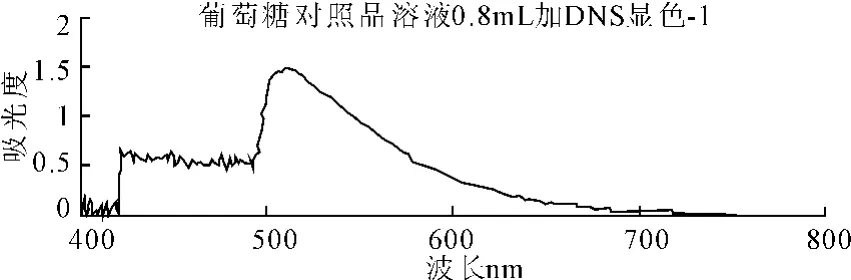
图1 葡萄糖溶液显色UV扫描
2.3.2 三七供试品显色扫描
精密移取三七多糖水解液样品2.0mL置10mL容量瓶中,加水稀释至刻度,精密移取上述溶液0.3mL置具塞试管中,加蒸馏水至2.0mL,加入1.5mL DNS试剂,摇匀,于沸水浴中加热5min,取出后迅速冷却,随行以2.0mL蒸馏水作空白,用紫外-可见分光光度计于200~800nm进行全波长扫描,其吸收曲线见图2。
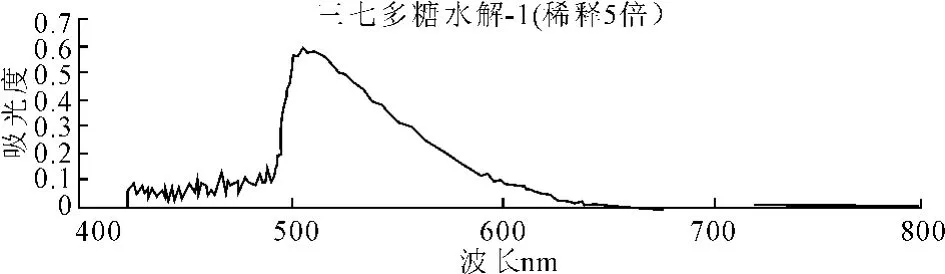
图2 三七供试品显色UV扫描
对比以上两个样品扫描图可知,二者的最大吸收峰一致,均在510nm处左右,因此选择510nm为检测波长。
2.4 方法学考察
2.4.1 标准曲线的绘制
精密称取干燥恒重D-无水葡萄糖对照品适量,加水溶解使成400.0mg/L,精密移取葡萄糖对照品溶液0、0.3、0.4、0.5、0.6、0.7、0.8mL,置具塞试管中,分别加水至2.0mL,加入1.5mL DNS试剂,摇匀,于沸水浴中加热5min,取出后迅速冷却,以第一份样品作空白,于510nm下测定其吸光度,每个样品浓度平行3份,以每3.5mL溶液中所含的葡萄糖质量(mg)为横坐标,以其平均吸光度值为纵坐标,绘制标准曲线,回归方程:Y=5.859X-0.355 9(r=0.999 2)。结果表明,D-无水葡萄糖溶液在0.117 6~0.313 6mg/3.5mL范围内与吸光度有良好的线性关系。
2.4.2 精密度试验
精密吸取对照品溶液0.5mL,按标准曲线制作方法测定吸光度,重复测定6次。平均吸收度为0.744,RSD为0.21%,结果表明精密度良好。
2.4.3 稳定性实验
精密称取三七样品5g,按“2.2”项下操作制备溶液,依法显色,显色后分别于0、5、10、15、20、25、30min测定其吸光度,平均吸收度为0.835,RSD为1.66%。结果表明样品溶液在30min内稳定。
2.4.4 重现性试验
取三七样品6份,按“2.2”项下操作制备溶液,依法测定,平均含量为9.30%,RSD为1.9%,结果表明重现性良好。
2.4.5 回收率试验
取已知含量的样品5份,每份取约2.5g,精密称定,每份样品分别加入精密称取的葡萄糖对照品0.1mg,按“2.2”项下方法制备供试品,按“2.4.1”项下方法操作,算得样品的平均加样回收率为98.87%,RSD为2.6%,表明本方法准确度良好。结果见表1。
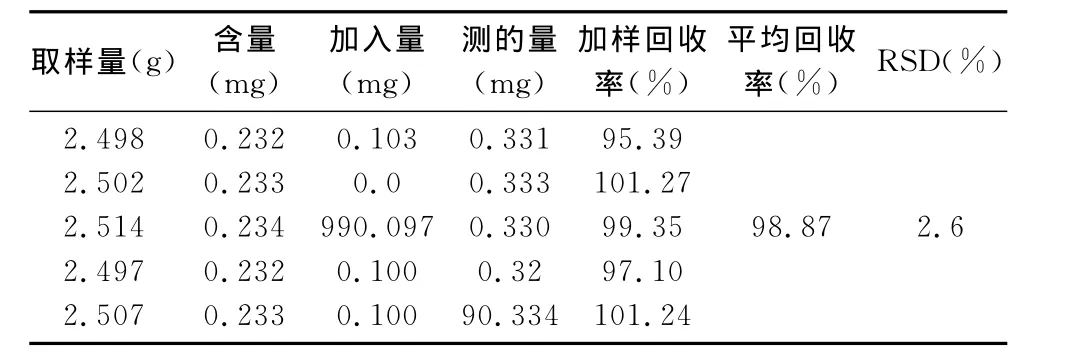
表1 回收率测定结果
2.5 三七供试品总多糖含量测定
精密移取不同等级的三七多糖水解液样品1.0mL(根据实验结果调整取样量),置具塞试管中,加水至2.0mL,加入1.5mLDNS试剂,摇匀,于沸水浴中加热5min,取出后迅速冷却,随行以2.0mL蒸馏水作空白,用紫外-可见分光光度计于510nm测定吸光度。按公式1计算,结果见表2。
多糖含量%=m/(m样品/250×V多糖/100×V水解液/50×1000)×0.9
其中,m样品为样品取样量,V多糖为水解时多糖取样体积,V水解液为显色时所取水解液体积;多糖水解成单糖时,每断裂一个糖苷键需加入一分子水,故在计算单糖含量时需乘以0.9校正。
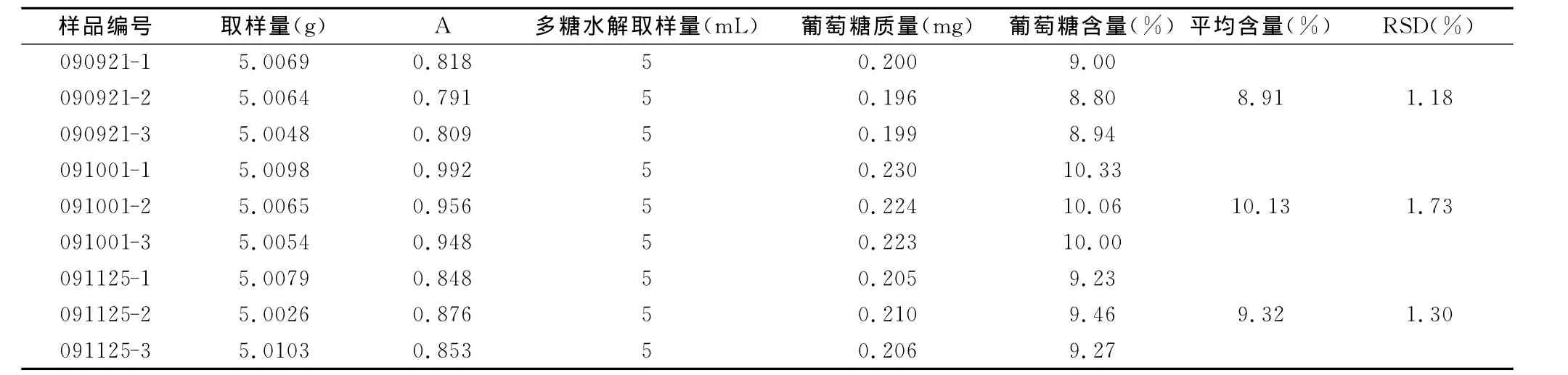
表2 三七样品多糖含量测定结果
3 讨论
多糖并不具有还原性,跟DNS无法反应,因此需要对总多糖溶液进行水解后再用DNS法显色测定其吸光度,此时测定的为三七中总糖含量;同时,水提醇沉法可以将三七中的还原糖沉淀出来,因此需先对三七多糖溶液用DNS显色后测定其吸光度,此时测定的为三七中还原糖含量;总糖含量减去还原糖含量即为三七中多糖含量。在试验中对未水解的多糖进行显色测定后发现其吸光度极低,对结果影响不大,因此本实验没有对其进行测定。多糖的含量测定方法有苯酚-硫酸法[5]、硫酸-蒽酮法[6]、3,5-二硝基水杨酸法等。本文采取了DNS法测定三七总多糖的含量,对不同批次三七中总多糖进行含量测定,以期为系统评价三七药材的质量控制提供资料。
[1]国家中医药管理局.中华本草[M].上海科学技术出版社,1999:839-849.
[2]GAO H,WANG F,LIEN EJ.Trousdale MD.Immuno stimulating polysaccharides from Panax notoginseng[J].Pharm Res,1996,13(8):1196.
[3]陈新霞,顾呈华,杨明晶,等.三七多糖对小鼠免疫功能调节的研究[J].江苏预防医学,2007,18(3):10-12.
[4]崔秀明,徐珞珊,王强,等.三七糖类成分的含量及其变化[J].现代中药研究与实践,2003,7(增刊):21-24.
[5]王红英.钱斯日古楞,赵前程,等.3,5一二硝基水杨酸比色法测定麦冬多糖含量[J].沈阳农业大学学报,2005,36(5):628-630.
[6]李小凤,程荷凤.广佛手中总多糖含量的分光光度法测定[J].中成药,2004,26(10):5-6.
[7]姜曼花,邱细敏,刘胜姿,等.白背三七多糖的提取纯化及含量测定[J].时珍国医国药,2008,19(9):2148-2149.

