金樱根多糖含量测定及提取工艺优选
郭巧玲,田素英
(1.广东省新兴中药学校,广东 新兴527400;2.广东药学院 中山校区,广东 中山528458)
金樱根为蔷薇科植物金樱子Rosa laevigata Michx.的干燥根、根皮,最早入药记载见于《日华子本草》,为临床常用中药,有清热解毒,凉血活血,祛瘀止痛,固精涩肠等功用,临床应用广泛,已被制成多种制剂,临床效果良好[1]。多糖类化合物是多种中草药的有效成分之一,具有多种生物活性。近年来研究显示高等植物中所含多糖具有提高和恢复机体免疫功能、抗心肌缺血、抗应激、抗肿瘤等[2]功用。本实验对金樱根多糖提取工艺与含量进行研究,为开发利用金樱根多糖,制定其质量标准提供科学依据。
1 主要仪器与材料
KQ-500型数控超声波清洗器(昆山市超声仪器有限公司);TE52CS旋转蒸发器(上海亚荣生化仪器厂);恒温水浴锅B-220(上海亚荣生化仪器厂);MV1102紫外可见分光光度计(上海天美科学仪器有限公司)。金樱根(批号:090210、090901、1006284,均经广东药学院房志坚副教授鉴定为蔷薇科植物金樱子Rosa laevigata Michx.的干燥根);(+)葡萄糖(AR,天津市津东天正精细化学试剂厂);其他试剂均为分析纯。
2 方法与结果
2.1 含量测定
(1)对照品溶液的制备。精密称取105℃恒温干燥至恒重的葡萄糖60mg,用蒸馏水溶解并定容至100mL。摇匀,静置。
(2)供试品溶液的制备。取金樱根粗粉2g,加石油醚—乙醇(1∶2)混合液150mL,置250mL锥形瓶中,超声20min,过滤,取药渣挥干后,置锥形瓶中,加0.5%氢氧化钠水溶液100mL,超声20min。加稀盐酸至提取液呈中性,置100℃水浴加热20min,过滤,滤液加纯水定容至100mL。
(3)最大波长测定。分别精密移取标准溶液和样品液各0.5mL,分别置20mL容量瓶加纯水定容。精密吸取各溶液2mL置具塞试管,分别加入4%苯酚水溶液1mL,摇匀后迅速加入浓硫酸7mL,摇匀,放入40℃温水水浴30min,取出,冷却10min,于400~520nm处波长扫描,读取吸光度值,确定吸收峰,得到最大波长为485.0nm(见表1)。

表1 样品最大波长紫外测定结果
(4)标准曲线制备[3]。精密移取对照品溶液0.2mL、0.4mL、0.6mL、0.8mL、1.0mL、1.2mL、1.4mL,分 别 置 于20mL容量瓶,加纯水定容。精密吸取各溶液2mL置具塞试管,按最大波长测定法于最大波长485nm处,以蒸馏水为空白,测定吸光度,以吸光度A为纵坐标,对照品溶液浓度C(mg/mL)为横坐标制作标准曲线。得标准曲线回归方程为Y=7.784 2X+0.000 9,r=0.999 3。结果表明,在溶液浓度为0~0.05mg/mL范围内测定葡萄糖吸光度呈良好线性。
(5)显色稳定性考察。精密移取对照品溶液和供试品溶液各0.8mL,分别置20mL容量瓶加纯水定容。以冷水水浴10min,开始为0min,每隔10min记录1次。RSD为1.58%(n=9),结果表明,在10~90min区间内显色稳定性良好(见图1)。
(6)精密度考察。精密移取对照品溶液0.2mL置于20mL容量瓶,加纯水定容,测定吸光度值。结果RSD%为0(n=5),结果表明该精度良好。
(7)多糖含量测定。按上述制备方法取三批次样品制成供试品溶液,分别精密移取各供试品溶液0.5mL,分别用纯水定容至20mL。按标准曲线中苯酚—硫酸显色法显色,并记录吸光度。代入标准曲线中计算总含糖量(124.593 8±2.150 6)mg。

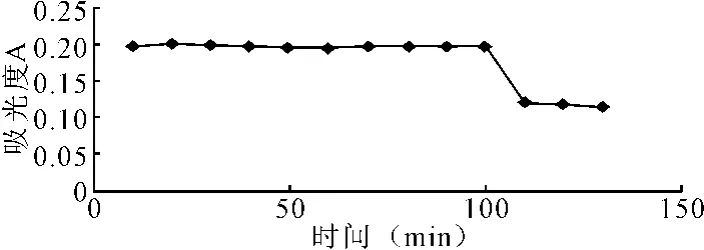
图1 显色稳定性考察结果
(8)加样回收试验。精密称取已知多糖含量的粗多糖溶液1mL 3份,依次加入不同量的葡萄糖标准贮备液,按上述操作方法测定供试品溶液的吸光度值,计算多糖回收率为94.70%,RSD为2.51%(n=6)。
2.2 提取工艺的优选
2.2.1 单因素考察(超声提取温度60℃,提取时间20min)
氢氧化钠溶液浓度选择:精密称量约1g/份的金樱根粗粉共5份,按上述方法制备溶液,分别以浓度为1%、1.5%、2.0%、2.5%、3%的氢氧化钠为提取液50mL超声提取,再用100℃水浴提取2h,过滤。吸取各滤液0.5mL,用纯水定容至20mL。测定含糖量。结果表明,氢氧化钠溶液浓度对金樱根多糖的提取结果有影响,且2.5%浓度的氢氧化钠提取结果较好。
料液比选择:精密称量约1g/份的金樱根粗粉共5份,按上述方法制备溶液,分别以料液比为1∶30、1∶40、1∶50、1∶60、1∶70,浓度为2.5%的氢氧化钠溶液为提取液进行超声提取,再用100℃水浴提取2h,过滤。吸取各滤液0.5mL,用纯水定容至20mL。测定含糖量。结果表明,随着料液比的提高糖的提取量也提高。
提取温度选择:精密称量约1g/份的金樱根粗粉共5份,按上述方法制备溶液,以2.5%氢氧化钠溶液50mL超声提取后,再分别60℃、70℃、80℃、90℃、100℃水浴提取2h,过滤。吸取各滤液0.5mL,用纯水定容至20mL。测定含糖量。结果表明,提取温度对多糖的提取结果有影响,且随着水浴温度的提高,糖含量也相应提高。可能是因为随着温度的提高,金樱多糖的溶解度不断升高,所以,提取温度越高,提取的多糖的量也就越多。由于水浴的最高温度为100℃,故正交实验考察最佳提取条件时不再考察温度,直接用100℃进行水平提取。
提取时间选择:精密称量约1g/份的金樱根粗粉共5份,按上述方法制备溶液,以2.5%氢氧化钠溶液50mL超声提取后,再分别0.5h,1h,1.5h,2.0h,2.5h,100℃水浴提取,过滤。吸取各滤液0.5mL,用纯水定容至20mL。测定含糖量。结果表明,2.5h糖含量较多,有可能是在水浴过程中多糖链断裂成单糖碎片,提高了多糖的溶解度。
2.2.2 正交试验
根据金樱根的提取性质考察了氢氧化钠浓度、料液比、提取温度和提取时间4个因素,并结合单因素试验结果,设置3因素3水平正交试验。根据因素水平表,以糖总含量为评价指标,采用L9(33)安排试验,结果见表2。
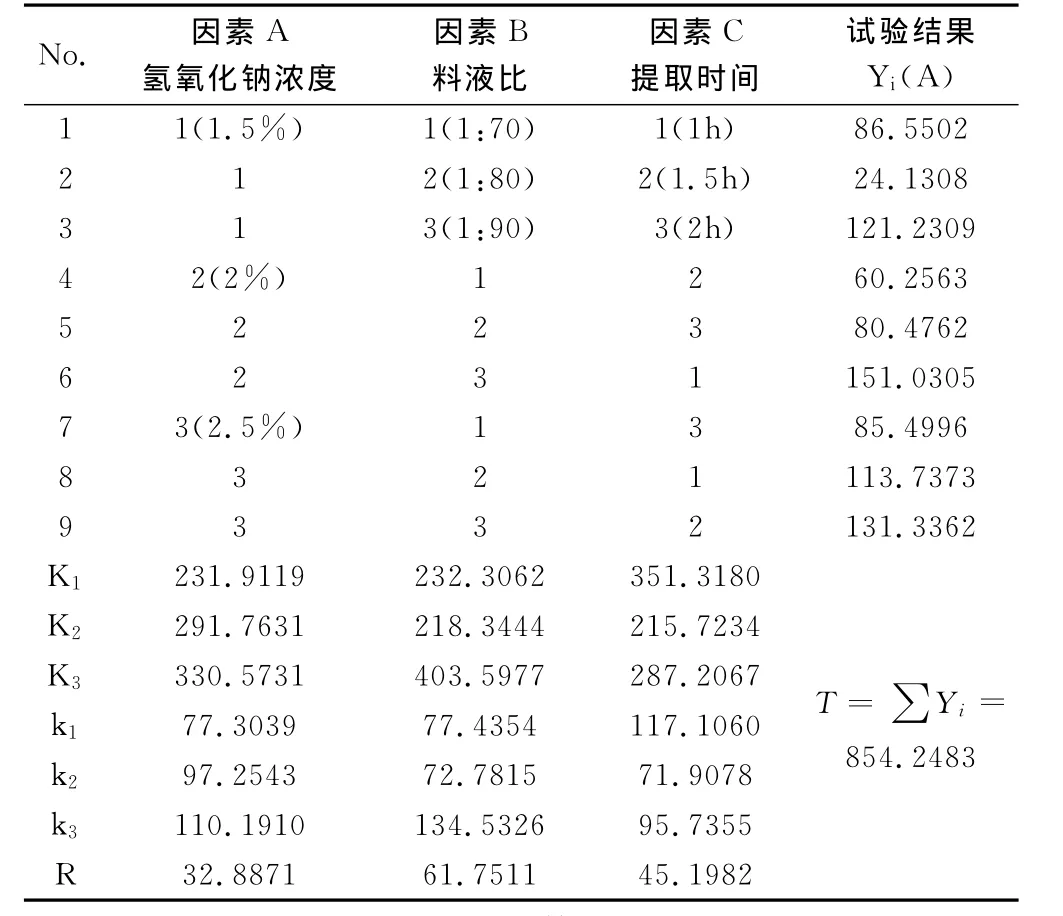
表2 正交试验优选因素水平与结果
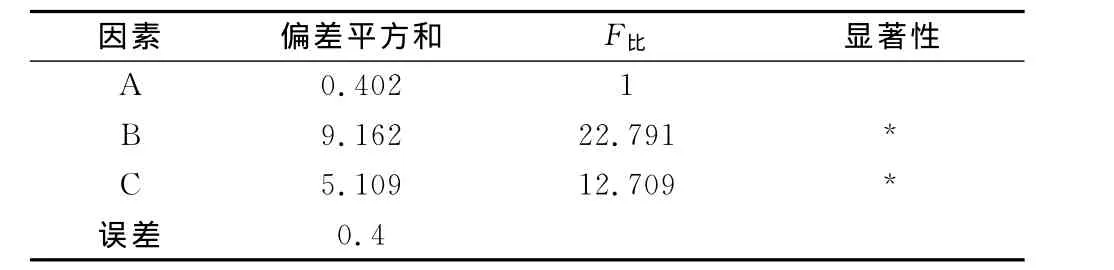
表3 方差分析
实验结果表明,对金樱根多糖含量结果的影响因素显著性顺序为:料液比>提取时间>氢氧化钠浓度。金樱根多糖的提取最优工艺为:料液比1∶90,提取时间1h,氢氧化钠浓度为2.5%。
3 讨论
(1)本实验同时采用单因素与正交试验法优选提取工艺,结果获得的最佳提取工艺条件为提取液氢氧化钠浓度为2.5%,料液比为1∶90,100℃水浴提取1h。单因素考察的结果表明,料液比、提取温度、提取液浓度和提取时间均对提取结果有影响,且在各因素所选的5个水平基础上,各因素对结果影响的显著性顺序为:料液比>提取温度>提取时间>氢氧化钠浓度。
(2)本实验采用超声提取和水浴提取相结合,实验结果表明采用此提取方法提取时间对提取结果影响较小,可在较短时间内提取完成。与传统的提取方法中20h以上的回流提取时间相比,大大缩短了提取时间。且超声提取和水浴提取较简便安全,为提取金樱多糖的较佳提取方法。
[1]黄泰康.现代本草纲目[M].上卷.北京:中国医药科技出版社,2001:61.
[2]吴梧桐,高美凤,吴文俊,等.多糖的抗肿瘤作用研究进展[J].中国天然药物,2003,1(3):15.
[3]任浩娜.中药北沙参多糖与单糖组成和含量测定方法研究[D].沈阳:沈阳药科大学,2008.

