SIRT1在NMDA诱导的兴奋性神经毒中的保护作用1)
秦花萍,司沛沛,杨小荣,张 策
谷氨酸是中枢神经系统重要的神经递质,介导各种兴奋性突触传递。在胚胎期神经发育、成年脑的各种兴奋性突触传递、突触的可塑性等方面发挥重要作用[1]。然而,谷氨酸在突触间隙的过度聚集可引起神经元损伤甚至死亡,被称为兴奋性神经毒。兴奋性神经毒参与多种神经病理过程,如脑缺血损伤和各种神经退行性疾病等。而兴奋性神经毒模型是最常用(被普遍公认)、最具毒性(既可引起坏死,也可引起凋亡)、损伤机制最复杂(涉及氧化应激、线粒体功能障碍、细胞坏死及凋亡等)、最具临床意义(兴奋性神经毒参与了几乎所有神经病理过程,如脑缺血损伤,各种神经退行性疾病等)的一个神经损伤模型[1,2]。
沉默信息调节因子1(silent information regulator 1,SIRT1)作为一种依赖于烟碱腺嘌呤二核苷酸(nicotine-amid adenine dinucleotide,NAD)的去乙酰化酶(histone deacetylase,HDAC),广泛存在于哺乳动物细胞质和细胞核中。SIRT1可以作用于组蛋白和非组蛋白使其去乙酰化,从而在多种生物活动过程中发挥重要作用,包括参与基因转录、物质代谢、胰岛素分泌、血管生成以及细胞衰老过程的调节[3-7]。近年研究发现,SIRT1具有明显的神经保护作用。但SIRT1在N-甲基-D-门冬氨酸(N-methyl-D-aspartate,NMDA)诱导的兴奋性神经毒中是否发挥保护作用尚不明确。因此本研究采用NMDA(100 μmol/L,2h)诱导的兴奋毒细胞模型,应用细胞计数试剂盒-8(CCK-8)分析,乳酸脱氢酶 (LDH)检测以及 Calcein-AM 和 PI双染等方法检测细胞损伤,同时使用SIRT1激活剂白藜芦醇(Resveratrol,RSV)和 SIRT1抑制剂 Sirtinol,观察 SIRT1在NMDA介导毒性过程中的作用。
1 材料与方法
1.1 试剂 Neurobasal,B27添加剂购自Gibco,细胞计数试剂盒-8购自Dojindo,LDH试剂盒购自南京建成生物工程研究所,SIRT1激活剂白藜芦醇(Resveratrol,RSV)和SIRT1抑制剂Sirtinol购自Sigma。1.2 方法
1.2.1 原代皮层神经元培养 取新生1d~3d的小鼠,常规手术,分离制成小鼠皮层单细胞悬液。细胞悬液经1 000g离心5 min,弃上清,用培养液重悬细胞,按5×104个/mL的浓度,在37℃、5%CO2的条件下进行培养。
1.2.2 NMDA毒性诱导 采用 NMDA(100μmol/L)和Gly(10μmol/L)与培养神经元共孵育2h,再进行后续的细胞活力检测。SIRT1激活剂白藜芦醇(Resveratrol,RSV)在NMDA诱导之前预孵育12h,SIRT1抑制剂Sirtinol在白藜芦醇孵育前2 h加入。
1.2.3 CCK-8法 将细胞培养在96孔培养板上,经NMDA进行毒性诱导后,继续培养24h,在每孔加入10μL的CCK-8,再继续培养2h,最后用酶标仪测定490nm吸光度值。
1.2.4 LDH检测 将细胞培养在6孔培养板上,经NMDA毒性诱导后,继续培养24h(即NMDA开始作用后的24h),收集培养液进行LDH活性的检测。
1.2.5 Calcein-AM和PI染色 将细胞培养在6孔培养板上,经NMDA毒性诱导后,继续培养24h(即NMDA开始作用后的24h),在盖玻片上滴加Calcein-AM和PI溶液,37℃下孵育20min,PBS洗涤两次。随后用共聚焦显微镜(Olympus,FV21000)在激发波490nm和发射波515nm条件下拍摄照片,并进行细胞计数。
2 结 果
2.1 RSV对NMDA引起的细胞活力下降的作用观察 预先应用SIRT1抑制剂Sirtinol(10μmol/L)与神经元预孵育2h,之后加入SIRT1激活剂RSV(25μmol/L)再孵育12h,采用CCK-8检测细胞活力。结果显示,RSV可有效抑制NMDA引起的细胞活力下降,使细胞活力恢复31.92%(P<0.05);Sirtinol可以有效阻断RSV使细胞活力恢复的作用。详见图1。

图1 RSV和Sirtinol对NMDA引起细胞活力下降的影响
2.2 RSV对NMDA引起的LDH释放的作用观察 在进行LDH的实验观察中发现,与对照组相比NMDA组的LDH水平增高了116.03%(P<0.05);RSV(25μmol/L)使 NMDA诱导释放的LDH减少27.34%(P<0.05);Sirtinol(10μmol/L)取消了RSV减少LDH释放的作用。MK-801完全阻断NMDA的作用。详见图2。

图2 RSV对NMDA引起的LDH释放的作用观察
2.3 RSV对NMDA引起的活细胞下降的作用观察 在利用Calcein-AM和PI免疫组织化学双染进行的活细胞标记的实验观察中发现,NMDA引起存活神经元的数量明显减少,约为对照组的53.37%(P<0.05);与 NMDA组相比,RSV(25μmol/L)使活细胞数目增加18.9%(P<0.05);同时 Sirtinol(10 μmol/L)抑制了RSV使活细胞数目增多的作用;此外 MK-801完全阻断NMDA的作用。详见图3。
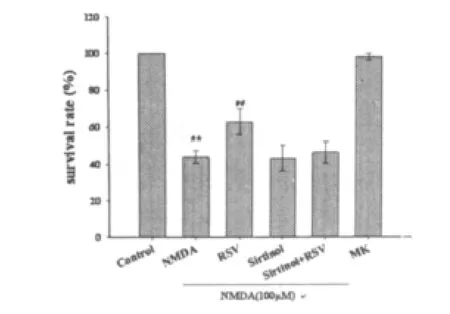
图3 RSV对NMDA引起的活细胞下降的作用观察
3 讨 论
谷氨酸作为中枢神经系统一种重要的神经递质,当过度激活突触后膜NMDA受体时,使胞外的Ca2+内流引起一系列Ca2+依赖的重要事件,如各种蛋白酶及蛋白激酶激活、过度产生的自由基,这些因素共同作用,使神经元的结构和功能受到破坏,直到细胞死亡,产生兴奋性神经毒效应[8]。
大约70多年前,人们就发现限制热量摄入可以延长大鼠寿命,后来在线虫、蠕虫、果蝇、芽殖酵母等物种中发现了同样的现象[9]。此后的研究证实,热量限制(calorie restriction,CR)延长酵母及啮齿动物寿命,推迟哺乳动物年龄相关的疾病如癌症、动脉粥样硬化及糖尿病的发生,是通过增加去乙酰化酶Sirtuin活性而起作用。存在于哺乳动物体内的这类酶被称作Sirtuins家族,是一种依赖于烟碱腺嘌呤二核苷酸的去乙酰化酶。其中SIRT1是SIRTUINS家族中研究最为深入的一个成员。现有的研究提示,CR延长哺乳动物寿命的机制至少部分通过激活SIRT1。由于SIRT1基因的高度保守和CR延长寿命的广泛性,推测在人类激活SIRT1可能也有延长寿命的作用。SIRT1可以作用于组蛋白和非组蛋白使其去乙酰化,从而在多种生物学过程中发挥重要作用,包括参与基因转录、物质代谢、胰岛素分泌、血管生成、神经保护以及细胞衰老过程的调节[3-7]。
在猴的阿尔茨海默病(Alzheimer’s disease,AD)动物模型中,高表达SIRT1能减少脑内的β淀粉样蛋白(amyloid-β,Aβ),且脑内Aβ含量与同一区域的SIRT1含量呈负相关[10]。体外研究表明,SIRT1对诸多底物如p53、FOXOs、Ku70、PGC-1α、TAFI68、P300、PCAF等均具有很强的去乙酰化作用。从这些去乙酰化底物的生理作用推测,SIRT1可能参与调控细胞凋亡、细胞周期、基因转录和物质代谢等过程[11]。相应的实验观察显示,SIRT1可通过使p53特异位点的赖氨酸残基发生去乙酰化作用从而负性调节其活性,使细胞免于凋亡,继续分裂生长[12];通过使FOXO3a以及其他forkhead家族成员发生去乙酰化作用抑制其转录调控作用,起到促存活抗凋亡的作用[13];通过对DNA修复蛋白Ku70的去乙酰化作用抑制Bax介导的细胞凋亡[14]。另外,SIRT1也能通过抑制NF-κB的活性,拮抗Aβ对神经元的损伤作用[15]。Okawara等[16]的研究表明,白藜芦醇可以减少由神经毒素(MPP+)诱导的多巴胺能神经元毒性作用,并且可能是通过激活SIRT1发挥的保护作用。在应用Wallerian慢性退化模型(Wlds)的研究发现,SIRT1对神经元的损伤亦有保护作用。当抑制SIRT1活性后,神经元损伤加剧,而用白黎芦醇激活SIRT1后,神经元的损伤明显减少[17]。此外,SIRT1还可能参与调节物质代谢,如SIRT1通过对PGC-1α的去乙酰化,激活肝脏糖异生抑制糖酵解[18];还能抑制过氧化物酶体增殖物激活受体(PPAR-γ),可以在热量摄入减少的情况下,促进脂肪动员[19,20]。上述结果提示,SIRT1可能通过调节多种转录调节因子的活性,一方面参与调节细胞在应激条件下的存活与死亡的平衡,另一方面参与代谢的调节。总之,作为一种进化上相对保守的蛋白,SIRT1发挥了一些最为基本而广泛的蛋白修饰功能,从而参与能量代谢调节过程,保持基因组的稳定性,因而使SIRT1具有广泛的细胞保护功能,同时具有延缓衰老及延长生命的作用。
本实验中利用NMDA诱导的兴奋性神经毒模型,观察SITR1在NMDA诱导的兴奋性神经毒中的保护作用。为观察SIRT1可能具有的神经保护作用,应用了SIRT1的激动剂RSV。RSV是含有芪类结构的非黄酮类多酚化合物。广泛存在于葡萄、松树、虎杖、决明子和花生等天然植物或果实当中,具有抗癌、抗氧化、调节血脂、影响寿命等多方面有益于人类健康的重要功能,因而引起学者的高度重视[21]。研究发现,白藜芦醇可以在多种生物体内模拟CR的作用,因此被认为是CR的模拟物。目前,在进行SIRT1的作用观察过程中,普遍使用RSV作为其激动剂。本实验结果显示,利用SIRT1激动剂RSV能够拮抗NMDA诱导的神经毒性作用,表现为细胞活力增加、LDH释放减少,同时利用Calcein-AM和PI染色观察到活细胞数明显增加。而SIRT1抑制剂Sirtinol能够阻断RSV对NMDA损伤的抑制效应(保护效应),说明RSV的保护作用是通过活化SIRT1而实现的。
本实验研究表明,在NMDA引起的神经毒过程,SIRT1的作用可能受到抑制,由此参与神经损伤;而激活SITR1可发挥神经保护作用。NMDA兴奋性神经毒参与多种神经病理过程,如脑缺血损伤和各种神经退行性疾病等[1,2]。
[1]Arundine M,Tymianski M.Molecular mechanisms of glutamatedependent neurodegeneration in ischemia and traumatic brain injury[J].Cell Mol Life Sci,2004,61(6):657-668.
[2]Palmer GC.Neuroprotection by NMDA receptor antagonists in a variety of neuropathologies[J].Curr Drug Targets,2001,2:241-271.
[3]Pillarisetti S.A review of SIRT1and SIRT1modulators in cardiovascular and metabolic diseases[J].Recent Patents on Cardiovascular Drug Discovery,2008,3:156-164.
[4]Haigis MC,Guarente LP.Mammalian sirtuins:Emerging roles in physiology,aging,and calorie restriction[J].Genes Dev,2006,20:2913-2921.
[5]Rodgers JT,etal.Nutrient control of glucose homeostasis through a complex of PGC-1αand SIRT1[J].Nature,2005,434:113-118.
[6]Yamamoto H,Schoonjans K,Auwerx J.Sirtuin functions in health and disease[J].Mol Endocrinol,2007,21:1745-1755.
[7]Bordone L,Guarente L.Calorie restriction,SIRT1and metabolism:Understanding longevity[J].Nature Rev Mol Cell Biol,2005,6:298-305.
[8]Hynd MR,Scott HL,Dodd PR.Glutamate-mediated excitotoxicity and neurodegeneration in Alzheimer’s disease[J].Neurochem Int,2004,45(5):583-595.
[9]Lin SJ,Kaeberlein M,Andalis AA,etal.Calorie restriction extends Saccharomyces cerevisiae lifespan by increasing respiration[J].Nature,2002,418(6895):344-348.
[10]Qin W,Chachich M,Lane M,etal.Calorie restriction attenuates Alzheimer’s disease type brain amyloidosis in Squirrel monkeys(Saimiri sciureus)[J].J Alzheimers Dis,2006,10(4):417-422.
[11]邓向群.SIRT1表达对大鼠胰岛β细胞凋亡及非酒精性脂肪肝病形成的影响[D].武汉:华中科技大学,2007.
[12]Vaziri H,Dessain SK,Ng Eaton E,etal.hSIR2(SIRT1)functions as an NAD-dependent p53deacetylase[J].Cell,2001,107(2):149-159.
[13]Motta MC,Divecha N,Lemieux M,etal.Mammalian SIRT1represses fork head transcription factors[J].Cell,2004,116(4):551-563.
[14]Cohen HY,Lavu S,Bitterman KJ,etal.Acetylation of the C terminus of Ku70by CBP and PCAF controls Bax-mediated apoptosis[J].Mol Cell,2004,13(5):627-638.
[15]Chen J,Zhou Y,Mueller-Steiner S,etal.SIRT1protects against microglia-dependent amyloid-beta toxicity through inhibiting NF-kappaB signaling[J].J Biol Chem,2005,280(48):40364-40374.
[16]Okawara M,Katsuki H,Kurimoto E,etal.Resveratrol protects dopaminergic neurons in midbrain slice culture from multiple insults[J].Biochem Pharmacol,2007,73(4):550-560.
[17]Araki T,Sasaki Y,Milbrandt J.Increased nuclear NAD biosynthesis and SIRT1activation prevent axonal degeneration[J].Science,2004,305(5686):1010-1013.
[18]Picar F,Kurtev M,Chung N,etal.Sirt1promotes fat mobilization in white adipocytes by repressing PPAR-gamma[J].Nature,2004,429(6993):771-776.
[19]Picard F,Guarente L.Molecular links between aging and adipose tissue[J].Int J Obes(Lond),2005,29(Suppl 1):S36-S39.
[20]Odgers JT,Lerin C,Haas W,etal.Nutrient control of glucose homeostasis through a complex of PGC-1alpha and SIRT1[J].Nature,2005,434(7029):113-118.
[21]Fu JT,Zhang R,Huang BK,etal.The development of the study on the function of resveratrol in natural plants[J].Res Pract Chin Med,2005,19(2):62-64.

