白黎芦醇对人表皮样癌细胞端粒酶活性及其增殖、凋亡的影响
翟晓翔 ,姜月华,严月华 ,唐志铭 ,李敬果 ,孙敬昌,张翠侠 ,陈向辉
(1.江苏省徐州市中医院,徐州 221003;2.山东中医药大学附属医院,济南 250011;3.武汉大学中南医院,武汉 430071;4.山东中医药大学基础医学院细胞生物学实验室,济南 250355)
白黎芦醇对人表皮样癌细胞端粒酶活性及其增殖、凋亡的影响
翟晓翔1,姜月华2,严月华3,唐志铭1,李敬果1,孙敬昌4,张翠侠1,陈向辉1
(1.江苏省徐州市中医院,徐州 221003;2.山东中医药大学附属医院,济南 250011;3.武汉大学中南医院,武汉 430071;4.山东中医药大学基础医学院细胞生物学实验室,济南 250355)
目的 观察白藜芦醇诱导人表皮样癌A431细胞的凋亡情况,并探讨其对端粒酶活性和hTERT基因蛋白表达的影响。方法 以不同浓度的白藜芦醇处理A431细胞,显微镜观察细胞的形态学改变;MTT法检测细胞增殖情况;采用TRAP-PCR-ELISA法测定A431细胞的端粒酶活性;蛋白质印迹法检测A431细胞hTERT蛋白水平。结果 在白藜芦醇诱导A431细胞凋亡的过程中对端粒酶活性有显著抑制作用,且随着其浓度增加而抑制作用越强;白藜芦醇能降低A431细胞hTERT蛋白的表达,且呈浓度依赖性。结论 白藜芦醇能下调hTERT蛋白表达,抑制A431细胞端粒酶活性,这可能是白藜芦醇抑制A431细胞增殖的重要机制之一。
白藜芦醇;A431细胞;细胞凋亡;增殖;端粒酶
白藜芦醇是一种含有芪类结构的非黄酮类多酚化合物,具有多种生物学活性及药理作用。近年来的研究发现它可诱导多种肿瘤细胞凋亡,抑制其增殖,因此具有抗肿瘤的作用。文献报道,白藜芦醇的抗肿瘤作用与其抑制端粒酶活性有关[1,2]。端粒酶是一种特异的染色体末端转移酶,研究发现,在许多恶性肿瘤细胞中均能检测到明显的端粒酶活性,而正常细胞中则检测不到。正常细胞向肿瘤细胞转变过程中大多伴随端粒酶的激活[3],端粒酶的活化是恶性肿瘤发生的关键环节之一,其中催化亚单位端粒酶逆转录酶(hTERT)与端粒酶的激活密切相关,二者呈正相关[4,5]。目前白藜芦醇诱导皮肤癌细胞凋亡及对其端粒酶活性的影响研究比较少见。为此,我们应用白藜芦醇对体外培养的人表皮样癌A431细胞进行干预,观察其对A431细胞增值、凋亡及端粒酶活性的影响,为白藜芦醇应用于临床治疗皮肤肿瘤提供理论依据。
1 材料与方法
1.1 材料
1.1.1 白藜芦醇 购自Alexis Biochemicals公司。
1.1.2 A431细胞株 武汉大学中国典型培养物保藏中心提供。
1.1.3 主要试剂 DMEM高糖培养基:美国Gibco公司;胎牛血清(FBS):杭州四季青生物工程材料有限公司;胰蛋白酶粉(Trypsin)、DMSO:均为 Amresco公司;TRAP-PCR-ELISA端粒酶活性检测试剂盒:Roche(德国宝灵曼公司)。
1.1.4 主要仪器 自动酶标记数仪:Elx808型,美国BioTek仪器有限公司;PCR扩增仪:ABI Veriti 96孔型梯度PCR扩增仪,美国基因有限公司。
1.2 方法
1.2.1 细胞培养 将A431细胞以1×107mL接种于含10%FBS的DMEM培养液中,置于37℃、5%CO2、饱和湿度的培养箱中培养。每3d换液1次,倒置显微镜下观察细胞形态,待细胞长满时用0.25%胰蛋白酶消化并传代培养。取对数生长期的细胞用于实验。
1.2.2 分组与给药 取第4代对数生长期的A431细胞,用0.25%胰蛋白酶消化,倒置显微镜下计数,以2×104/mL浓度接种至96孔细胞培养板,经24h无血清培养基预处理后,随机分为4组:空白对照组(A组)和3个药物浓度组,即B组(浓度0.1mg/mL)、C 组 (浓 度 0.2mg/mL)、D 组 (浓 度0.3mg/mL),每组8个复孔。
1.2.3 细胞形态学观察 按前述分组加药培养24h后,细胞在96孔板上用4%多聚甲醛室温(RT)固定30min,蒸馏水洗净甲醛,HE染色,光学显微镜下观察A431细胞的形态学变化。
1.2.4 MTT法检测不同浓度白藜芦醇干预下的A431细胞增生状况 将白藜芦醇用DMSO溶解为所需浓度,分别加入上述3个药物浓度组,每孔20μL,空白对照组每孔加入1%DMSO/DMEM20μL。药物干预24h,每孔加入5mg/mLMTT(用Ph7.4PBS配制)20μL,37℃继续培养4h后,小心吸弃上清,每孔加入150μL DMSO,振荡l0min,使甲臜结晶颗粒溶解为均匀的蓝紫色,以空白孔调零,在酶标仪波长490nm处测定各孔吸光度(A)值。
1.2.5 白藜芦醇对A431细胞端粒酶活性的影响 将白藜芦醇用DMSO溶解为所需浓度,分别加入上述3个药物浓度组,每孔20μL,空白对照组每孔加入1%DMSO/DMEM20μL。37℃继续培养24h后,按照标准方法收集细胞,每个反应取2×105细胞移入一个新的EP管中,按TRAP-PCR-ELISA端粒酶活性检测试剂盒说明书进行操作,最后用酶标仪测量在690nm参考波长的450nm波长吸光度(A)值,根据A=A450nm-A690nm计算,A值代表端粒酶活性。
1.2.6 白藜芦醇对A431细胞hTERT蛋白水平的影响 采用Western blot法(蛋白质印迹法)检测。按前述分组与给药,37℃继续培养24h后收集细胞,用预冷的磷酸盐缓冲液洗2次,加入细胞裂解液,在冰面上静置10~20 min,用细胞刮匀浆后,4℃,离心 10min,转速 15 000 r/min,取上清,加入1/3体积的4×上样缓冲液,煮沸10 min使蛋白变性。样品蛋白经凝胶电泳分离、电转移至硝酸纤维素膜,室温封闭1 h后加入hTERT单克隆抗体(1:500),4℃孵育过夜。漂洗后加入辣根过氧化物酶标记的羊抗兔IgG(1:500),37%孵育1 h,漂洗后用ECL显色,曝光,冲洗胶片。将hTERT蛋白条带与内对照β-actin蛋白条带的密度灰度值的比值作为蛋白的表达相对水平。
2 结果
2.1 白藜芦醇诱导对A431细胞凋亡的形态学变化 白藜芦醇(B、C、D)作用A431细胞24h后,相差显微镜下可见不同程度的凋亡特征,表现为细胞贴壁不好,细胞形态不规整,胞质浓缩,胞质中颗粒明显增多,细胞核固缩,有的出现核碎裂,可见凋亡小体,部分细胞漂浮于培养液中。这种作用随白藜芦醇浓度的增加而增强;而对照组(A)细胞贴壁牢,生长良好,细胞形态正常,细胞质中颗粒很少,未见凋亡小体。见图1。
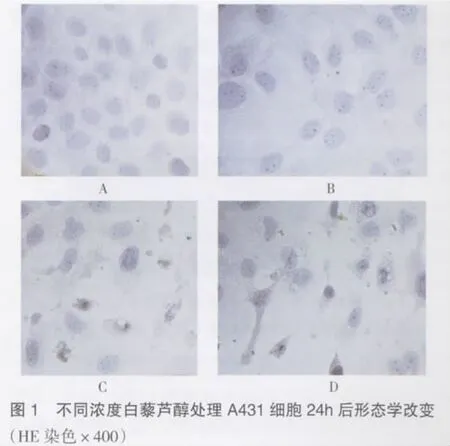
2.2 白藜芦醇对A431细胞增殖的影响 以不同浓度的白藜芦醇处理A431细胞后,采用MIT法检测其增殖情况,结果显示,各不同药物浓度组与空白对照组相比,A值均明显偏低,有显著性差异(P<0.01),说明白藜芦醇对A431细胞的增殖有显著抑制作用,并且这种抑制作用有剂量依赖性,见表1。
表1 不同浓度白藜芦醇对A431细胞增殖的影响(±s,n=6)

表1 不同浓度白藜芦醇对A431细胞增殖的影响(±s,n=6)
注:与空白对照组比较;**P<0.01。
组别A组B组C组D组浓度-0.1mg/mL 0.2mg/mL 0.3mg/mL A值0.485±0.050 0.228±0.018*0.177±0.016*0.155±0.008*
2.3 白藜芦醇对A431细胞端粒酶活性的影响 见表2。白藜芦醇作用24h,A431细胞的端粒酶活性与未加药的对照组相比受到显著抑制(P<0.01),且随药物浓度增加,抑制作用增强。
表2 不同浓度白藜芦醇对A431细胞端粒酶活性的影响(±s,n=6)

表2 不同浓度白藜芦醇对A431细胞端粒酶活性的影响(±s,n=6)
注:与空白对照组比较,*P<0.05;**P<0.01。
组别A组B组C组D组浓度-0.1mg/mL 0.2mg/mL 0.3mg/mL端粒酶活性0.719±0.064 0.623±0.068*0.608±0.057**0.506±0.043**
2.4 白藜芦醇对A431细胞hTERT蛋白水平的影响 以不同浓度的白藜芦醇处理A431细胞24h后,通过蛋白质印迹法检测发现,hTERT蛋白水平明显降低。由Matlab图像软件分析了空白对照组和白藜芦醇组相对灰度值,0.1mg/mL、0.2mg/mL、0.3mg/mL 3个浓度组的灰度值均低于空白对照组,差异具有统计学意义(P<0.05),见图2。

3 讨论
皮肤癌为表皮角质形成细胞的恶性增生,主要包括鳞状细胞癌和基底细胞癌[6]。近年来皮肤癌的发病率呈明显上升趋势,这可能与环境污染等因素造成臭氧层被破坏,到达地球的紫外线增多,从而人被动接受其照射的强度增高有关[7]。目前皮肤癌的具体发病机制仍不十分清楚,临床治疗皮肤癌的方法也有限,寻找一种新的有效的防治皮肤癌的天然药物就成为当前亟待解决的课题之一。近年来随着对白藜芦醇研究的深入,发现它对多种肿瘤细胞有拮抗作用,如肝癌、胃癌、白血病、食管癌、乳腺癌、宫颈癌等[8],其机制可能与端粒酶活性改变有关[9]。但白藜芦醇是否也对皮肤癌细胞的增值、凋亡及端粒酶活性产生影响,目前国内外尚无这方面的研究报道,因此,我们通过本项研究对此进行了一些探索,为白藜芦醇临床治疗皮肤癌提供理论依据。
端粒是一种封闭真核染色体末端的脱氧核糖核酸,对染色体起保护作用。端粒酶是一种特异的染色体末端转移酶,其主要功能是以自身的RNA为模板,催化合成染色体末端的端粒重复序列,弥补因细胞分裂而致的端粒DNA的丢失,使细胞无限增殖,它的表达水平与恶性肿瘤的发生、发展和预后密切相关。在绝大多数肿瘤细胞中端粒酶活性异常表达,而在正常人体细胞中检测不到端粒酶活性。端粒酶活化是恶性肿瘤发生的关键环节之一,它的活性可以通过调控端粒酶的RNA成分或 (和)蛋白质成分来实现,其中催化亚单位hTERT作用最为重要[10]。
本项研究通过白藜芦醇干预A431细胞后,在形态学上可见典型的凋亡特征。MTT法检测结果显示,不同浓度白藜芦醇干预后,A431细胞的增殖都受到一定程度的抑制,其抑制作用随着白藜芦醇浓度增加而增强,表明这种抑制作用有一定的剂量依赖。端粒酶活性检测实验结果表明,白藜芦醇能抑制A431细胞端粒酶活性,且与浓度呈依赖关系。以不同浓度的白藜芦醇处理A431细胞24h后,通过蛋白质印迹法检测发现,hTERT蛋白水平明显降低。
实验结果表明,白藜芦醇能够抑制人表皮样癌细胞A431的增值,诱导其凋亡,其机制可能与抑制hTERT mRNA的转录降低其蛋白的表达,从而降低端粒酶的活性有关。
[1] Pearce VP,Sherrell J,Lou Z,et al.Immortalization of epithelial progenitor cells mediated by resveratrol[J].Oncogene,2008,27:2365-2374.
[2]Fuggetta MP,Lanzilli G,Tricarico M,et al.Effect of resveratrol on proliferation and telomerase activity of human colon cancer cells in vitro[J].J Exp Clin Cancer Res,2006,25:189-193.
[3]Boukamp P,Popp S,Krunic D.Telomere-dependent chromosomal instability[J].J InvestigDermatol Symp Proc,2005,10:89-94.
[4]Cairney CJ,Keith WN.Telomerase redefined:integrated regulation of hTR and hTERT for telomere maintenance and telomerase activity[J].Biochimie,2008,90:l3-23.
[5]KyoS,Takakura M,Fujiwara T,et al.Understanding and exploiting hTERT promoter regulation for diagnosis and treatment of human cancers[J].Cancer Sci,2008,99:1528-1538.
[6]王平,毕志刚.UVB诱发皮肤癌的分子机制研究进展[J].国外医学皮肤性病学分册,2005,31(1):44-46.
[7]李立,白雪涛.紫外线辐射对人类皮肤健康的影响[J].国外医学卫生学分册,2008,35(4):198-201.
[8]熊小春,安舂妹.白藜芦醇抗肿瘤的研究进展[J].黑龙江医药,2010,23(1):59-61.
[9]LanzilliG,FuggettaMP,TricaricoM,et al.Resveratrol down-regulates the growth and telomerase activity of breast cancer cells in vitro[J].Int J Oncol,2006,28:641-648.
[10]Fujiwara T,Tanaka N.Telomerase-specific oncolytic virotherapyfor human cancer with the hTERTpromoter[J].Uirusu,2008,58:11-18.
EffectsofResveratrolontheProliferation,ApoptosisandtheTelomeraseActivityofHumanEpidermoidCarcinomaCell
ZHAI Xiao-xiang1,JIANG Yue-hua2,YAN Yue-hua3,TANG Zhi-ming1,LI Jing-guo1,SUN Jing-chang4,ZHANG Cui-xia1,CHEN Xiang-hui1
1.Chinese Medicine Hospital of Xuzhou City,Xuzhou221003,China;2.Affiliated Hospital of Shandong University of Traditional Chinese Medicine,Ji’nan250011,China;3.Zhongnan Hospital of Wuhan University,Wuhan430071,China;4.School of Basic Medicine Cell Biology Laboratory of Shandong University of Traditional Chinese Medicine,Ji’nan250355,China
ObjectiveTo investigate the effect of resveratrol on cell apoptosis,ability of telomerase and the hTERT protein expression of human epidermoid carcinoma cell A431.MethodsA431 cells were treated with different concentration of resveratrol.And then the cell appearance was observed by microphone;the cell proliferation was examined by MTT assay;and the ability of telomerase were detected by TRAP-PCR-ELISA.ResultsResveratrol could significantly inhibited the activity of telomerase in concentration-dependent manner,and also decreased the expression of hTERT protein in concentrationdependent manner.ConclusionResveratrol can down-regulate the expression of hTERT protein,and also inhibit the activity of telomerase of A431.It may be one of the important mechanisms that resveratrol could inhibit the proliferation of A431 cell.
resveratrol;A431 cell;cell apoptosis;proliferation;telomerase
R285,R739.5
A
1672-0709(2011)05-0276-04
徐州市科技计划项目(XM08C048)
姜月华,E-mail:jiang_yuehua@hotmail.com
2011-08-16)

