Aβ寡聚体预处理的BV2细胞对PC12细胞凋亡的影响
蔺慕会, 徐忠信, 陈晓虹
β淀粉样蛋白(amyloid protein,Aβ)导致的tau蛋白异常磷酸化、神经原纤维缠结、神经元凋亡被认为是导致阿尔茨海默病(Alzheimer disease,AD)的主要原因[1]。有研究认为小胶质细胞可在AD的发生发展中清除Aβ,起到保护神经元的作用,但也有研究认为小胶质细胞可通过炎症反应加重神经元损伤。本研究将预先被Aβ寡聚体处理的BV2细胞与PC12通过筛网共育,部分模拟体内小胶质细胞与神经元关系,来探讨小胶质细胞对神经元损伤的作用。
1 材料与方法
1.1 材料 PC12细胞购于中国科学院北京细胞生物研究所,BV2细胞购于上海复祥生物科技有限公司。细胞转移筛网购于美国BD Falcon公司;1640培养基、DMEM培养基、胎牛血清购于GIBCO公司;Aβ1-42,HFIP(六氟丙醇),抗 tau,tau(pS396)一抗、二抗购于sigma公司;BCA蛋白定量试剂盒购于美国PIERCE公司;Western blot化学发光检测试剂盒购于武汉博士德公司;MTT(噻唑蓝)购于上海华舜生物工程有限公司;双染凋亡试剂盒购于上海宝赛公司。
1.2 方法
1.2.1 Aβ 寡聚体的制备及细胞培养 按Klein WL(2002)方法制备 Aβ1 ~42 寡聚体[2],用1640培养液(含10%胎牛血清,100u/ml青霉素,100g/L链霉素)将PC12细胞培养在24孔培养板中。用DMEM培养液(含10%胎牛血清)将BV2细胞培养在转移筛网上。在BV2细胞经Aβ1-42处理24h后,将培养液及生长有BV2细胞的转移筛网同时移入PC12细胞培养板与PC12细胞共育。
1.2.2 分组 在PC12细胞培养液中分别加入0、1、5、10μmol/L Aβ1-42 处理24h 作为对照组即Aβ+PC12;实验组则在BV2细胞培养液中加入0、1、5、10μmol/L Aβ1-42 预处理24h,然后通过转移筛网将Aβ1-42处理过的BV2细胞及培养液移入未处理过的PC12细胞培养孔共育24h,即Aβ+BV2+PC12。
1.2.3 MTT方法检测 PC12细胞抑制率 弃去 PC12 上清,加入 MTT(0.5mg/ml),37℃孵育 4h,细胞内见到蓝色沉淀后,吸出培养上清液,每孔加入200μl DMSO,使结晶物充分溶解,空白孔调零,经全自动酶标仪于490nm处测定各孔数值(655nm作为参考波长)。细胞抑制率计算:1-(OD实验组/OD对照组)×100%。
1.2.4 流式细胞仪检测细胞凋亡 收集细胞,PBS洗3遍,1000r/min离心10min,细胞沉淀中加入70%乙醇2ml,-20℃固定过夜,1000r/min离心10min,细胞沉淀中加入PI染色液1ml,流式细胞仪检测,用Cell Quest3.0软件分析。
1.2.5 Western blot方法检测 tau、tau(pS396)蛋白表达 将蛋白裂解缓冲液(预冷至0℃)加入经过漂洗的单层PC12细胞中,静置20min;收集细胞,用蛋白定量分析(bicinchonic acid assay BCA法)测定总蛋白浓度。加样蛋白含量50μg,经10%SDSPAGE电泳分离,4℃条件下转膜,置膜于5%脱脂奶粉封闭1h,在室温下分别加入兔抗大鼠 tau(pS396);tau一抗(1∶1000),4℃ 过夜,室温下加入辣根过氧化物酶标记的二抗(1∶4000),60min。化学发光显色,计算机扫描分析。
1.2.6 统计学处理 实验数据以 χ±SD表示,采用统计程序软件SPSS10.0 for windows,采用t检验。
2 结果
2.1 MTT法检测PC12细胞抑制率 除空白对照外(0μmol/L Aβ1-42),所有浓度的 ADDLs均可导致PC12细胞抑制,且PC12细胞抑制表现为ADDL浓度依赖性关系,即随着Aβ浓度增加PC12抑制率也明显增加,10μmol/L组最明显,与空白对照组相比,差异有统计学意义(P<0.05);其中实验组PC12细胞抑制率增加更明显,10μmol/L组最明显,并且与对照组中相同浓度组比较,PC12细胞抑制率增加更明显,其差异有统计学意义(P<0.05),见表1。

表1 MTT检测PC12细胞抑制率酶标仪检测结果(OD值)
2.2 流式细胞仪分析PC12细胞凋亡率结果对照组与实验组中空白对照组均为少量PC12细胞凋亡,两组相比无统计学意义;当Aβ浓度为1、5、10μmol/L时,对照组与实验组中均可见PC12细胞凋亡增多(P<0.05),并呈浓度依赖性升高;Aβ浓度相同时两组比较,实验组PC12细胞凋亡进一步增多,其差异有统计学意义(P<0.05)(见图1、图2)。
2.3 PC12细胞tau(pS396)、tau蛋白表达情况各组PC12细胞tau蛋白表达无明显差别,对照组中 Aβ(1、5、10μmol/L)组 tau(pS396)表达增多,差异有统计学意义(P <0.05);实验组 Aβ(1、5、10μmol/L)组中PC12细胞tau(pS396)表达明显增多,差异有统计学意义(P<0.05);实验组与对照组相同Aβ浓度组相比PC12细胞tau(pS396)表达增加,差异有统计学意义(P<0.05),见图3。
3 讨论
目前认为AD是一种由于基因缺陷直接或间接改变淀粉样蛋白前体(APP)表达或蛋白酶解过程从而影响Aβ聚集稳定性的病理综合征。Aβ导致的tau蛋白异常磷酸化,神经递质丢失,神经胶质增生和炎症反应等,最终可导致神经元功能失调,死亡。小胶质细胞作为脑内重要的免疫细胞之一,参与多种疾病的发生、发展,包括 AD[3~5]。但小胶质细胞在AD发生发展中的作用是清除Aβ保护神经元,还是通过炎症反应加重神经元损伤尚有争议。本研究通过PC12细胞抑制率、细胞凋亡检测及Tau蛋白表达变化的分析,观察了BV2细胞被Aβ寡聚体处理后对PC12细胞凋亡的影响,进而探讨了小胶质细胞在神经元损伤中的作用。

图1 Aβ(5μmol/L)对照组PC12细胞凋亡

图2 Aβ(5μmol/L)实验组PC12细胞凋亡
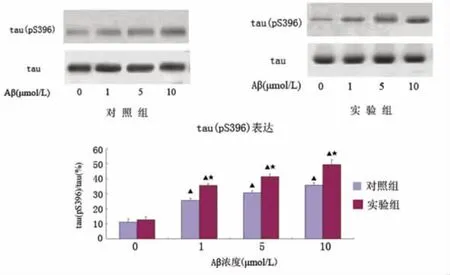
图3 PC12细胞tau(pS396)、tau蛋白表达
有研究发现来源于AD患者脑内的小胶质细胞对培养皿底部预先聚集的Aβ沉积物有明显趋向性,3w内Aβ沉积物被小胶质细胞覆盖。在动物实验及尸检也证实AD患者及动物模型中小胶质细胞能聚集于老年斑周围并内吞Aβ。有学者发现装载Aβ的小胶质细胞迁移到血管或脑室旁试图清除脑内Aβ。即小胶质细胞对Aβ具有趋化作用和吞噬性。关于小胶质细胞是吞噬、清除Aβ阻止AD发展,还是在Aβ作用下分泌细胞毒性物质加速AD发展,目前仍存在争议。
本研究选择与神经元有很多相似之处的PC12细胞及已被广泛用来体外培养、代替小胶质细胞的BV2细胞[6]通过细胞筛网共同培养,进而观察被Aβ寡聚体预处理的BV2细胞对PC12细胞凋亡的影响。PC12细胞来自鼠肾上腺嗜铬细胞瘤细胞系,BV2细胞来源于鼠小胶质细胞瘤细胞。筛网孔径8μm,允许筛网内外的大分子蛋白和液体交流及细胞突触通过,不允许细胞通过。该模型可分别对PC12细胞及BV2细胞的形态、蛋白质、RNA等进行检测,是较理想的模型。结果表明,所有浓度的ADDLs均可导致PC12细胞凋亡,且PC12细胞凋亡表现为ADDL浓度依赖性关系,即随着Aβ浓度增加PC12抑制率、细胞凋亡、tau(pS396)表达也明显增加,其中用Aβ寡聚体预处理BV2细胞24h后再与PC12细胞共育,与Aβ寡聚体直接处理的PC12细胞组相比,前者PC12细胞上述指标增加更明显,对照组与实验组中空白对照组未见明显的PC12细胞凋亡。提示BV2细胞能放大β淀粉样蛋白对PC12细胞的损伤,加速tau蛋白异常磷酸化,增加神经元凋亡,但“静止状态”下的小胶质细胞(Aβ寡聚体0μmol/)无神经元损伤作用。支持在病理状态下小胶质细胞在神经元损伤中起促进作用,因此可能加重AD的病情。但本研究应用的PC12细胞及BV2细胞不是原代培养的神经元及小胶质细胞,并且仅此二细胞共育,并不能完全模仿体内复杂的内环境如血液、脑脊液、其他细胞成分的影响等,因此有一定的局限性。本研究结果提示,小胶质细胞在一定条件下可促进神经元损伤。因此,进一步探讨小胶质细胞在神经元损伤中的作用机制,对于揭示AD发病机制以及为AD的临床治疗提供理论依据将具有重要的意义。
[1] Lambert JC,Amouyel P.Genetics of Alzheimer’s disease:new evidences for an old hypothesis[J]?Curr Opin Genet Dev,2011,21(3):295-301.
[2] Del Zoppo GJ,Milner R,Mabuchi T,et al.Microglial activation and matrix protease generation during focal cerebral ischemia[J].Stroke,2007,38(2 Suppl):646 -651.
[3] Jander S,Schroeter M,Saleh A.Imaging inflammation in acute brain ischemia[J].Stroke,2007,38(2):642 - 645.
[4] Lefterov I,Bookout A,Wang Z,et al.Expression profiling in APP23 mouse brain:inhibition of Abeta amyloidosis and inflammation in response to LXR agonist treatment[J].Mol Neurodegener,2007,2:20.
[5] Klein WL.Abeta toxicity in Alzheimer’s disease:globular oligomers(ADDLs)as new vaccine and drug targets[J].Neurochem Int,2002,41(5):345-352.
[6] Shafer LL,McNulty JA,Young MR.Brain activation of monocyte lineage cells:brain-derived soluble factors differentially regulate BV2 microglia and peripheral macrophage immune functions[J].Neuroimmunomodulation,2002,10(5):283 -294.

