Lactuside B对缺血性脑损伤大鼠海马和纹状体NT-3 mRNA表达的影响
李平法, 李生莹, 闫福林, 牛秉轩, 詹合琴
神经营养因子3(Neurotrophin-3,NT-3)是神经生长因子家族成员之一,其对感觉神经元、运动神经元和交感神经元的存活与功能有着十分重要的意义[1~3]。它能使受损的神经元长出侧芽,促进神经损伤的修复,应用NT-3可使3/4的脊髓萎缩细胞发生逆转,使细胞的存活数量明显增加[4]。
近期,国内外学者研究发现NT-3与缺血性脑损伤关系密切,Zhang等将改良表达NT-3的神经干细胞移植到严重局部脑缺血的大鼠体内,结果显示存活的移植干细胞分泌高水平的 NT-3[5],Benoit等人研究发现在脑缺血再灌注损伤期间,具有完整结构的补体C1q可以诱导神经元基因的表达,使NGF和NT-3表达增加,从而促进缺血后神经功能的恢复[6]。
本实验小组前期研究发现高翅果菊提取物Lac-tuside B(LB)具有较好的抗脑缺血作用[7],但其作用机制不明。本研究拟从该单体化合物对大鼠缺血性脑损伤海马和纹状体NT-3表达的影响入手,拟阐明Lactuside B抗缺血性脑损伤的部分作用机制。
1 材料与方法
1.1 主要试剂、药品及仪器 loading buffer和RT-PCR试剂盒(宝生物工程大连有限公司),DEPC液、溴化乙锭(美国Sigma公司),琼脂糖(西班牙Biowest公司),50×TAE缓冲液(广州威佳科技有限公司),D2000DNA分子量标记物(北京天根生化有限公司)和 Trizol(美国 Invertrogen公司),无水乙醇、异丙醇和氯仿(天津市德恩化学试剂有限公司);AG PCR扩增仪(德国Eppendorf公司),DYY-7C型水平电泳仪(北京市六一仪器厂),UV-2102PC紫外分光光度计(尤尼柯上海仪器有限公司),TGL-16G-A台式高速低温离心机(上海安亭科学仪器厂),MDF-U4086S超低温冰箱(日本 SANYO公司),TOCAN240凝胶成像系统(上海领成生物科技有限公司);尼莫地平注射液(山东方明药业股份有限公司),水合氯醛粉剂(天津市瑞金特化学品有限公司);LB(由新乡医学院药学院药化教研室闫福林教授提供,为白色粉末状,纯度>98%)。
1.2 实验动物、分组与给药 动物采用健康清洁Ⅱ级雄性SD大鼠,体重280~320g,购自河南省实验动物中心,动物合格证号:SYXK(豫)2005-0012。动物随机被分为:假手术组、模型组、阳性药物对照组、LB低剂量组(12.5mg/kg)、中剂量组(25mg/kg)和高剂量组(50mg/kg),共6组,8只/组。所有动物于再灌后每天给药1次,均按5ml/kg腹腔注射给药。假手术组、模型组分别给予等体积的蒸馏水,阳性对照组给予尼莫地平(1mg/kg),LB低、中、高剂量组分别给予相应剂量的实验药物。各组动物于再灌注24h和72h后分别处死4只,进行RT-PCR实验。实验过程对动物的处理符合中华人民共和国科学技术部2006年颁布的《关于善待实验动物的指导性意见》。
1.3 大鼠大脑中动脉阻塞线的制备 1.5号日本渔线(DaDong Yang制造),直径 0.2mm,剪成5cm的数小段,将其末端靠近火焰烧圆,在长2.0cm处做标记,放入肝素钠溶液中浸泡备用。
1.4 大鼠缺血性脑损伤模型的制备及模型成功判定指标 大鼠大脑中动脉缺血再灌注损伤模型的制备参照Longa[8]线栓法和本组实验方法制备大鼠大脑中动脉缺血再灌注损伤模型(动物麻醉采用10%的水合氯醛),将预先制备好的阻塞线插入颈内动脉(intemal carotid artery,ICA),插入长度为2.0cm,假手术组阻塞线插入ICA长度为0.5cm,将动物伤口处缝合后回笼饲养。所有动物均阻塞2h后再把阻塞线球端拉回颈外动脉进行再灌注,动物在手术清醒后和处死前根据Zea-longa评分法[8]进行神经缺损症状评分。
1.5 RT-PCR方法检测NT-3基因的转录水平取所需实验大鼠断头取脑,快速分离出双侧海马和纹状体(取壳核和尾状核的全部条纹状组织)在液氮中磨碎,Trizol抽提总RNA,检测其纯度和浓度保证所提的RNA无降解和污染。用TaKaRa pime-Script TM RT-PCR试剂盒合成cDNA模板,以β-actin基因作为内参基因。PCR反应溶液为50μl,上下游引物(见表1)各0.5μl(100μmol/L)。PCR 反应条件为:95℃ 5min;95℃ 30s、50℃ 30s、72℃ 1min,30个循环;72℃ 10min。PCR产物在2%琼脂糖凝胶进行电泳,凝胶成像分析仪拍照记录后用Quantity One图像分析软件测定各条带灰度,以扩增的特异性目的片段灰度值与同时扩增的内参β-actin片段灰度值的比值作为特异性扩增目的片段的半定量检测值,每组每只实验重复3次,求其平均值。
2 结果
2.1 大脑中动脉缺血再灌注模型成功的判定和LB对大鼠神经行为学评分的影响 手术动物麻醉清醒后,假手术组大鼠活动正常,无神经功能缺损症状。模型组大鼠则出现不同程度的神经缺损表现,如左侧前肢屈曲内收、爬行时向左侧划圈、站立时向左侧倾倒和意识丧失等,神经行为学评分在1~4分之间。LB各剂量组在缺血再灌注24h和72h后,均可降低大鼠的神经行为学评分,与模型组比较有显著性差异(P<0.05或 P<0.01),其中剂量组作用较强,与阳性药物对照组比较有显著性差异(P<0.05或 P <0.01);用药72h后 LB 低、中剂量组神经行为学评分低于用药24h,中剂量组有显著性差异(P <0.05或 P <0.01)(见表2)。
2.2 LB对大鼠缺血性脑损伤海马组织各时段NT-3 mRNA的影响 实验显示:LB各剂量组均能增加海马NT-3 mRNA的表达,与模型组比较有显著性差异(P<0.05或 P<0.01),其低、中剂量组作用较好优于阳性对照药(P<0.05或 P<0.01),用药72h较用药24h的作用更强,两者相比有显著性差异(见表3、图1)。
2.3 LB对缺血性脑损伤大鼠纹状体各时段NT3 mRNA的影响 结果显示:LB各剂量组均能增加纹状体NT-3 mRNA的表达,与模型组比较有显著性差异(P<0.05或 P<0.01),其中、低剂量组优于阳性对照药(P<0.05或 P<0.01),用药72h较用药24h的作用更强,两者相比有显著性差异(见表4、图2)。

表1 NT-3和β-actin的上下游引物
表2 LB对缺血性脑损伤大鼠神经缺损症状评分的影响±s)

表2 LB对缺血性脑损伤大鼠神经缺损症状评分的影响±s)
与模型组比较*P <0.05,**P <0.01;与阳性药物对照组比较#P <0.05,##P <0.01;与用药24h比较 ΔP <0.05,ΔΔP <0.01
组别 药物剂量(mg/kg)时间麻醉清醒后24h 72h假手术组模型组阳性对照组LB低剂量组LB中剂量组LB高剂量组--112.525500.00 ±0.003.72 ±0.453.95 ±0.353.26 ±0.853.98 ±0.633.99 ±0.520.00 ±0.003.60 ±0.512.61 ±0.52*2.11 ±0.48**2.00 ±0.51**#2.41 ±0.49**0.00 ±0.003.69 ±0.712.58 ±0.53*Δ 2.05 ±0.58**1.40 ±0.67**##Δ 2.35 ±0.92**Δ
表3 LB对缺血性脑损伤大鼠海马NT-3 mRNA表达的影响±s)
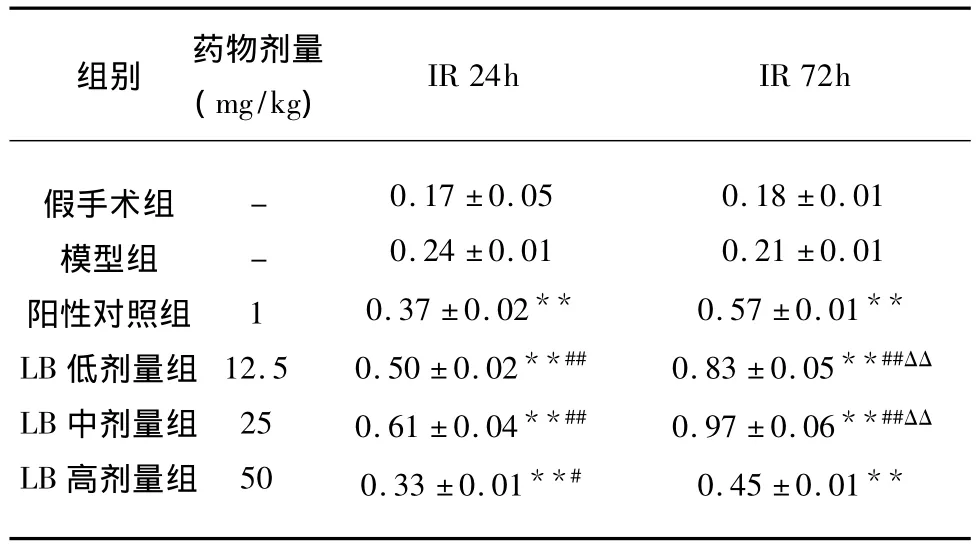
表3 LB对缺血性脑损伤大鼠海马NT-3 mRNA表达的影响±s)
与模型组比较*P<0.05,**P<0.01;与阳性药物对照组比较#P <0.05,##P <0.01;与用药24h 比较 ΔP <0.05,ΔΔP <0.01
组别 药物剂量(mg/kg)IR 24h IR 72h假手术组模型组阳性对照组LB低剂量组LB中剂量组LB高剂量组--112.525500.17 ±0.050.24 ±0.010.37 ±0.02**0.50 ±0.02**##0.61 ±0.04**##0.33 ±0.01**#0.18 ±0.010.21 ±0.010.57 ±0.01**0.83 ±0.05**##ΔΔ 0.97 ±0.06**##ΔΔ 0.45 ±0.01**
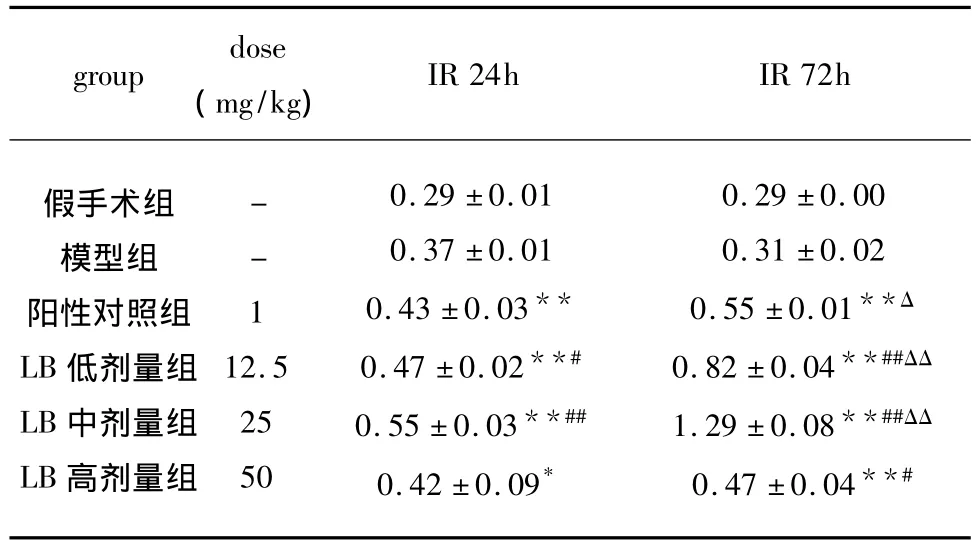
表4 LB对缺血性脑损伤大鼠纹状体NT-3 mRNA表达的影响

图1 Lactuside B对缺血性脑损伤大鼠海马NT-3 mRNA表达的影响(PCR电泳图)

图2 LB对缺血性脑损伤大鼠纹状体NT-3 mRNA表达影响(PCR电泳图)
3 讨论
缺血性脑损伤是由于各种原因引起的脑部供血减少或中断而导致的以神经感觉和运动障碍为主的一类脑血管性疾病,临床上多见于脑血栓形成或脑栓塞,其它如药物中毒、心脏骤停等原因也可导致不同程度的脑缺血性损伤。
缺血性脑损伤有着复杂的病理生理过程,由于脑血流的急性中断和随后的再灌注发生,可导致不同脑区的神经细胞广泛损伤。脑缺血后神经损害主要发生在大脑皮质和纹状体[9,10],海马部位的神经元也易受累[11,12]。
有研究认为神经营养因子-3(NT-3)在保护神经细胞、避免其损伤死亡的过程中起着一个重要的作用,缺血性脑损伤的危险因素可下调其在脑部的表达[13]。也有研究发现,脑缺血后海马 NT-3维持一定水平在某时间范围内有利于脑缺血[14]。
虽然NT-3对于缺血性脑损伤的保护作用早已被人们所认知,但许多研究证实脑缺血后皮质、海马部位的 NT-3表达减少[15,16],此可能是脑组织对缺血损害的一种防御性反应。本实验研究发现,缺血性脑损伤24h和72h后模型组动物的NT-3 mRNA在海马和纹状体却表达增多,主要原因可能为本实验所采用的时间点与其它研究有较大的差别,以往NT-3在脑组织的基因或蛋白表达研究都是在脑缺血后十几分钟或几小时之内取材,而本实验依据给药需要设置的时间点较长。Yang等研究报道,用核酶保护和原位杂交法检测短暂性脑缺血大鼠海马神经元时发现NT-3的表达趋势是先下降后上升[17],故本实验结果与其它研究结果并不背离。
本实验研究还发现,在缺血性脑损伤大鼠的海马和纹状体组织,Lactuside B各剂量组均能增加其NT-3 mRNA的表达,且中、低剂量组优于阳性对照药,用药72h NT-3 mRNA表达更多。实验结果提示:Lactuside B良好的抗脑缺血作用与其能够上调、维持海马和纹状体NT-3 mRNA的表达有关,但两部位NT-3 mRNA的表达与其蛋白的表达是否一致,尚需在以后的实验中去研究证实。
目前,对于缺血性脑损伤的有效治疗除了在治疗窗内进行溶栓外,其它的药物治疗主要倾向于神经功能的保护,但能见诸于临床并有确切作用的药物很少。有关Lactuside B抗缺血性脑损伤的作用和作用机制的研究,将为其作为神经功能保护的潜在新药提供一定的理论基础和实验依据。
[1] Friedman WJ,Ibanez CF,Hallbook F,et al.Differential actions of neurotrophins in the locus coeruleus and basal forebrain[J].Exp Neurol,1993,119(1):72 - 78.
[2] Hohn A,Leibrock J,Bailey K,et al.Identification and characterization of a novel member of the nerve growth factor/brain-derived neurotrophic factor family[J].Nature,1990,344(6264):339 - 341.
[3] Farinas I,Jones KR,Backus C,et al.Severe sensory and sympathetic deficits in mice lacking neurotrophin-3[J].Nature,1994,369(6482):658-661.
[4] Bradbury EJ,King VR,Simmons LJ,et al.NT-3,but not BDNF,prevents atrophy and death of axotomized spinal cord projection neurons[J].Eur JNeurosci,1998,10(10):3058 - 3068.
[5] Zhang ZH,Wang RZ,Wang RZ,et al.Transplantation of neural stem cells modified by human neurotrophin-3 promotes functional recovery after transient focal cerebral ischemia in rats[J].Neurosci Lett,2008,444(3):227 -230.
[6] Benoit ME,Tenner AJ.Complement protein C1q-mediated neuroprotection is correlated with regulation of neuronal gene and microRNA expression[J].JNeurosci,2011,31(9):3459 -3469.
[7] 詹合琴,郭兰青,崔建敏,等.高翅果菊化学成分及lactuside B的抗脑缺血活性研究[J].中草药,2010,41(5):692-696.
[8] Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20:84-91.
[9] Hou SW,Wang YQ,Xu M,et al.Functional integration of newly generated neurons into striatum after cerebral ischemia in the adult rat brain[J].Stroke,2008,39:2837 -2844.
[10] Tanaka K,Wada N,Ogawa N,et al.Chronic cerebral ischemia-repoperfusion induces transient reversible monoaminergic changes in the rat brain[J].Neurochem Res,2000,25(2):313 - 320.
[11] Sasaki T,Hamada J,Shibata M,et al.Inhibition of nitric oxide production during global ischemia ameliorates ischemic damage of pyramidal neurons in the hippocampus[J].Keio JMed,2001,50(3):82-87.
[12] Ray AM,Benham CD,Roberts JC,et al.Capsazepine protects against neuronal injury caused by Oxygen Glucose Deprivation by Inhibiting 1h[J].J Neurosci,2003,23(31):10146 -10153.
[13] Yang JT,Chang CN,Wu JH,et al.Cigarette smoking decreases neurotrophin-3 expression in rat hippocampus after transient forebrain ischemia[J].Neurosci Res,2008,60(4):431 -438.
[14] Yang JT,Chang CN,Lee TH,et al.Hyperbaric oxygen treatment decreases post-ischemic neurotrophin-3 mRNA down-regulation in the rat hippocampus[J].Neuroreport,2001,12(16):3589 -3592.
[15] Takeda A,Onodera H,Yamasaki Y,et al.Decreased expression of neurotrophin-3 mRNA in the rat hippocampus following transient forebrain ischemia[J].Brain Res,1992,569(1):177 -180.
[16] 李宗敏,李 莉,陈立君,等.局部亚低温对大鼠局灶脑缺血再灌注后神经营养因子-3表达的影响[J].国际病理科学与临床杂志,2009,29(1):6 -9.
[17] Yang JT,Chang CN,Lee TH,et al.Effect of dexamethasone on the expression of brain-derived neurotrophin factor and neurotropuin-3 messenger ribonucleic acid after forebrain ischemia in the rat[J].Crit Care Med,2002,30(4):913 -918.

