JAK2/STAT3信号转导通路在大鼠急性脊髓损伤中对细胞凋亡的调控作用
飞 翔, 锁志刚, 丁惠强, 唐晓杰, 樊 涛
基因调控的启动需要复杂而周密的信号转导系统,JAK2/STAT3信号转导通路是近年来备受关注的一条细胞内重要的信号转导途径,该途径是多种细胞因子和生长因子信号转导的共同通路,在细胞的增值、分化、凋亡以及免疫调节等过程中发挥着重要作用[1~3]。目前对脊髓损伤后信号通路的研究较少,JAK2/STAT3信号转导通路在ASCI后继发脊髓损伤中对细胞凋亡是否起调控作用未得到证实。本实验应用大鼠急性脊髓损伤模型,检测 JAK2/STAT3信号转导通路相关基因JAK2、STAT3的磷酸化水平及细胞凋亡执行基因caspase-3在ASCI后的表达变化。
1 材料与方法
1.1 实验动物及主要试剂、仪器 健康成年雄性SD大鼠90只,体重225~275g,由宁夏医科大学实验动物中心提供。P-JAK2多克隆抗体(phospho-Try1007+Tyr1008)、P-STAT3多克隆抗体(phospho-Thr705)、Caspase-3多克隆抗体、过氧化物酶标记的链霉卵白素染色试剂盒(以上均购自北京博奥森生物技术有限公司)、DAB显色试剂盒(购自北京中杉金桥生物技术有限公司)、AG-490(购自美国Sigma公司)。全自动切片机(德国莱卡公司)、全自动染色仪、自动封片仪(德国MiCROM公司)、BMJ-Ⅲ型包埋机(常州中成电子仪器厂)、显微照相系统(日本OYLMPUS公司)。
1.2 脊髓损伤动物模型制备 应用Allen’s重物击落法并加改良制作大鼠急性脊髓损伤模型:大鼠实验前禁食8h,实验顺序随机进行。用3%的水合氯醛(27mg/100g)腹腔内注射麻醉,俯卧位固定,无菌操作。取胸背部正中切口,长约2.5cm,逐层切开皮肤及皮下组织,暴露T8-T10椎板,将T9全椎板切除,显露硬脊膜并使之保持完整,钳夹固定T8及T10棘突,用质量为10g的克氏针沿带有刻度的导管从25mm高处垂直自由下落,打击在直径4mm,宽2mm的由薄塑料材料制成的半圆片上,致伤后迅速移开打击物,造成大鼠脊髓不完全损伤,逐层缝合。模型成功的判定标准:打击后,损伤处脊髓出血、水肿,大鼠出现摆尾反射,双下肢及躯体回缩样扑动,麻醉清醒后双下肢呈弛缓性瘫痪。对照组只切开T9全椎板,不损伤脊髓。每天切口局部消毒一次,每8h膀胱按摩协助排尿,直至建立反射性膀胱排空。分笼饲养,自由取食,饲养室温度保持在25℃左右。
1.3 取材及组织切片制备 在各个时间点逐个对每只大鼠行过量麻醉(注射3%的水合氯醛54mg/100g),打开胸腔,经左心室将管插入主动脉,并用止血钳固定,切开右心耳,对心脏快速灌注冰生理盐水,待流出的液体清亮后换用4%多聚甲醛缓冲液固定40min,自背部原切口进入,钝性剥离,充分暴露脊髓,切取以损伤段为中心长约1cm脊髓,放入4%多聚甲醛缓冲液固定过夜,常规脱水,石蜡包埋,行冠状面连续切片,片厚4μm。取一部分行HE染色,另取一部分做免疫组织化学检测。
1.4 HE染色及免疫组织化学染色 对3组的每例大鼠脊髓标本进行HE染色,光镜下观察两组在各个时间的脊髓组织形态结构的改变。
对每例大鼠脊髓标本随机切取数张切片,分别进行P-JAK2、P-STAT3及caspase-3免疫组织化学染色。按SP试剂盒说明书操作:烤片、常规脱蜡至水、高压修复、3%H2O2去离子水处理、血清封闭、滴加一抗过夜(工作浓度P-JAK2为1:50、P-STAT3为1∶100、Caspase-3为1∶100),并同时用PBS代替一抗作为阴性对照,次日滴加二抗、S-A/HRP工作液,最后DAB显色,镜下控制,蒸馏水终止显色,以上步骤均用PBS冲洗5min×3次,之后苏木素轻度复染、冲洗、梯度酒精脱水,透明,中性树胶封片。光镜观察脊髓组织,以细胞浆棕黄色着色为阳性细胞,每张切片分别于灰质、白质各取3个视野(×400),采用双盲法分别计算每个视野的阳性细胞数,取平均值。
1.5 腹腔给药 AG490+脊髓损伤组:将AG490(40μg/g)充分溶解到45%二甲基亚枫(DMSO),脊髓损伤之前20min缓慢注入大鼠腹腔。对照组和脊髓损伤组:只注射等量45%二甲基亚枫。
2 结果
2.1 HE染色结果 对照组各时间脊髓组织的神经细胞及神经胶质细胞形态规则,白质致密(见图1A)。脊髓损伤组4h毛细血管扩张充血,细胞内水肿,灰质结构破坏,可见少量神经细胞死亡,部分神经细胞有核固缩表现,12h上述现象逐渐显著。24h至72h出血范围扩大,脊髓破坏严重,灰质中神经元数量明显减少,出现胞体皱缩和胞核固缩,有凋亡小体形成,白质中可见肿胀的轴突和大量空泡,并有炎性细胞浸润,72h邻近阶段也有表现(见图1B)。168h脊髓破坏范围与72h基本相同,有空洞形成,有很典型的凋亡区域。AG490+脊髓损伤组各个时间点脊髓组织病理学改变与脊髓损伤组比较无明显变化。
2.2 P-JAK2、P-STAT3 的表达 P-JAK2、PSTAT3阳性表达的细胞胞浆呈棕黄色颗粒。在对照组各时间点脊髓组织里检测到少量 P-JAK2、PSTAT3阳性细胞(见图1C、F)。脊髓损伤组各时间点P-JAK2、P-STAT3阳性表达明显高于对照组(P<0.01),脊髓损伤后4h即在损伤阶段及邻近阶段检测到P-JAK2、P-STAT3阳性表达的细胞。在SCI后12h脊髓损伤组织的背侧较腹侧损伤严重,有少数变形和压缩的神经细胞存留,P-JAK2和P-STAT3主要表达在这些脊髓前角神经细胞,12h达峰值,而后逐渐减少,168h仍有表达,主要在邻近阶段,白质、灰质均检测到阳性细胞(见图1D、G)。AG490+脊髓损伤组各个时间点P-JAK2、P-STAT3阳性表达量较脊髓损伤组降低,但峰值不变(P<0.01)(见表1、表2 及图1E、H)。
2.3 Caspase-3的表达 Caspase-3表达的阳性细胞胞浆呈棕黄色颗粒。对照组脊髓组织里少见(见图1I),脊髓损伤组各时间点阳性细胞数明显高于对照组(P<0.01),4h即能检测到大量的阳性细胞,72h达峰值(见图1J)。AG490+脊髓损伤组Caspase-3的阳性表达量低于脊髓损伤组(P<0.01)(见表3、图1K)。
表1 不同大鼠脊髓组织中P-JAK2的表达及阳性细胞数± s,n=36,个/视野)
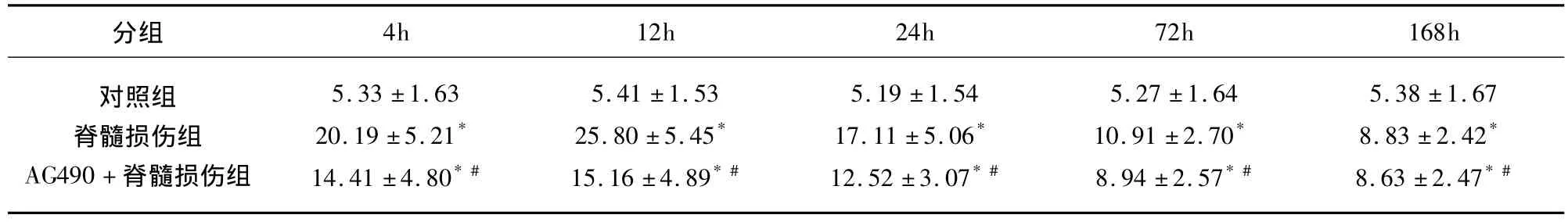
表1 不同大鼠脊髓组织中P-JAK2的表达及阳性细胞数± s,n=36,个/视野)
与假手术比较*P<0.01;与脊髓损伤组比较#P<0.01
分组4h 12h 24h 72h 168h对照组脊髓损伤组AG490+脊髓损伤组5.33 ±1.6320.19 ±5.21*14.41 ±4.80*#5.41 ±1.5325.80 ±5.45*15.16 ±4.89*#5.19 ±1.5417.11 ±5.06*12.52 ±3.07*#5.27 ±1.6410.91 ±2.70*8.94 ±2.57*#5.38 ±1.678.83 ±2.42*8.63 ±2.47*#
表2 不同脊髓组织中P-STAT3的表达及阳性细胞数 ± s,n=36,个/视野)
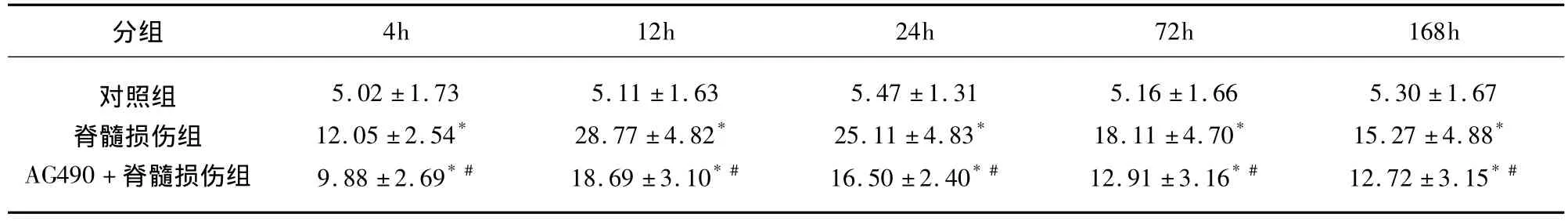
表2 不同脊髓组织中P-STAT3的表达及阳性细胞数 ± s,n=36,个/视野)
与对照组比较*P<0.01;与脊髓损伤组比较#P<0.01
分组4h 12h 24h 72h 168h对照组脊髓损伤组AG490+脊髓损伤组5.02 ±1.7312.05 ±2.54*9.88 ±2.69*#5.11 ±1.6328.77 ±4.82*18.69 ±3.10*#5.47 ±1.3125.11 ±4.83*16.50 ±2.40*#5.16 ±1.6618.11 ±4.70*12.91 ±3.16*#5.30 ±1.6715.27 ±4.88*12.72 ±3.15*#
表3 不同脊髓组织中Caspase-3的表达及阳性细胞数± s,n=36,个/视野)
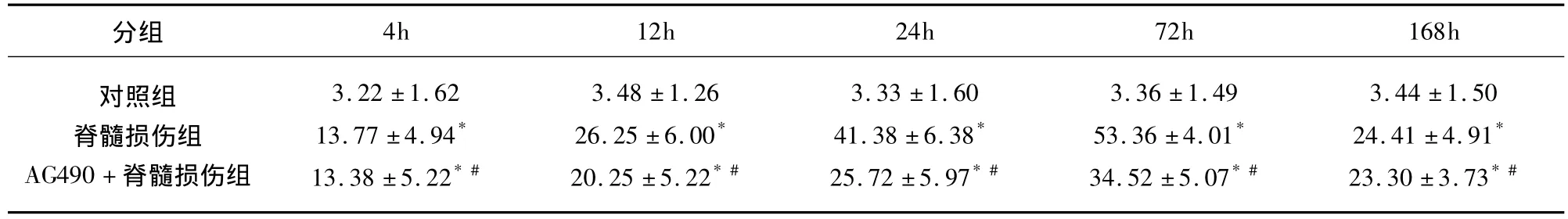
表3 不同脊髓组织中Caspase-3的表达及阳性细胞数± s,n=36,个/视野)
与假手术比较*P<0.01;与脊髓损伤组比较#P<0.01
分组4h 12h 24h 72h 168h对照组脊髓损伤组AG490+脊髓损伤组3.22 ±1.6213.77 ±4.94*13.38 ±5.22*#3.48 ±1.2626.25 ±6.00*20.25 ±5.22*#3.33 ±1.6041.38 ±6.38*25.72 ±5.97*#3.36 ±1.4953.36 ±4.01*34.52 ±5.07*#3.44 ±1.5024.41 ±4.91*23.30 ±3.73*#
3 讨论
3.1 ASCI可异常激活JAK2/STAT3信号转导通路 本研究基于多数学者提出的SCI后细胞凋亡调控的时相和空间分布点,选择4、12、24、72和168h等5 个时间点[4,5]。本实验结果显示,在 ASCI后JAK2和STAT3的磷酸化立即发生,12h达峰值,然后逐渐降低。从变化规律上看,P-JAK2在SCI后4h表达量迅速上升,12h达峰值,而后下降较快,168h的表达量明显低于其它的时间点。而P-STAT3则是在SCI后4h缓慢上升至12h的峰值,而后下降缓慢,168h的表达量仍然高于4h(见图2A、B),这符合JAK/STAT的代谢机制和快速启动及瞬间消失的显著特性[6]。在正常生理状态下,JAK2和STAT3会发生瞬时的磷酸化,这种激活状态只持续数分钟至几小时[7],对照组里有少量P-JAK2、P-STAT3的阳性表达,说明正常生理状态下脊髓组织里 JAK2、STAT3同样以非磷酸化的状态存在为主。而在脊髓损伤组里,P-JAK2、P-STAT3在各个时间点上的阳性表达均高于对照组,证明ASCI后JAK2、STAT3主要以磷酸化的状态存在,初步证实JAK2/STAT3信号转导通路是被异常激活的。
研究表明JAK/STAT信号通路的受体不具备酶的特性,但其胞内段具有酪氨酸蛋白激酶的结合位点,受体与配体结合后,通过与之相联系的酪氨酸蛋白激酶的活化,磷酸化各种靶蛋白的酪氨酸残基来实现信号转导[8]。这些受体主要有 IL-2、IL-4、IL-4、IL-6、PRL、CSF 等因子[9]。Chen 等[10]报道IL-6 可激活中枢神经信号转导通路JAK/STAT和MAPK,Suzuki等[11]证实 IL-6的下游信号通路 JAK/STAT在大脑局部缺血再灌注损伤中发挥重要的作用。在ASCI后也有许多早期炎性细胞因子的表达[12,13],JAK2/STAT3信号转导通路是否被这些早期炎性因子激活有待进一步研究证实,这可能是 ASCI后JAK2/STAT3信号转导通路被异常激活的机制。
3.2 JAK2/STAT3信号转导通路可调控ASCI后继发脊髓损伤中细胞凋亡 脊髓损伤可直接导致神经功能丧失,从而引起组织、器官功能障碍。神经元和神经胶质细胞丧失是脊髓损伤后脊髓功能永久性障碍的主要原因。自1996年Li等[14]报道大鼠压迫性脊髓损伤后白质内出现大量凋亡细胞以来,对ASCI后细胞凋亡的深入研究发现,许多基因参与了细胞凋亡的调控,其中caspase家族参与凋亡各个时期,是细胞凋亡途径的核心成分[15]。大量的研究表明,凋亡的发生是蛋白酶级联切割过程,Caspase-3在这一过程中起着核心作用,被称作死亡蛋白酶[16],其通过对蛋白激酶、核酸酶及细胞骨架的裂解,产生核皱缩、DNA片段形成等凋亡现象,最终控制凋亡的发生和发展。本研究通过免疫组织化学法检测发现ASCI后Caspase-3阳性表达在4h迅速上升,72h达峰值,168h的表达仍高于对照组,这与大部分学者的结果相符[17,18]。HE染色证实损伤最严重阶段也出现在ASCI后72h,脊髓破坏严重,灰质中神经元数量明显减少,出现胞体皱缩和胞核固缩,有凋亡小体形成,Caspase-3的阳性表达高峰与其相同,再次说明caspase-3在ASCI后继发损伤中的重要性。
基因调控的启动需要复杂而周密的信号转导系统,JAK2/STAT3信号转导通路是近年来国内外学者研究的热点,研究主要集中在与免疫系统和肿瘤相关疾病及机制方面。Kong等[19]报道,脑缺血激活JAK/STAT信号转导通路,磷酸化的STAT3入核发挥重要功能,调节大量的基因表达,该信号通路可能直接参与诱导了脑缺血所致的神经元凋亡。Wang等[20]研究报道,由JAK2/STAT3信号转导通路介导,可诱导大量的大脑皮质神经元细胞凋亡。还有研究发现,JAK/STAT3信号转导通路在许多实体肿瘤和血液肿瘤中被激活,可能与其促进生长和抗凋亡作用有关[21]。STAT是JAK激酶的底物,JAK能使705位酪氨酸残基磷酸化转而招募并激活STAT。激活的STAT单体聚合,以二聚体、四聚体等多聚体形式穿越核膜,特异性结合DNA反应元件上,启动下游目的基因转录,使信号从细胞外向细胞内转导,并实现细胞增值、分化、凋亡以及免疫调节等过程[22,23]。STAT3是STAT家族中最为活跃的成员[24],对细胞的生长与凋亡,以及细胞周期的调控都有着重要的影响[25],是一种具有关键作用的的双功能蛋白,调控大量的下游的靶基因,谢惠芳等[26]在大鼠局灶性脑缺血再灌注损伤后,阻断JAK2/STAT3信号转导通路后发现,其能减轻神经细胞凋亡,改善神经功能缺损症状。本实验基于此,在建立大鼠脊髓损伤模型之前腹腔内注射AG-490,(AG-490是近年来新发现的一种JAK2、JAK3的阻断剂)可有效阻断下游STAT3 的活化[27],结果显示,P-JAK2、P-STAT3 阳性的表达较脊髓损伤组各个时间的表达降低,同时发现caspase-3的阳性表达也较脊髓损伤组有明显降低(见图2C),产生这种现象的原因尚不清楚,但提示JAK2、STAT3是Caspase-3的上游调因子。
总结,本实验应用大鼠急性脊髓损伤模型,通过分子生物学方法研究发现,ASCI可异常激活JAK2/STAT3信号转导通路,同时证实caspase-3是继发脊髓损伤中细胞凋亡的重要执行因子之一。AG-490可抑制JAK2/STAT3信号转导通路活化,而且减少了caspase-3的表达,提示该通路是Caspase-3的前提,进一步提示其对神经细胞凋亡起着重要调控作用。这为继发脊髓损伤的机制提供更多的理论基础,为研究和设计以信号传导通路为靶的药物和治疗方法提供新思维。
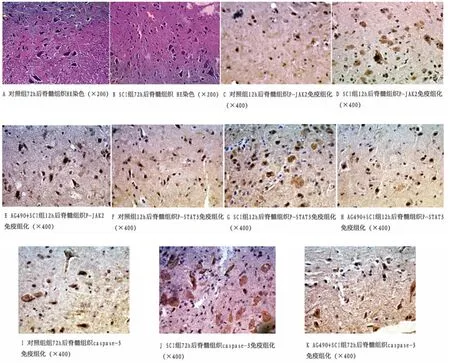
图1 3组大鼠脊髓组织HE染色和P-JAK2、P-STAT3、Caspase-3免疫组织化学染色结果

图2 P-JAK2、P-STAT3、Caspase-3在3组大鼠脊髓组织中各个时间点的表达量及趋势图
[1] Morales JK,Falanga YT,Depcrynski A,et al.Mast cell homeostasis and the JAK-STAT pathway[J].Genes Immun,2010,11(8):599 -608.
[2] Lai SY,Johnson FM.Defining the role of the JAK-STAT pathway in head and neck and thoracic malignancies:implications for future therapeutic approaches[J].Drug Resist Updat,2010,13(3):67 - 78.
[3] Yang QZ,Lei C,Lu ZH,et al.Neuroprotective effects of combined application of JAK-STAT signal pathway inhibitor and free radical scavenger on focal cerebral ischemia/reperfusion injury in rats[J].Zhongguo Wei Zhong Bing Ji Jiu Yi Xue,2008,20(11):641 -644.
[4] 刘世清,周 华.大鼠急性脊髓损伤后细胞凋亡的时空分布特点[J]. 中国矫形外科杂志,2003,11(24):1699 -1700.
[5] 傅 强,候铁胜,李 明,等.脊髓急性损伤后神经细胞凋亡的时相和空间分布特点[J].颈腰痛杂志,2001,22(3):199-201.
[6] Liu H,Yao YM,Yu Y,et al.Role of Janus kinase/signal transducer and activator of transcription pathway in regulation of expression and inflammation-promoting activity of high mobility group box protein 1 in rat peritoneal macrophages[J].Shock,2007,27(1):55 -60.
[7] Hilton DJ.Negative regulators of cytokine signal transduction[J].Cell Mol Life Sci,1999,55(12):1568 -1577.
[8] 陈晓萍,徐 飞.JAK-STAT信号通路研究进展[J].自然杂志,2003,25(3):149 -152.
[9] Geijsen N,Koenderman L,Coffer PJ.Specificity in cytokine signal transduction:lessons learned from the IL-3/IL-5/GM-CSF receptor family[J].Cytokine Growth Factor Rev,2001,12(1):19 -25.
[10] Chen SH,Benveniste EN.Oncostatin M:a pleiotropic cytokine in the central nervous system[J].Cytokine Growth Factor Rev,2004,15(5):379-391.
[11] Suzuki S,Tanaka K,Suzuki N.Ambivalent aspects of interleukin-6 in cerebral ischemia:inflammatory versus neurotrophic aspects[J].J Cereb Blood Flow Metab,2009,29(3):464 -479.
[12] Bartholdi D,Schwab ME.Expression of pro-inflammatory cytokine and chemokine mRNA upon experimental spinal cord injury in mouse:an in situ hybridization study[J].Eur J Neurosci,1997,9(7):1422-1438.
[13] Hayashi M,Ueyama T,Nemoto K,et al.Sequential mRNA expression for immediate early genes,cytokines,and neurotrophins in spinal cord injury[J].JNeurotrauma,2000,17(3):203 - 218.
[14] Li GL,Brodin G,Farooque M,et al.Apoptosis and expression of Bcl-2 after compression trauma to rat spinal cord[J].JNeuropathol Exp Neurol,1996,55(3):280 -289.
[15] 汪红林,徐祝军.脊髓损伤后细胞凋亡基因调空进展[J].国际骨科杂志,2010,31(3):187 -189.
[16] Stermicke HR,Salvesen GS.Properties of the Caspase[J].Biochim Biophys Acta,1998,1387:17 -31.
[17]易成腊,陈安民,徐卫国,等.大鼠脊髓损伤后Caspase-3表达和神经细胞凋亡相关性研究[J].创伤外科杂志,2004,6(3):171-174.
[18] 崔 开,韩亚新,孔冉冉,等.大鼠急性脊髓损伤后 Caspase-3、Cathep sin B的表达[J].中国矫形外科杂志,2009,17(18):1400-1403.
[19] Kong LY,Abou-Ghazal MK,Wei J,et al.A novel inhibitor of signal transducers and activators of transcription 3 activation is efficacious against established central nervous system melanoma and inhibits regulatory T cells[J].Clin Cancer Res,2008,14(18):5759 - 5768.
[20] Wang G,Zhou D,Wang C,et al.Hypoxic preconditioning suppresses group III secreted phospholipase A2-induced apoptosis via JAK2-STAT3 activation in cortical neurons[J].J Neurochem,2010,114(4):1039-1048.
[21] Ram PT,Iyengar RG.G protein coupled receptor signaling through the Src and Stat3 pathway:role in proliferation and transformation[J].Oncogene,2001,20(13):1601 -1606.
[22] Darnell JE Jr.STATs and gene regulation[J].Science,1997,,277(5332):1630-1635.
[23] Ihle JN,Kerr IM.Jaksand Stats in signaling by the cytokine receptor Superfamily[J].Trends Genet,1995,11(2):69 -74.
[24] Bromberg JF.Activation of STAT proteins and growth control[J].Bioessays,2001,23(2):161 -169.
[25] Ram PT,Iyengar RG.G protein coupled receptor signaling through the Src and Stat3 pathway:role in proliferation and transformation[J].Oncogene,2001,20(13):1601 -1606.
[26] 谢惠芳,徐如祥,魏继鹏,等.炎症介质阻断剂对大鼠脑缺血再灌注损伤后神经功能缺损、细胞凋亡及半胱氨酸蛋白酶-3表达的影响[J].临床神经病学杂志,2009,22(3):199-202.
[27] Xiong H,Zhang ZG,Tian XQ,et al.Inhibition of JAK1,2/STAT3 signaling induces apoptosis,cell cycle arrest,and reduces tumor cell invasion in colorectal cancer cells[J].Neoplasia,2008,10(3):287 -297.

