头部局部亚低温对实验性脑出血大鼠脑组织TNF-α、NF-κB 影响的研究
高宏艳, 徐宝林, 吴 江
脑出血(ICH)是严重危害人类健康的一类常见疾病。但迄今为止对于ICH仍缺乏很有效的治疗方法。作为炎症反应的重要指标——细胞因子,在ICH病理生理过程中扮演着重要角色。因此,有必要针对抑制ICH炎症反应这方面进行研究,以指导ICH的临床治疗。亚低温方法的脑保护作用近些年来逐渐被人们重视起来,作者拟通过研究亚低温治疗对大鼠实验性ICH急性期肿瘤坏死因子-α(TNF-α)和核转录因子-κB(NF-κB)表达的影响,以继续探讨头部局部亚低温治疗的脑保护作用机制。
1 材料与方法
1.1 实验动物分组 健康雄性Wistar大鼠36只,月龄3~4个月,体重250~300g。随机分为常温组、亚低温组、假手术组,每组各12只。常温组和亚低温组用非肝素化自体血建立ICH模型,亚低温组在建立模型后立即应用头部局部亚低温连续治疗48h,常温组不予以治疗,假手术组仅完成同样的手术过程但不注血,亦不予以治疗。
1.2 制备实验性ICH动物模型 大鼠以10%水合氯醛(4ml/kg)腹腔麻醉生效后,俯卧于立体定位仪上,耳棒固定外耳孔,鼠门齿比前囟及外耳孔连线低2.4mm。无菌操作暴露颅骨,双氧水显示前囟,定位前囟后0.2mm,中线旁开4mm,垂直进针5.5mm,为大鼠尾壳核区。经心脏穿刺取非肝素抗凝自体动脉血50μl,5min内缓慢注入大鼠尾壳核区,留针10min后,迅速拔针,无菌骨腊封闭颅骨后缝合皮肤。
1.3 亚低温治疗方法 ICH模型术后,将水循环颅脑制冷仪的冰垫紧贴敷于大鼠的注血侧头部,固定,亚低温仪温度设定在15℃ ~18℃,湿毛巾覆盖于大鼠头部及冰垫处,以维持大鼠头部稳定的低温环境,将温度传感器放置于血肿中心部位,监测治疗侧脑内温度,温度控制在32℃ ~34℃。维持低温治疗48h。低温过程中,注意大鼠的保暖,肛表监测体温,保持体温在37℃ ~38℃之间。常温组和假手术不给予治疗,肛表监测体温,体温在37℃ ~38℃之间。
1.4 脑组织病理标本采集 各组分别取2只动物,于制作模型48h后,以10%水合氯醛(4ml/kg)腹腔麻醉,生效后,立即取脑,沿进针部位冠状位切开脑组织,进行大体观察。各组其余动物于制作模型48h后,以10%水合氯醛(4ml/kg)腹腔麻醉,生效后,用0.9%生理盐水及4%多聚甲醛心脏灌流固定,取脑,再用该液浸泡固定4~6h。沿针孔部位前1mm、后2mm冠状位取材,修块,酒精脱水,二甲苯透明,浸蜡,石蜡包埋,连续切片,切片厚度为2μm。分别进行HE染色及免疫组化染色。
1.5 统计学处理方法 在显微镜下,每张切片均在血肿周围以及注血侧皮质、胼胝体、脉络丛的相同部位分别取5个相邻的200倍视野,以整个细胞或细胞核染成棕黄色作为阳性细胞,计数阳性细胞数,计算出均数和标准差,采用单因素方差分析进行统计学处理。
2 结果
2.1 实验性ICH动物的行为学变化 大鼠注血后活动减少,反应较术前迟钝,部分动物可见注血对侧肢体活动不灵活,有单方向转圈现象。
2.2 实验性ICH动物的脑组织病理改变
2.2.1 大体观察结果 常温组:注血侧脑组织肿胀,沿进针部位冠状位切开脑组织,可见血肿呈类圆形,均匀一致,位于基底节区,直径3mm左右,脑组织周围水肿,有的可见中线移位。亚低温组:注血侧脑组织肿胀程度较常温组轻。假手术组:可见脑表面的针孔,脑组织无肿胀。
2.2.2 HE染色结果 常温组:血肿形成后48h,血肿周围脑组织结构不清,炎细胞浸润,脑组织水肿,神经细胞核固缩、浓染,部分神经细胞坏死、消失。胶质细胞肿胀、增生,部分小胶质细胞内存积含铁血黄素,聚集成片位于血管周围。周围小血管可见出血。亚低温组:脑组织水肿明显轻于常温组,胶质细胞反应较轻,周围小血管出血现象轻于常温组。假手术组:针道附近有少量炎细胞浸润,无明显的组织水肿,无细胞的坏死及胶质细胞增生(见图1~图3)。
2.2.3 免疫组织化学染色结果
2.2.3.1 TNF-α 常温组:TNF-α 大量表达,与假手术组比较,P<0.01,有统计学意义。阳性细胞主要集中在血肿周围、注血侧皮质、胼胝体、脉络丛,包括中性粒细胞、淋巴细胞、胶质细胞、神经细胞、血管内皮细胞、室管膜细胞、脉络丛细胞、胼胝体的成纤维细胞和神经膜细胞。亚低温组:TNF-α阳性细胞亦增多,但较常温组明显减少,P<0.05,有显著差异,与假手术组比较,P<0.01,有统计学意义。阳性细胞主要分布于血肿周围的中性粒细胞、淋巴细胞、胶质细胞、神经细胞、血管内皮细胞,注血侧皮质的胶质细胞、锥体细胞,室管膜细胞,脉络丛细胞,胼胝体的成纤维细胞和神经膜细胞。假手术组:在针道附近、注血侧皮质、胼胝体和脉络丛可见个别阳性表达的细胞(见表1、图4~图6)。
2.2.3.2 NF-κB 常温组:NF-κB 表达显著增多,与假手术组比较,P<0.01,有统计学意义。阳性细胞主要位于血肿周围、注血侧皮质、胼胝体和脉络丛,以中性粒细胞、淋巴细胞、胶质细胞、神经细胞、血管内皮细胞、室管膜细胞、脉络丛细胞、胼胝体的成纤维细胞和神经膜细胞为主,阳性表达大部分在细胞核内。亚低温组:NF-κB在血肿周围、注血侧皮质、胼胝体和脉络丛也可见明显的阳性表达,阳性细胞数显著少于亚低温组,两组间比较P<0.05,具有统计学意义,与假手术组比较,P<0.01,有显著差异。假手术组:可见散在NF-κB阳性细胞,个别阳性表达位于核内(见表2、图7~图9)。

表1 各组大鼠不同部位TNF-α的表达差异

表2 各组大鼠不同部位NF-κB的表达差异
3 讨论
ICH是致死率、致残率很高的一类疾病,且目前无论是脱水降颅压、营养神经、调节血压等内科治疗方法,还是开颅手术清除血肿、开瓣减压、脑室引流等外科方法都不能满意地降低致死率和致残率。因此ICH的治疗是医学界长期关注的一个热点问题。
近些年,人们认识到中枢神经系统亦具有免疫功能,能够发生免疫反应,并发现ICH也存在着炎症反应,作为炎症反应的重要指标——细胞因子,在ICH的病理损伤中扮演着重要角色。
TNF-α是目前研究较多的前炎性细胞因子。TNF-α主要由活化的单核-巨噬细胞产生,在中枢神经系统它可来源于神经细胞、星形胶质细胞、小胶质细胞、室管膜细胞、血管内皮细胞(VEC)、白细胞等[1]。TNF-α的过量表达对神经系统主要发挥其毒性损害作用。大量临床及动物实验研究表明,脑出血后血液、CSF以及血肿周围TNF-α的表达均显著增加,其表达程度与血肿大小成正相关,有继续出血的患者TNF-α表达更高[2]。TNF-α对中枢神经系统的损害作用主要有以下几个方面:(1)直接损伤作用:对少突胶质细胞具有毒性作用,导致其死亡。(2)参与血脑屏障破坏及脑水肿的形成。(3)参与引起细胞凋亡。(4)参与引起离子失调及神经递质紊乱[3]。(5)参与引起凝血和抗凝机制平衡失调[4]。(6)促进其他细胞因子及自由基等的释放,协同加重损伤。近年来,诸多学者对TNF-α的调控机制进行了系列研究,发现TNF-α的表达与NF-κB有着密切的关系。有人研究发现,ICH后1h就有炎症反应,出血2h后,在局部血管周围就可以看见NF-κB复合体的活化,出血后8h表达更为广泛,在出血同侧血肿附近的皮质内亦可见NF-κB的表达增加,并且在数天内持续增高,参与造成脑损伤[5]。因此,抑制细胞因子的过量表达,从而减轻大量细胞因子释放参与造成的血脑屏障破坏、脑水肿、神经元及神经胶质细胞死亡、细胞凋亡等一系列病理变化,是ICH治疗方面有待开拓的一个领域[6]。
近来研究表明亚低温疗法可以提高ICH患者的生存率和生存质量。但是,对于亚低温脑保护机制方面的研究仍很少。本实验旨在研究头部局部亚低温方法对实验性ICH大鼠脑组织内TNF-α及调控其表达的NF-κB的影响,从而进一步深入探讨亚低温的脑保护作用机制。
采用大鼠脑内缓慢注入非肝素化自体血的方法,建立实验性ICH动物模型。各组分别于制作模型后48h后取脑连续切片,进行HE染色及用抗TNF-α和抗NF-κB的多克隆抗体进行免疫组化染色(SP法)。从本实验结果可以看出在大鼠ICH后48h血肿周围有炎细胞浸润、胶质细胞增生,并且脑组织内前炎性细胞因子TNF-α以及调控其转录和翻译的NF-κB明显增多。这表明了在ICH急性期脑组织内炎症反应的存在。亚低温治疗可以下调NF-κB和TNF-α的表达,并且在亚低温治疗组脑血肿周围炎细胞减少,胶质细胞增生程度减轻,以及直接病理观察发现脑组织的脑水肿程度轻于常温组,以上结果均支持亚低温方法可以抑制炎症反应,起到脑保护的作用。而且可以推论,亚低温方法由于抑制了炎症反应调控因子NF-κB的表达,从而抑制了炎症反应。
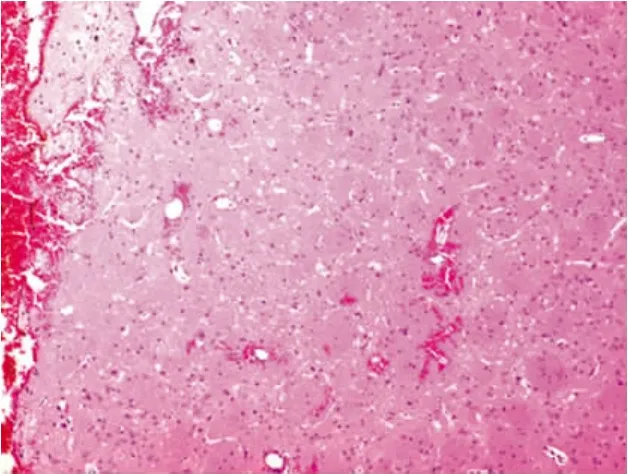
图1 常温组血肿周围脑组织结构不清,炎细胞浸润,组织水肿,神经细核固缩,核浓染,周围小血管出血(HE,100×)
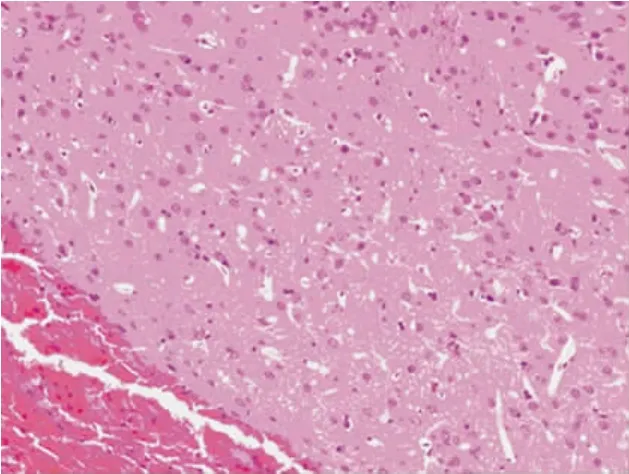
图2 亚低温组血肿周围有少量炎细胞浸润,脑组织水肿明显轻于常温组,胶质细胞反应较轻(HE,100×)

图3 假手术组针道附近无明显炎细胞浸润,无组织水肿(HE,200×)
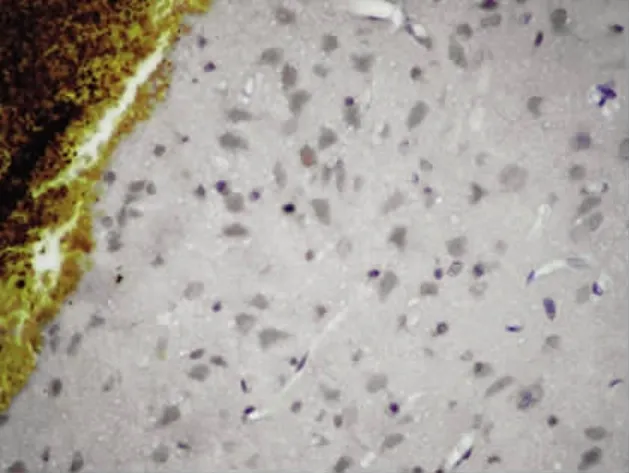
图4 常温组TNF-α在血肿周围的表达(免疫组化,200×)
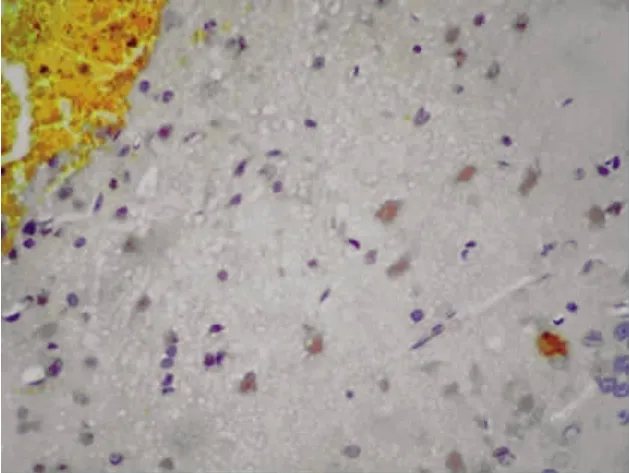
图5 亚低温组TNF-α在血肿周围的表达(免疫组化,200×)

图6 假手术组TNF-α在血肿周围的表达(免疫组化,200×)

图7 常温组NF-κB在皮质的表达(免疫组化,200×)

图8 亚低温组NF-κB在皮质的表达(免疫组化,200×)

图9 假手术组NF-κB在皮质的表达(免疫组化,200×)
[1] Mayne M,Ni W,Yan HJ,et al.Antisense oligodeoxynucleotide inhibition of tumor necrosis factor-alpha expression is neuroprotective after intracerebral hemorrhage[J].Stroke,2001,32:240 - 248.
[2] Silva Y,Leira R,Tejada J,et al.Molecular signatures of vascular injury are associated with early growth of intracerebral hemorrhage[J].Stroke,2005,36(1):86 -91.
[3] Huang R,Sochocka E,Hertz L.Cell culture studies of the role of elevated extracellular glutamate and K+in neuronal cell death during and after anoxia/ischemia[J].Neurosci Biobehav Rev,1997,21:129-134.
[4] Szaflarski J,Burtrum D,Silverstein FS.Cerebral hypoxia ischemia stimulates cytokine gene expression in perinatal rats[J].Stroke,1995,26:1093 -1100.
[5] Susan L,Hickenbottom,MD,James C,et al.Nuclear factor-κ B and cell death after experimental intracerebral hemorrhage in rats[J].Stroke,1999,30:2472 -2478.
[6] Tarkowski E.Intracerebral production of tumor necrosis factor-alpha,a local neuroprotective agent,in Alzheimer disease and vascular dementia[J].JClin Immunol,1999,19(4):223 -230.

