乏力、口干,间断肢体麻木,双肾多发结石
全军肾脏病研究所学术委员会
病例摘要
现病史 38岁女性患者,因“乏力、口干20余年,间断右侧肢体麻木14年,双肾多发结石12年”于2010-11-30第二次入院。
患者于1987年出现脱发、口干、四肢乏力,逐渐发展为四肢软瘫,肢体痛温觉正常,病理反射阴性,外院检查提示低钾(血钾1.5~1.8 mmol/L)、高氯、酸中毒,尿pH不详,诊断为“肾小管酸中毒”,给予枸橼酸钾口服后症状缓解,其后乏力间断发作,均予对症治疗后好转。1996年出现眼睛干涩,1996年4月初无诱因出现双手拇指、食指麻木伴肌力下降,右上肢强直性痉挛,持续约2h后自行缓解,查体示四肢肌力减低,右侧上、下肢肌张力增高,右侧病理反射征阳性,右颈3、左颈4以下痛觉减退;脑脊液检查示蛋白1 000 mg/L,WBC 0.008 ×109/L,MRI示第4~6颈段脊髓弥漫性水肿,诊断为“脊髓脱髓鞘(多发性硬化)”,予地塞米松10 mg/d连续使用7d,续以泼尼松10~20 mg/d,症状缓解,肌力恢复,病理反射消失。1997年4月出现左眼水平以上视野缺失合并右侧肢体伴痛温觉丧失,予甲泼尼龙2.0g及地塞米松球后注射等治疗后好转,其后右侧肢体麻木每年发作2~3次,均予甲泼尼龙冲击后好转。1996年患者双肾B超未见异常,1997年B超发现双肾多发性结石。2001年因双肾结石增多、口干症状加重,并出现眼干、全身无汗,阴道分泌物减少,首次入住我院。查ANA 1∶64阳性、眼科检查提示眼干,唇黏膜活检见中等量淋巴细胞浸润,诊断为干燥综合征,服用雷公藤多苷60 mg/d+泼尼松15 mg/d隔日及枸橼酸钾钠合剂维持治疗,半年后逐渐停用激素,肾功能、电解质维持正常,持续存在少量镜下血尿及白细胞尿,多次尿pH>7。2004年起SSA转为阳性,2007年4因月经紊乱停用雷公藤多苷,改用来氟米特20 mg/d治疗至今,神经系统症状稳定,但出现血白细胞下降(2.9~3.4×109/L)。2008年患者因右侧腰部阵发性绞痛行B超检查发现右输尿管结石,震波碎石后排出多个小结石(南京鼓楼医院行结石成分分析示磷酸钙结石),最大直径约3 mm左右。2010-10-21劳累后出现颈椎疼痛、右手指麻木且逐渐向上臂蔓延,无肌力异常,外院行MRI示颈髓局部水肿,静脉滴注甲泼尼龙(总量800 mg)后症状好转。夜尿13年,1~2次每夜。尿量2 000~3 000 ml/d。病程中无雷诺征、口腔溃疡、皮疹、肌痛、关节疼痛及不规则发热。精神、食欲、睡眠正常,大便正常,体重无明显变化。11月30日再次收入我院。
既往史 对青霉素、头孢类药物过敏。
个人史、家族史 无特殊。
体格检查 体温36.8℃,血压120/86 mmHg,呼吸16次/min,心率80次/min,身高156 cm,体重53 kg,体质量指数(BMI)21.8 kg/m2。全身皮肤、黏膜无皮疹及黄染,未触及浅表淋巴结,结膜、角膜充血,耳、鼻检查未见异常,见5枚龋齿,舌面干燥。心肺未见异常,平卧时左侧平脐、右侧脐下1指处可扪及左、右肾下缘。双侧腰区无叩击痛,双下肢无水肿,右侧大、小鱼际肌轻度萎缩。四肢关节无畸形、肿胀、压痛,活动自如,四肢肌力肌张力正常。右侧肱二头肌反射、肱三头肌反射、桡骨骨膜反射、膝反射、跟腱反射均较左侧亢进,双侧痛、温觉正常。右侧巴氏征阳性,左侧正常。眼科检查:泪膜破裂时间双侧0s、滤纸试验双侧<1 mm,眼底无异常。
实验室检查
尿液 尿酸化试验:pH 7.4。尿钙 146.6 mg/24h,尿酸 551 mg/24h,24h 尿钾 19.22 mmol/L。膀胱穿刺尿细菌培养:大肠埃希菌。其余结果见表1。
血常规 血红蛋白143 g/L,WBC 3.3×109/L,中性粒细胞:55%,PLT 198×109/L。
血生化 白蛋白41.4 g/L,球蛋白28.8 g/L,尿素氮 3.57 mmol/L,血清肌酐(SCr)52.16 μmol/L,尿酸251 mol/L,谷丙转氨酶13 U/L,谷草转氨酶23 U/L,胆固醇4.61 mmol/L,三酰甘油1.98 mmol/L,Na+139 mol/L,K+3.6mmol/L,Cl-102.3 mmol/L,TCO222.9 mmol/L,Ca2+2.29 mmol/L,P3+1.45 mmol/L,血糖 4.33 mmol/L。
血气分析 补碱治疗前:pH 7.312,BE-10.1,PO297 mmHg,PCO234 mmHg;补碱治疗后:pH 7.438,BE 1.5。
免疫学检查 抗ENA抗体谱:抗SSA 2+,余阴性。IgG 17.2 g/L,IgA 1.74 g/L,IgM 0.847 g/L,IgE<20 IU/ml,链球菌溶血素“O”(ASO) <46.2 IU/ml,类风湿因子(RF) < 20.3 IU/ml,补体C3 0.902g/L,C4 0.257 g/L。

表1 两次住院期间各项检查结果
辅助检查 双肾B超(2010年住院期间):左肾122 mm×40 mm×61 mm,右肾 117 mm×35 mm×58 mm,体积增大,双肾锥体回声增强,沿集合系统规则排列;右肾中上极见一大小约18 mm×18 mm的类圆形无回声区,界清;双肾见多个强回声光团,左肾较大的约25 mm,右肾较大的约24 mm,伴后声影;集合系统光带分离左9 mm、右12 mm(图1)。肝胆脾胰超声未见异常。心脏超声见异常。甲状腺及甲状旁腺超声未见异常。
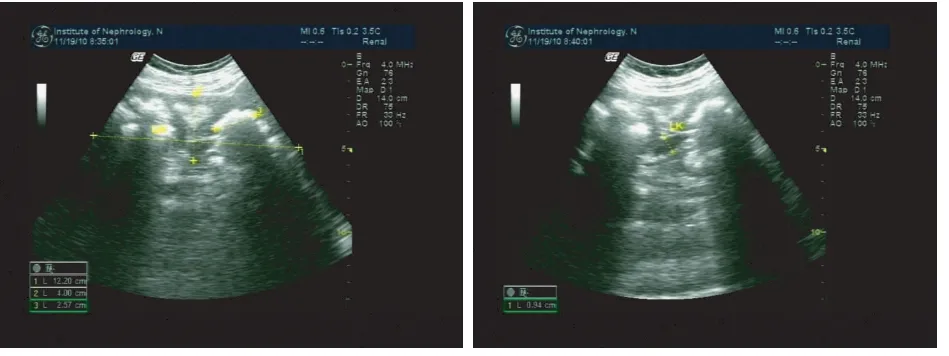
图1 B超提示双肾结石伴积水
X片:胸部正常;立位腹部平片示双肾多发结石,肾盂与第4、5腰椎平齐(图2),骨盆双髋关节未见异常。腹部CT:两侧肾脏髓质高密度影,符合髓质钙盐沉着,与前次比较无明显加重(图3)。头颅及颈椎MRI平扫:双侧半卵圆中心侧脑室旁脑白质、双侧颞叶缺血性改变(图4、5)。颈髓脱髓鞘样病变。C3/4、C4/5、C5/6轻度椎间盘突出(图6)。
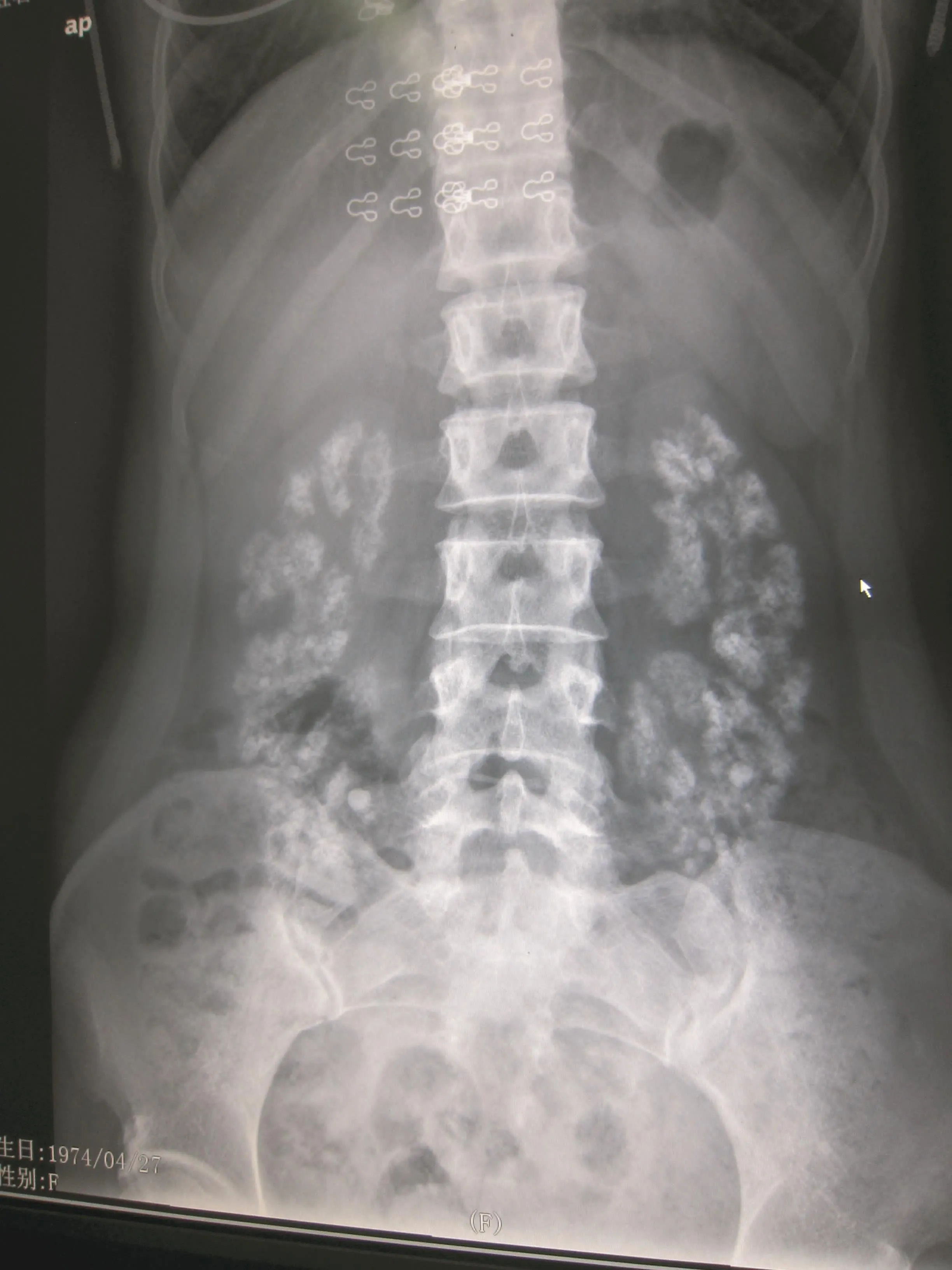
图2 立位腹部平片示双肾多发结石,肾盂与第4、5腰椎平齐

图3 双肾CT:双肾髓质多发高密度影,两次比较无明显加重(A:2001年,B:2010年) 图4 头颅MRI:双侧半卵圆中心侧脑室旁脑白质缺血性改变,2010年(B)较2001年(A)略有加重 图5 头颅MRI:双侧侧脑室旁脑白质缺血性改变,与脑室方向平行(↑)(2010年)
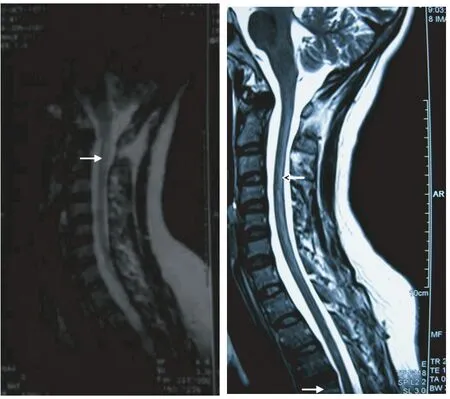
图6 与颈髓MRI:颈髓长条状异常信号,2010年(右)较2001年(左)略有加重(↑)
诊断分析
2001年本刊曾以临床集锦的形式报告过本例患者[1]。此后患者一直在我院随访,2010年因出现神经系统症状再次住院。其病史特点如下:(1)38岁女性,病史长达20余年;(2)严重的口干(舌面干燥、多发龋齿)、眼干(泪膜破裂时间双侧0s、滤纸试验双侧<1s),SSA抗体阳性,ANA阳性,高球蛋白血症,唇黏膜活检提示中等量淋巴细胞浸润;(3)中枢神经系统症状:反复发作右侧肢体麻木伴肌力下降,右上肢强直性痉挛,视野缺失,头颅MRI示颅内病变平行于脑室长轴;(4)肾脏病变:反复低钾性麻痹,伴高氯,血气分析示酸中毒而尿液呈碱性。腹部平片和B超提示双肾多发结石、肾下垂。
干燥综合征 患者10年前存在典型的口干眼干表现,结合唇黏膜活检,已确诊干燥综合征。虽然起病初期SSA、SSB均阴性,但随访过程中SSA转为阳性并持续至今,更证实诊断的正确性。
神经系统病变 患者神经系统症状突出,表现为反复发作的右侧肢体麻木伴肌力下降,右上肢强直性痉挛,视野缺失。MRI示:双侧半卵圆中心侧脑室旁脑白质、双侧颞叶缺血性改变。颈椎脱髓鞘样病变,激素治疗有效。文献报告,干燥综合征可以合并中枢神经系统损害,因此本例应首先考虑干燥综合征的中枢神经系统损害(CNS-SS)。CNS-SS可呈多种表现,其病变累及脑、脊髓和视神经等不同部位导致相应症状。病变趋于反复发生、多灶性和慢性进展性,两次发作间期病情可稳定,这些特点使部分CNS-SS患者临床表现类似多发性硬化,然而,CNS-SS和多发性硬化的影像学表现仍有一定的区别:多发性硬化的病理基础是血管周围炎细胞浸润导致的白质脱髓鞘和胶质增生,由于脑室旁小静脉走行方向垂直于脑室壁,故病灶垂直于脑室长轴,此“垂直脱髓鞘征”可视为多发性硬化的特征性MRI表现[2]。本例患者头颅MRI示颅内病变平行于脑室长轴,因此不符合典型多发性硬化。
肾脏病变 患者存在低钾高氯性酸中毒,尿酸化障碍伴肾小管指标升高[尿N-乙酰-D-氨基葡萄糖胺酶(NAG)、视黄醇结合蛋白(RBP)及溶菌酶],肾小管酸中毒诊断明确。血气分析示酸中毒,而尿液呈碱性,合并肾结石均提示其为远端肾小管酸中毒。10年前我们已经注意到患者存在多发结石。然而对其结石类型及其处理并未深入探讨。随访过程中,患者于2008年因右侧腰部阵发性绞痛而发现右输尿管结石,震波碎石后行成分分析确定为磷酸钙结石。患者主诉久坐或站立后腰部不适,B超提示双肾积水,本次入院后性立位腹部平片提示肾盂与第4~5腰椎平齐,证实肾下垂(二至三度)。
最后诊断 (1)干燥综合征;(2)远端肾小管酸中毒,双肾多发磷酸钙结石,双肾下垂伴积水,尿路感染(大肠埃希菌);(3)干燥综合征的中枢神经系统损害。
治疗及转归 患者自2001年起长期口服枸橼酸钾钠,血钾恢复正常,酸中毒纠正,自觉尿液中排出沙粒样物质较前明显减少。间断服用碳酸氢钠、选用敏感抗生素以防治尿路感染,但仍间断尿WBC阳性。针对神经病变,先后给予激素联合雷公藤多苷和来氟米特免疫抑制治疗,患者病情稳定。2010年10月患者劳累后再次出现颈椎疼痛、右手指麻木,给予甲泼尼龙治疗后好转。
本次入院后全面复查各项指标:干眼症较前加重,腹部平片和肾脏B超提示双肾结石与前次相比无明显加重,但出现双肾下垂伴积水。尿NAG、RBP、溶菌酶及尿渗量等肾小管功能较前明显改善,SCr下降。尿WBC阳性,SSA自2004年起转为阳性。经查阅相关文献,考虑到枸橼酸钾防治结石效果优于枸橼酸钾钠,碳酸氢钠加重钠负荷、增加尿钙排泄,遂停用上述两种药物,改为枸橼酸钾。建议患者使用腹带,避免长时间站立或久坐。经治疗,患者腰部不适较前改善。继用激素30 mg/d以治疗神经病变,因外周血WBC持续低下未用环磷酰胺,给予来氟米特,目前患者右手仅遗留轻微麻木,肌力、感觉无异常。
讨 论
纵观患者十年来病情演变,我们对其诊断和治疗有了新认识。患者口干20余年,起病十余年后(2001年)才在我院确诊为干燥综合征,究其原因,主要与医师仅注意低钾、神经系统病变,未重视口干、眼干和高球蛋白血症有关,深层次原因则在于医师仅满足于临床某一综合征的诊断,未进一步探究其病因。关于干燥综合征诊断延误的问题,10年前我们的病例报告已有深入探讨[1],不再赘述。在近10年的随访过程中,患者SSA转为阳性,进一步证实干燥综合征诊断的正确性和长期随访的重要性。
干燥综合征的预后 一般认为,干燥综合征总体预后尚可,但合并肺纤维化、恶性淋巴瘤者预后较差。曾小峰等[3]对协和医院172例原发性干燥综合征患者进行随访,共9例患者死亡,其中5例死于感染,最常见的为肺间质纤维化伴感染(3例,33.3%),无一例死于肾衰竭和中枢神经病变,作者认为男性患者、肺间质纤维化、雷诺现象及肺动脉高压等为死亡的高危因素。Saugar等[4]观察了24例行肾活检的干燥综合征肾损害患者,其中16例随访时间超过1年,随访12~192月(中位时间76月),14例肾功能改善或稳定,2例肾功能有所进展,无患者进展至终末期肾病(ESRD)。刘正钊等[5]随访了56例干燥综合征肾损害患者,平均随访37.5月,均未出现ESRD或死亡,仅1例出现SCr倍增。本例患者合并中枢神经病变和肾脏病变,无肺部受累,长期使用免疫抑制剂,本次入院复查球蛋白降至正常,近端和远端肾小管指标均较10年前明显改善,SCr始终正常,虽然眼部干燥较前加重,中枢神经系统病变时有发作,但并未遗留明显后遗症,总体病情相对平稳。提示干燥综合征合并中枢神经系统及肾脏受累时仍可得到较为良好的预后,积极的免疫抑制治疗有助于缓解症状、改善预后。
干燥综合征的中枢神经系统病变(CNS-SS)既往认为干燥综合征累及中枢神经系统少见。Coates等认为CNS-SS发生率几乎为零[6]。80年代Alexander等[7]报道 CNS-SS的发生率20% ~25%;据 Lafitte 和 Anaya 等[8,9]报道,干燥综合征患者累及中枢神经系统的比例在2.5%~60%。近10年对CNS-SS的深入研究显示,>30%干燥综合征患者伴中枢神经系统损害,多表现为弥散性、多部位损害,且累及脑、脊髓和视神经等部位不同而出现相应症状(表2)[10]。CNS-SS较常累及脊髓,多表现为急性横断性脊髓炎(反复发作)、慢性进行性脊髓病和神经源性膀胱等。累及视神经时即为视神经炎,通常在脊髓病的基础上出现,称为视神经脊髓炎,临床症状以视力下降和肢体瘫痪为主。目前认为视神经脊髓炎是针对水通道蛋白4产生特异性自身抗体所导致的自身免疫性疾病。本例患者也主要表现为视野缺失和脊髓病变,但受累更为广泛,同时合并颅内病变。

表2 干燥综合征患者中枢神经系统病变的分类
CNS-SS在病程早期,可自然缓解,随着病情发展,病变趋于反复发生、多灶性和慢性进展性,两次发作间期病情稳定。这一特点使其临床表现类似于多发性硬化。袁春云等[11]报告15例CNS-SS患者中3例临床表现为多发性硬化。杨美兰等[12]报告9例干燥综合征误诊为多发性硬化。Wang等[13]对12例诊断为多发性硬化的患者进一步进行干燥综合征评估,结果发现50%患者为干燥综合征,多发性硬化和部分CNS-SS患者的临床表现、实验室检查以及MRI特征相似,两者用激素均可缓解,如未进行干燥综合征相关检查,极有可能将其误诊为多发性硬化。目前人们认为,多发性硬化是代表一组临床综合征的诊断名词,并非均一的疾病,应积极搜寻原发病因,不能轻易诊断多发性硬化。因此本例应诊断为干燥综合征中枢神经系统损害而非多发性硬化。
CNS-SS的发病机制目前尚不完全明确,一般认为有以下几种机制参与其发病:(1)血管炎性损伤,主要见于多发性脑梗死、皮层下白质或脑室周围白质缺血性改变;(2)中枢神经系统脱髓鞘,主要表现为多发性硬化、视神经脊髓炎,其中部分由水通道蛋白4特异性自身抗体介导;(3)血管源性水肿,常表现为可逆性后部脑白质病变。另有报道表明,抗SSA抗体可能与中枢神经系统病变发病及病情严重程度有关,在CNS-SS患者中,抗SSA抗体阳性者较阴性者中枢神经系统病变更加严重和广泛;而抗磷脂抗体与中风、偏头痛、癫痫发作和横断性脊髓炎有关。本例患者SSA阳性,可能与其神经病变反复发作有关。
CNS-SS的治疗很大程度上是经验性治疗,至今尚无大规模的临床试验验证激素和其他免疫抑制剂的作用,一些研究结果表明,在激素基础上应用免疫抑制剂,大部分患者的病情可得以稳定和缓解。Govoni等[14]建议针对不同的临床特征决定不同的治疗方案。对于稳定自限性患者,可以不予治疗,继续观察。反之,当病情活动和进展时,可以给予激素治疗,对于激素不敏感的患者可加用免疫抑制剂。在免疫抑制剂中,环磷酰胺最常用。Delalande等[15]研究了73例接受泼尼松治疗的CNS-SS患者,29例(45%)患者病情得到长期稳定和缓解,13例患者完全无效(主要是多发性神经炎患者)。20例患者接受环磷酰胺(700 mg/m2)治疗6~12月后,92%合并脊髓病变和全部合并多发性单神经炎的患者病情稳定或部分缓解。对于难治性复发性CNS-SS患者,大剂量丙种球蛋白和血浆置换有效,神经系统症状可迅速缓解。本例患者每次神经系统病变复发,给予甲泼尼龙冲击均有效,似乎诱导治疗并不困难,也未遗留明显的并发症;但维持治疗疗效仍不令人满意。由于外周血白细胞持续低下,患者未用环磷酰胺而采用来氟米特维持治疗,虽然可长期稳定,但似乎仍不能避免其复发,其最佳的维持治疗方案仍有待前瞻性的临床研究指明方向。
远端肾小管酸中毒所致结石的治疗 远端肾小管酸中毒所致肾结石主要是磷酸钙结石,不同于普通人群肾结石以草酸钙最多见,其原因在于此类患者尿液呈碱性,促进磷酸钙结石形成。
目前认为,对于肾内结石,不需要手术清除或碎石,除非引起了梗阻、感染、严重出血或持续疼痛。非手术治疗方面,宜每日饮水2 000 ml以上,昼夜均匀,并将钠摄入量降至2.3 g/d以下,蛋白质摄入量为0.8~1.0 g/(kg·d),随机临床试验已证实上述措施可减少结石复发[16]。碳酸氢钠虽然可以纠正酸中毒,但加重钠负荷,导致尿钙排泄增加,不宜使用,建议患者长期口服枸橼酸钾。枸橼酸钾进入体内后迅速被代谢为碳酸氢根,可有效纠正酸中毒,减少骨骼中磷酸钙释放、从而减少了尿钙、磷排泄;此外枸橼酸是结石的天然抑制剂,可抑制钙盐结晶,有助于防治肾结石。本例服用枸橼酸制剂之前肾结石逐渐增多,接受枸橼酸治疗十年后复查结石较前无明显加重,提示枸橼酸预防结石有效,但对已形成的磷酸钙结石则较难溶解。
小结:本例患者病程长达20余年,以低钾软瘫起病,被诊断为“肾小管酸中毒”;此后反复发作肢体麻木伴肌力下降,当地医师又根据临床和影像学特点诊断为“多发性硬化”,据此治疗也均取得一定疗效。然而这两次诊断却都只触及皮毛,未把握到病情的本质——干燥综合征所致的肾脏和中枢神经系统病变。因此,对于临床表现为多发性硬化样病变和远端肾小管酸中毒的患者需进一步排查可能的病因,尤其应注意有无干燥综合征的可能性。此外,本例患者病初已有中枢神经系统和肾脏受累,双肾大量结石,但经过10年随访,肾小管功能较前改善,SCr持续正常,双肾结石和神经系统病变无明显进展,提示经过积极治疗,合并中枢神经系统和肾脏受累的干燥综合征患者仍可获得较好预后。
1 张 波,刘志红.干燥综合征伴肾小管酸中毒和多发性神经病变.肾脏病与透析肾移植杂志,2001,10(5),493-498.
2 徐 雁,崔丽英.多发性硬化与脑梗死影像学表现的鉴别诊断.中国实用内科杂志,2005,5(5):402-403.
3 曾小峰,吴 敏,李明佳,等.原发性干燥综合征死亡原因及相关因素分析.中华风湿病学杂志,1999,3(4):222-223.
4 Maripuri S,Grande JP,Osborn TG,et al.Renal involvement in p rimary Sj?gren's syndrome:a clinicopathologic study.Clin J Am Soc Nephrol,2009,4(9):1423-1431.
5 刘正钊,胡伟新,章海涛,等.原发性干燥综合征肾损害的临床病理特征及预后.肾脏病与透析肾移植杂志.2010,19(3),225-229,251.
6 Coates T,Slavotinek JP,Rischmueller M,et al.Cerebral white matter lesions in primarySjögren'ssyndrome: a controlled study.J Rheumatol,1999,26(6):1301-1305.
7 Alexander EL.Neurologic disease in Sjögren's syndrome:mononuclear inflammatory vasculopathy affecting central/peripheral nervous system and muscle.A clinical review and update of immunopathogenesis.Rheum Dis Clin North Am,1993,19(4):869-908.
8 Lafitte C,Amoura Z,Cacoub P,et al.Neurological complications of primary Sjögren's syndrome.J Neurol,2001,248(7):577-584.
9 Anaya JM,Villa LA,Restrepo L,et al.Central nervous system compromise in primary Sjögren's syndrome.J Clin Rheumatol,2002,8(4):189-196.
10费允云,吴 迪,张奉春.原发性干燥综合征的中枢神经系统病变.中华全科医师杂志,2006,5(2):102-104.
11袁春云,李蜀渝,肖 波,等.原发性干燥综合征神经系统损害21例临床分析.国际神经病学神经外科学杂志,2010,1,9-11.
12杨美兰,李 涛,刘 云,等.原发性干燥综合征误诊9例分析.中国误诊学杂志,2009,9(3),616-617.
13 Wang YJ,Tsai KY,Fuh JL,et al.High frequency of primary Sjogren's syndrome in taiwanese patient presenting as relapsing remitting multiple sclerosis.Eur Neurol,2004,51(1):21-25.
14 Govoni M,Padovan M,Rizzo N,et al.CNS involvement in primary sjögren's syndrome:prevalence,clinical aspects,diagnostic assessment and therapeutic approach.CNS Drugs,2001,15(8):597-607.
15 Delalande S,de Seze J,Fauchais AL,et al.Neurologic manifestations in primary sjögren syndrome:a study of 82 patients.Medicine(Baltimore),2004,83(5):280-291.
16 Worcester EM,Coe FL.Clinical practice.Calcium kidney stones.N Engl J Med,2010,363(10):954-963.

