他克莫司治疗Alport综合征的近期疗效
姚小丹 陈 欣 黄高渊 许书添 黄 倩 曾彩虹 陈惠萍 胡伟新 刘志红
Alport综合征(Alport syndrome,AS)临床治疗目前仍具挑战,文献报道的治疗方法包括血管紧张素转换酶抑制剂(ACEI)或(和)血管紧张素II受体拮抗剂(ARB)、钙调神经蛋白磷酸酶抑制剂环孢素A(CsA)等,其中CsA治疗AS患者的近期及远期疗效最引人注目[1]。而另一钙调神经蛋白抑制剂——他克莫司(tacrolimus,FK506)治疗 AS仍未见报道。本研究前瞻性观察5例FK506治疗的AS患者的近期疗效与不良反应。
对象和方法
病例选择 5例患者均经肾活检确诊为AS,符合Flinter诊断标准[2],近期均出现蛋白尿增加(>1g/24h)及低白蛋白血症加重(血清白蛋白<35 g/L)。5例患者中X连锁遗传(XLAS)4例,常染色体隐性遗传(ARAS)1例;男4例,女1例;年龄8~42岁(2例<12岁)。全部患者确诊后均随访1年以上,虽接受ACEI、ARB或(和)中成药治疗,但临床疗效不佳,其中1例ARAS患者曾接受短期CsA治疗亦无效。进入本研究前,所有患者血清肌酐(SCr)正常( <110.5 μmol/L),MDRD 公式计算的肾小球滤过率(eGFR) >90 ml/(min·1.73m2),且均无糖代谢异常、潜在感染及肿瘤等疾病。
实验室检查 全部患者均行(1)尿液检查:24h尿蛋白定量,尿沉渣红细胞计数,尿NAG酶。治疗前及治疗后每4周复查一次。(2)血生化检查:血清白蛋白、前白蛋白、SCr、血尿酸、胆固醇、三酰甘油、空腹血糖等。治疗前及治疗后每4周复查一次。(3)FK506血药浓度及CYP3A5基因型检测:治疗前或治疗第1周检查FK506谷浓度及CYP3A5基因型,CYP3A5基因型检测结果用于指导FK506的药物治疗剂量[3]。
肾活检及皮肤活检 全部患者曾行肾活检或(和)皮肤活检[4]。肾活检病理包括光镜检查、免疫荧光检查、电镜检查及Ⅳ胶原分子亚链(α3和α5链)单克隆抗体染色[5]。
治疗方案 均在患者既往治疗的基础上加用FK506(Astellas Ireland C,Ltd Killorglin,Co Kerey,Ireland),疗程12周。开始治疗时FK506剂量为0.15 mg/(kg·d),目标 FK506 谷浓度5 ~8 ng/dl,治疗8周后减至0.1 mg/(kg·d)。12周内每4周监测血药浓度1次,并根据血药浓度调整药物剂量,观察其临床疗效及不良反应。
疗效判断 完全缓解:治疗后蛋白尿<0.4g/24h且血清白蛋白水平恢复至正常范围;有效:治疗后蛋白尿下降幅度>50%和(或)血清白蛋白升高或达正常范围;无效:治疗8周后蛋白尿加重或低白蛋白血症加重。
安全性判断 治疗过程中出现空腹与餐后血糖升高、血压升高(>140/90 mmHg)、皮疹、神经系统症状、腹部症状、便秘或腹泻等临床症状,或无诱因SCr水平较治疗前升高>30%视为药物不良反应。
由于本组样本量小,不作统计学显著性分析。
结 果
一般资料及临床特征 5例患者进入研究前均已进展为中~大量蛋白尿且合并低白蛋白血症,但eGFR >90 ml/(min·1.73m2),SCr水平在正常范围,1例成年ARAS患者伴有高血压,长期采用ACEI治疗,肾小管损害指标无明显改变(表1)。
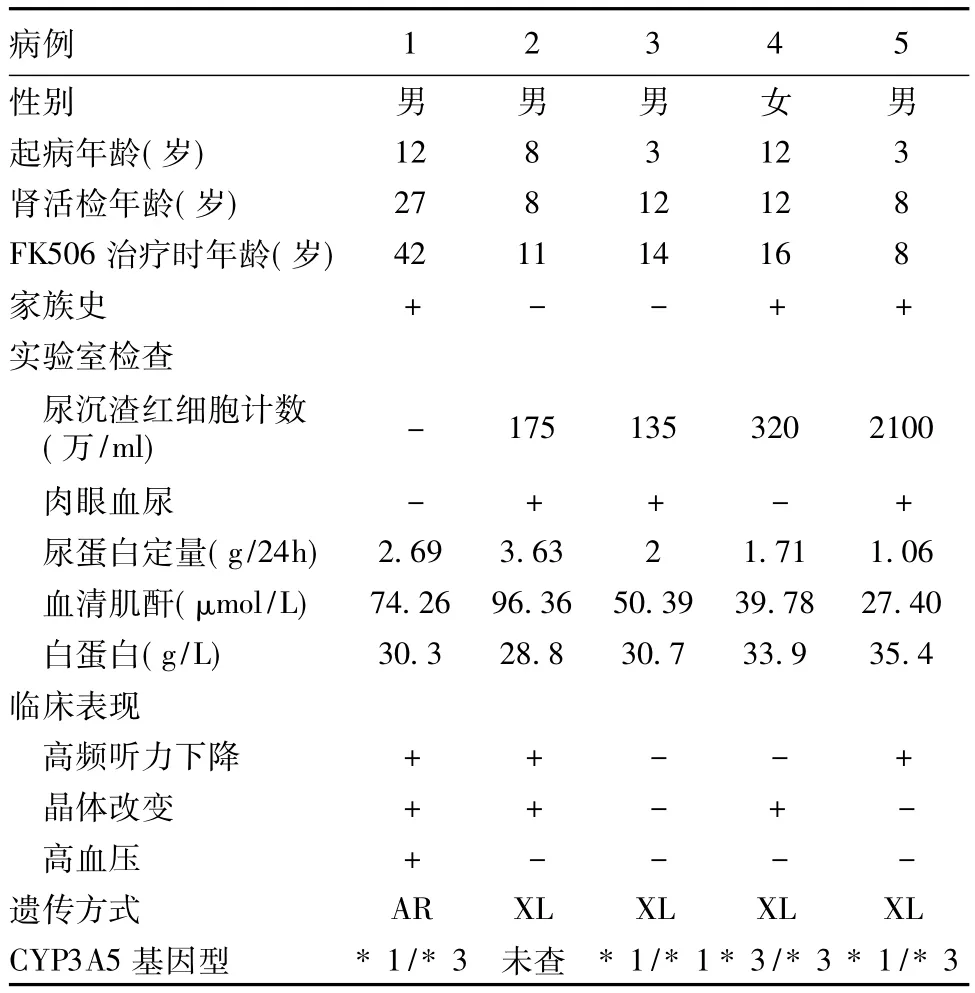
表1 5例Alport综合征患者的一般资料
FK506疗效 FK506治疗后所有患者血清白蛋白水平均较前改善且达正常范围(>35 g/L),蛋白尿亦较治疗前有所下降,起效时间在治疗后4~8周,其中下降幅度>50%者3例,但呈现明显波动的特征,且与血清白蛋白的变化不平行。镜下血尿有加重趋势,血脂、血尿酸水平无明显改善(图1,表2)。

图1 FK506治疗Alport综合征患者的主要指标变化
不良反应及处理 FK506治疗的不良反应主要包括肾功能损害、糖代谢异常、腹泻腹痛等(表3),其中2例SCr升高≥30%,1例在药物减量后肾功能恢复,另1例停药后随访6个月SCr仍未降至治疗前水平。
讨 论
虽然AS的遗传基因得以定位与克隆,发生机制亦较明确,但其临床治疗方法及疗效并不能令人满意。由于AS发病率较低,国内外均未见具说服力的随机对照性临床研究,仅见个案报道或小样本的非对照性研究[6,7],其中治疗方案涉及 ACEI、中药雷公藤[8]及钙调神经蛋白磷酸酶抑制剂CsA。值得注意的是Callis等[8]对CsA治疗AS近期与远期疗效的报道,8例AS患者口服CsA治疗,长期随访7~10年,在控制蛋白尿与保持长期肾功能稳定方面均取得显著疗效,与同家族未用CsA治疗的患者相比,前者的长期预后显著优于后者。最近来自德国的研究中,8例(8/9)AS患者在CsA治疗1~6月后尿蛋白排泄减少并伴有血清白蛋白水平轻度改善,但4例(4/9)患者终止研究(1例无效,2例肾功能损害及1例自行要求退出),3例患者重复肾活检可见CsA肾毒性的病理改变[9]。
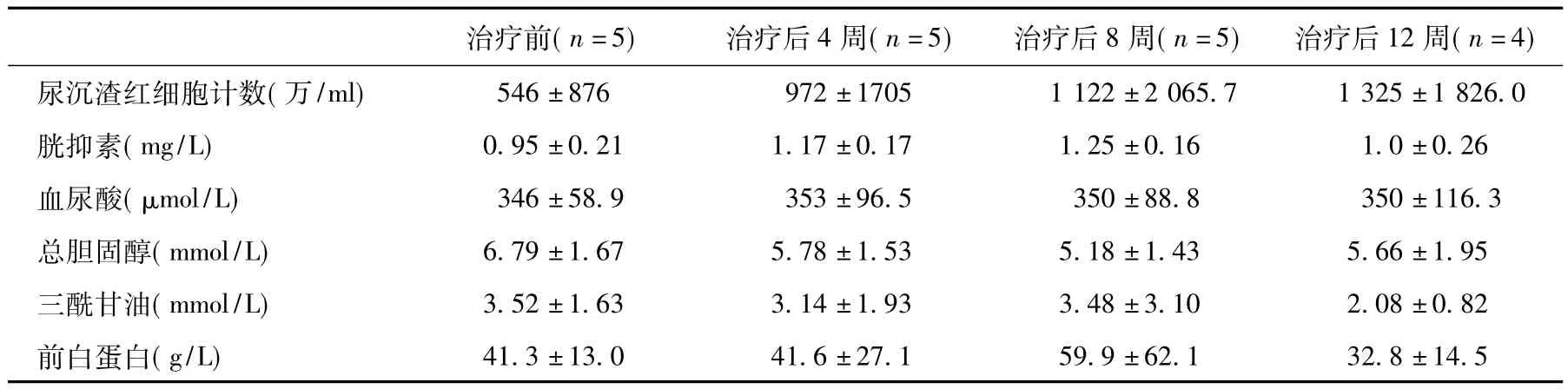
表2 FK506治疗后Alport综合征患者的其他指标变化

表3 FK506治疗的不良反应
本文前瞻性观察的5例患者均在本研究所专病门诊长期随访,曾接受ACEI、中成药或CsA治疗无效,且蛋白尿、低白蛋白血症近期出现加重趋势,但SCr水平仍保持于正常范围。采用FK506治疗后,5例患者蛋白尿及血清白蛋白水平最显著的改善均发生于4~8周,而8周后24h尿蛋白定量及血清白蛋白水平并无进一步改善。2例患者在延长治疗时间后亦未发生完全缓解。另2例患者在治疗第6周和第8周出现药物肾毒性及其他不良反应,减少FK506剂量后,药物相关不良反应消失。
FK506治疗起始剂量与目标血药浓度均借鉴器官移植及原发性肾病综合征的治疗诱导剂量,鉴于这类患者服药后发生肾毒性等不良反应可能性较大,治疗前均行CYP3A5基因型检测以判断FK506药代动力学特征并指导安全用药,起始剂量维持治疗8周,未达文献中CsA起始剂量治疗6个月的疗程。该设计可能减少长时间高药物浓度导致的肾毒性及神经系统与消化系统的不良反应[10],但亦可能造成疗程不足。其中1例CYP3A5-*1/*1型的AS患者血药浓度在加大用药剂量后仍不能达到有效治疗窗范围,且蛋白尿呈进行性加重趋势,因治疗无效而退出观察。
FK506治疗AS所获得部分疗效的机制尚不能充分阐述。与CsA同属于钙调神经蛋白磷酸酶抑制剂的FK506,在治疗原发性足细胞病(微小病变,特发性膜性肾病)及遗传性疾病所引起的足细胞病(AS与WT1突变相关的家族性FSGS)的作用机制亦不完全等同[11],其更可能通过改善足细胞的骨桥蛋白而减少蛋白尿。这可能与中药雷公藤多苷治疗各类足细胞病的机制有共同之处[12,13]。
本研究发现患者接受FK506治疗后,尿蛋白的变化并不完全与血清白蛋白水平的变化同步。这一现象也见于接受其他治疗的AS患者及接受FK506治疗的其他肾炎患者(如狼疮性肾炎,膜性肾病)。体外研究表明,FK506不能促进肝细胞分泌白蛋白,但能够明显减轻白细胞介素6对肝细胞分泌白蛋白的抑制,对肝细胞可能具有一定的保护作用[14]。
总之,目前AS仍无疗效肯定的方法,FK506治疗可在近期减少蛋白尿并改善低蛋白血症,儿童患者疗效可能优于成年患者,成年患者发生不良反应的机率也可能较高。延长治疗时间能否进一步提高长期疗效尚有待进一步观察证实。
1 Callis L,Vila A,Carrera M,et al.Long-term effects of cyclosporine A in Alport's syndrome.Kidney Int,1999,55(3):1051-1056.
2 姚小丹.泛谈Alport综合征诊断中存在的问题.肾脏病与透析肾移植杂志,2010,4(19):347-349.
3 陈劲松,黎磊石,唐 政,等.CYP3A5基因型对肾移植术后他克莫司血药浓度及疗效的影响.肾脏病与透析肾移植杂志,2008,17(1):4-8.
4 陈惠萍,曾彩虹.遗传性肾炎.肾脏病与透析肾移植杂志,1998,(3):288-291.
5 Wei G,Zhihong L,Huiping C,et al.Spectrum of clinical features and type IV collagen alpha-chain distribution in Chinese patients with Alport syndrome.Nephrol Dial Transplant,2006,21(11):3146-3154.
6 Chen D,Jefferson B,Harvey SJ,et al.Cyclosporine a slows the progressive renal disease of alport syndrome(X-linked hereditary nephritis):results from a canine model.J Am Soc Nephrol,2003,14(3):690-698.
7 Sigmundsson TS,Palsson R,Hardarson S,et al.Resolution of proteinuria in a patient with X-linked Alport syndrome treated with cyclosporine.Scand J Urol Nephrol,2006,40(6):522-525.
8 Li JG,Ding J,Wang F,et al.Drugs controlling proteinuria of patients with Alport syndrome.World J Pediatr,2009,5(4):308-311.
9 Massella L,Muda AO,Legato A,et al.Cyclosporine A treatment in patients with Alport syndrome:a single-center experience.Pediatr Nephrol,2010,25(7):1269-1275.
10 Kuypers DR,Naesens M,de Jonge H,et al.Tacrolimus dose requirementsand CYP3A5 genotype and the developmentof calcineurin inhibitor-associated nephrotoxicity in renalallograft recipients.Ther Drug Monit,2010,32(4):394-404.
11 Bensman A,Niaudet P.Non-immunologic mechanisms of calcineurin inhibitors explain its antiproteinuric effects in genetic glomerulopathies.Pediatr Nephrol,2010,25(7):1197-1199.
12 Chen ZH,Qin WS,Zeng CH,et al.Triptolide reduces proteinuria in experimental membranous nephropathy and protects against C5b-9-induced podocyte injury in vitro.Kidney Int,2010,77(11):974-988.
13 Zheng CX,Chen ZH,Zeng CH,et al.Triptolide protects podocytes from puromycin aminonucleoside induced injury in vivo and in vitro.Kidney Int,2008,74(5):596-612.
14 Li Y,Liu FY,Liu ZH,et al.Effect of tacrolimus and cyclosporine A on suppression ofalbumin secretion induced by inflammatory cytokines in cultured human hepatocytes.Inflamm Res,2006,55(5):216-220.

