以血管内皮生长因子及其受体为药靶的抗肿瘤药物的研究进展
李红,李岳,王兰,李亚,潘克俭*
(1.成都医学院,四川 成都 610083;2.成都康弘生物科技有限公司,四川 成都 610036)
对肿瘤生长来说,建立足够的血管系统以提供氧气和营养是一个必需的过程。肿瘤血管系统的建立,依赖于体内促血管生成类因子诱导的新生毛细血管的出芽和生长[1]。Folkman[2]在1971年提出实体肿瘤的生长和转移依赖于新生血管生成(angiogenesis)这一观点,并认为抗新生血管生成疗法(anti-angiogenesis)将成为一种有效的肿瘤治疗方法[2]。虽然在随后的10余年内该观点并未受到足够重视,但后来由于碱性成纤维细胞生长因子(bFGF)和血管内皮生长因子(VEGF)等发现以及新生血管染色技术的发展,用抗新生血管生成来抑制肿瘤生长和转移成为近年来研究的热点,Folkman的理论也被众多的实验所证实[3,4]。
VEGF由Ferrara等人于1989年首次从牛垂体滤泡星状细胞培养基中分离得到。VEGF可特异地结合于血管内皮细胞,促进其增生形成新生血管,且能增强血管通透性。VEGF被认为是专一、有效的刺激内皮细胞增生的因子,它还具有增加血管通透性、趋化血管内皮细胞等功能。以上这些功能的实现是依赖于VEGF与它在内皮细胞膜上的受体结合后完成[5]。近年来关于VEGF及其受体(VEGFR)与肿瘤生长、转移的关系,以及在将之作为靶分子进行的抗新生血管治疗肿瘤新药开发等方面,均取得较大的进展,目前已有数个药物经FDA批准上市。本文就VEGF及其受体在抗肿瘤血管生成治疗中的作用和研究进展作一概述。
1 以VEGF/VEGFR为靶标开发抗肿瘤药物的研究概况
VEGF及其受体在肿瘤生长和转移过程中起关键性的作用。以VEGF或其受体为靶向的治疗方式,有以下优势:1)已证实多种肿瘤细胞高表达VEGF,以VEGF为靶向,可达到广谱抗肿瘤效果并且毒副作用小;2)血管内皮细胞为二倍体细胞,遗传性稳定,耐药性小;3)药物容易到达和进入血管内皮细胞;4)容易通过非细胞毒性治疗达到目的[6]。目前已有不少以VEGF及其受体为药靶的抗肿瘤药物的研究,并且取得了不错的效果,有超过70多种候选药物已经被批准进入临床试验,其中7种药品已被美国FDA批准生产上市。现有可选择性作用于VEGF/VEGFR的药物,已进入临床试验阶段和已被批准上市的药物(表1)。这些药物均显示了一定的疗效,可以预见在不久的将来有更多的药物会进入临床试验阶段,或通过FDA审批,正式进入临床治疗。以下就对这些治疗方法做一概述。
1.1 抗体治疗
对肿瘤的抗体治疗研究已进行多年,目前有18种商业化抗体已应用于临床肿瘤治疗,例如治疗乳腺癌的人源化单抗 Herceptin(抗 HER-2)、治疗淋巴细胞瘤的Rituxan(抗CD20)和治疗急性髓细胞白血病的Mylotarg(抗CD33)等,均已通过FDA审查。由Genentech公司开发的针对VEGF-A的单抗Avastin已在2003年完成了Ⅲ期临床试验,并获得了FDA批准正式进入临床用于治疗直肠肿瘤、非小细胞肺癌、Her2阴性乳腺癌和肾癌[7,8]及复发性胶质母细胞瘤。Avastin是一人源化抗体(93%人源,7%鼠源),功能区为Fab段,可选择性识别VEGF-A的各类衍生物,但不识别VEGF的其它家族分子如VEGF-B、C等,在临床试验中未发现患者体内有抗-Avastin抗体生成,并取得较好的疗效。而针对VEGFR-2的单抗如DC101,已在动物实验中取得了初步的验证,但由于DC101选择性识别的VEGFR-2是小鼠分子Flk-1,而与人类同源分子KDR并无交叉反应,因此不能直接用于临床试验。但上述实验结果可以给人类肿瘤治疗提供一个有意义的参考,例如设计针对人类KDR分子的人源化单抗等。ImClone公司开发的抗VEGFR-2单克隆抗体,已进入Ⅲ期临床试验阶段[9]。至于选择何种靶标效果更好,是针对VEGF还是VEGFR,目前尚无定论。但有研究表明,在动物实验中,Avastin达到90%抑瘤效果的剂量只需要0.1~0.5mg/kg,而DC101却需要20~30mg/kg,其原因可能是由于仅抑制VEGFR-2并不能完全控制新生血管的生长,因为一些重要功能还通过VEGFR-1介导。
1.2 小分子蛋白激酶抑制剂
可选择性抑制VEGF及其受体酪氨酸蛋白激酶(RTK)活性的小分子合成类药物,是近年来研究的热点,许多公司都投入了大量资金进行开发。辉瑞公司开发的SU11248(Sutent),是一类小分子RTK抑制剂,目前被批准治疗肾细胞癌[10],其机理是作用于 VEGFR-1,2,3、RET 和 CSF-1。例如血小板衍生生长因子β(PDGFβ),Flt-3和C-kit配体。Ⅲ期临床试验结果显示,该药物可延缓对诺华公司抗癌药伊马替尼(imatinib)常规治疗无效或不能耐受的胃肠道间质瘤患者的肿瘤进程6.3个月,而对照组仅为1.5个月,与对照组相比Sutent组可以减少死亡率50%[11]。由Byer/Onxy公司开发的Bay 43-9006本是一类RAF激酶抑制剂,后来发现还有较强的VEGFRs的RTK抑制活性和下调Mcl-1蛋白,能够通过阻断胞内信号传导、促进肿瘤细胞凋亡和抑制肿瘤新生血管生成而发挥抗肿瘤作用。该药物商品名又为Nexavar(Sorafenib),为首个口服激酶抑制类药物,已通过FDA审查正式上市,治疗肾细胞癌[12]与肝癌[13]。SU5416是一种类醌类衍生物,为Sugen公司(后被辉瑞公司收购)开发的一种合成的VEGFR蛋白激酶抑制剂,它能结合在腺嘌呤结合袋中而使Flk-1/KDR失活。SU5416是第一个取得临床试验的抗血管小分子抑制剂,临床前试验显示了较好的抗血管生成和肿瘤抑制效果[14];但SU5416在随后的Ⅲ期临床试验中并未显示出明确的疗效,未获得FDA批准。SU6668也是Sugen公司开发的一种小分子RTK抑制剂,但在I期临床试验中由于毒副作用过大而被中止[15]。PKT787是Novartis公司合成的另外一种小分子化合物,能强有力的抑制VEGFR1/R2受体酪氨酸激酶,在更高一些浓度时还能抑制PDGFR-β酪氨酸激酶、c-Kit和c-Fms等。目前PKT787正在进行转移性结直肠癌的Ⅲ期临床试验[16]。目前也通过FDA审批的抑制新生血管生成的小分子药物还有ZD6474,由AstraZeneca公司开发,为口服的RTK抑制剂,选择性的作用于VEGFR1/2,继而抑制新生血管从而达到抗肿瘤效应[17]。
1.3 核酸治疗
核酸治疗即利用核酶、脱氧核酶、反义核苷酸或RNA干扰来阻断VEGF或其受体分子的转录或翻译。核酶是一种RNA分子,它既有RNA特异性序列识别功能,又有位点特异性切割其他RNA分子的功能。反义核苷酸是指能够与mRNA互补配对的单链DNA或RNA片断,通常为13~25碱基对(bp),在转录和翻译水平上可阻止蛋白质的合成,加速mRNA的降解,具有抑制靶基因表达的作用。RNAi是一种高效的特异性强的基因阻断技术,近年来发展迅速,很快就成为功能基因组研究的有力工具。通过实验手段将dsRNA分子导入细胞内,特异性地降解细胞内与其序列同源的mRNA,封闭内源性基因表达。Pavco等[18]用针对Flk-1mRNA的核酶观察了在小鼠Lewis肺癌模型中的抗肿瘤作用,发现它能明显抑制肿瘤的生长。Zhang等[19]合成了一种能消化Flk-1mRNA底物的脱氧核酶,可在体外抑制牛主动脉内皮细胞Flk-1mRNA的表达,并抑制裸鼠体内乳腺癌细胞的新生血管生成及肿瘤生长。Bernatchez等[20]则合成了针对Flk-1的反义核苷酸,能抑制VEGF介导的内皮细胞增殖和迁移。目前已有反义核苷酸制剂如ISIS3521(特异性抑制蛋白激酶C)和ISIS5132(特异性抑制c-raf激酶)进入肿瘤治疗临床试验Ⅱ期[21,22]。以 RNAi为基础治疗AMD的Bevasiranib(美国费城Acuity制药公司)能够关闭血管内皮生长因子(VEGF)基因,能够减缓眼睛中血管的生长并改善视力,而且试验中除了药物注射位置的红肿外,没有观察到其他任何副作用。第II期临床试验结果将于今年9月揭晓。此外,Intradigm公司的ICS-283RNA干扰疗法目前正处于临床前研究阶段,期望用于结肠直肠癌的一线治疗并拓展到其他的肿瘤治疗中。
1.4 可溶性VEGFR及VEGF异构体治疗
可溶性受体是指分泌到胞外的、只含有受体胞外部分的片段,它保持有同配体结合的能力,但是由于没有胞内的激酶活性区,因此不能进行信号传导,对正常的信号传导起负调节作用。1993年Kendall等报道了一种 Flt-1的天然突变物sFlt-1(soluble Flt-1),它 只 含 有 Flt-1 胞 外 段 N 端 6 个 区 的 片段[23]。sFlt-1可以同天然的 Flt-1或 Flk-1受体形异二聚体并抑制它们介导的信号传导,因此认为这种现象是一种天然的调节VEGFR功能的机制。设计和得到可溶性VEGFR的方法有以下几种:直接用重组的方法获得可溶性的VEGFR,从VEGFR上筛选出能与VEGF相结合的肽段,或者根据噬菌体文库筛选的VEGF表位肽序列、并用人工方法进行合成,等等。也有研究者设计出基于VEGF的异二聚体,其一端的受体结合区域被突变,而另一端的仍然保留;它能同受体结合,但不能介导受体二聚化和以后的信号传导。Lu等[24]最近用重组的方法,将Flt-1单抗的可变区和KDR单抗的可变区重组成一个双特异性的二价单链抗体二聚体。它既能和Flt-1结合,又能和KDR结合,并能阻断它们同配体的结合。这种二聚体更为强有力的抑制VEGF的内皮细胞增殖功能。还有研究者在VEGF上后脸接白喉毒素或志贺氏菌毒素,称可以选择性的抑制VEGFR和肿瘤生长[25]。但上述研究都还停留在动物实验阶段,目前未见有进一步临床试验的报道。VEGF-trap是Regeneron公司开发的一种可溶性类似抗体结构的融合蛋白,是将人VEGF受体Flt-1和KDR的细胞外结构域的一部分融合到人免疫球蛋白G的Fc片断上,可特异性的捕获体内VEGF分子,阻断其与VEGFR的结合,从而抑制新生血管的形成。研究者称这种融合蛋白拥有比抗体如Avastin更高的亲和力。目前,该药物已进入临床试验 Ⅲ 期[17]。 国 内 与 VEGF-trap 结 构 类 似 的KH903亦是一种抗体融合蛋白,可高效特异地阻断VEGF与受体的结合,目前已被sFDA批准进入临床I期。
1.5 疫苗诱导主动免疫治疗
肿瘤疫苗主要分为DNA疫苗、蛋白质疫苗、肽疫苗、DC细胞疫苗以及重组腺病毒疫苗等。由于VEGF及其受体在肿瘤生长过程中的重要性,开发针对VEGF及其受体的疫苗也是肿瘤治疗研究的一个方向。Li等[26]用可溶性的Flk-1和DC细胞混合孵育,制备出DC-Flk-1细胞疫苗,体内实验显示该疫苗能抑制多种肿瘤的转移,并能激发小鼠机体产生针对VEGFR的CTL反应。另有研究者将携带Flk-1基因的真核表达载体转化减毒的伤寒杆菌,制成口服DNA疫苗免疫小鼠,可观察到针对Flk-1阳性表达细胞的CTL反应,并能抑制肿瘤在体内的生长和转移[27]。由于自身免疫反应的强度不易控制,以及实际的VEGF/VEGFR抑制效果的稳定性有待提高,因此这个领域的研究尚未进入临床试验阶段。
2 抗VEGF治疗面临的问题和挑战
VEGF治疗肿瘤耐药性问题近年越来越突出,而且缺乏有效的敏感患者筛选预测指标。对于耐药机制的研究,原因可能与肿瘤旁分泌的促炎症因子募集CD11b+髓系细胞及自分泌因子诱导上皮细胞向间充质细胞的转变[28,29]。为此,FDA新批准雷帕霉素靶体(the mammalian target of rapam-ycin,mTOR)特异性抑制剂everolimus(Afinitor;诺华制药公司)用于 VEGFR激酶抑制剂(sorafenib,sunitinib)治疗耐药的肿瘤患者[30]。此外,安全性问题亦不容忽视,如形成血栓、出血、生殖功能障碍、伤口愈合延迟及剂量相关性3~4级的高血压[31,32]等多种毒副作用。其中,高血压的发生机制尚不确定,有3个相关学说:(1)NO学说;(2)肾脏损伤学说;
(3)先兆子痫样学说[33]。
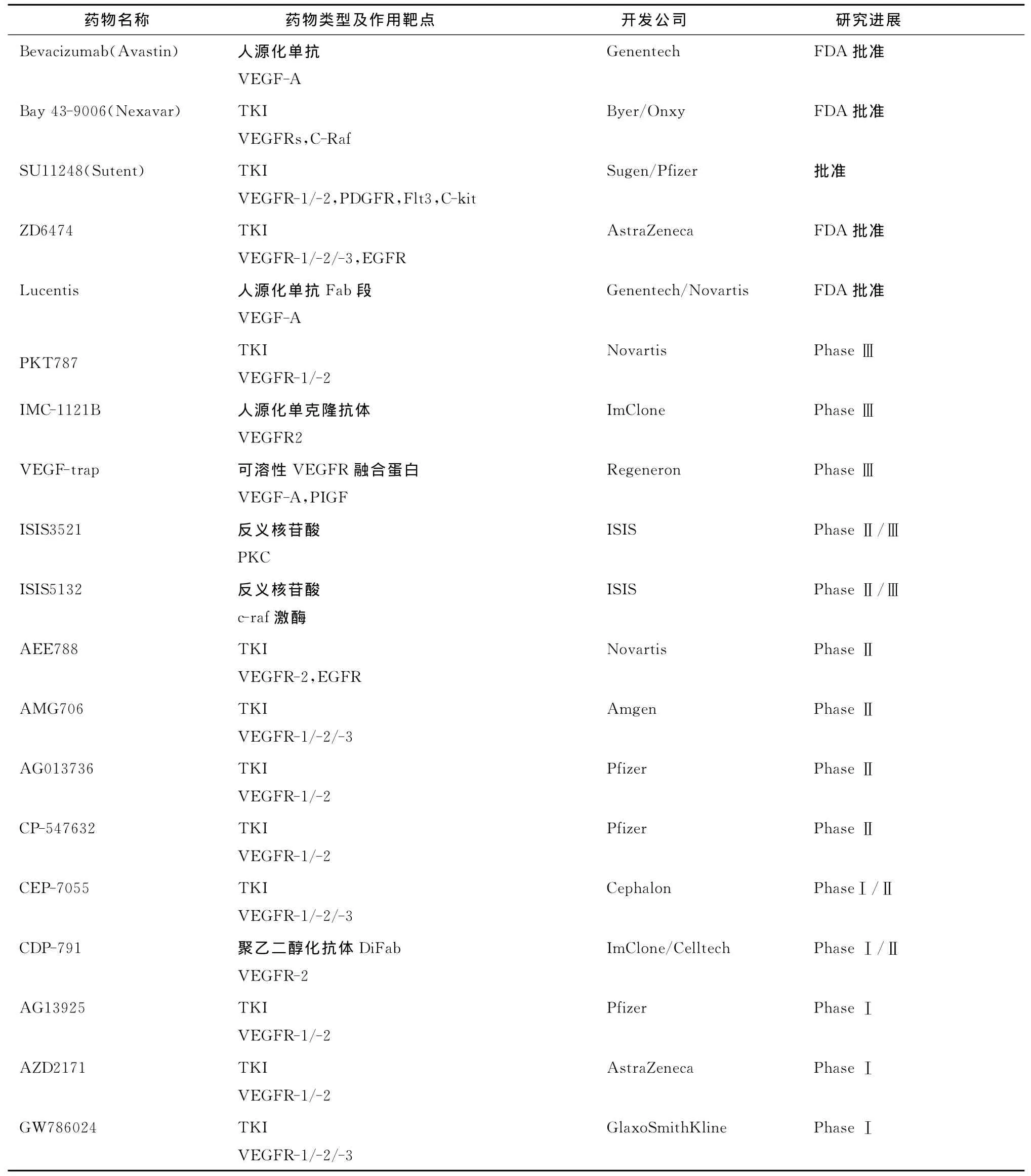
表1 作用于VEGF及其受体的药物及其试验进展Tab.1 Drugs targeting on VEGF signal pathway
3 结论和展望
对于新生血管形成在各类病理过程中所起的作用,特别是对肿瘤生长促进的作用,目前已无较大争议,因此寻找抑制新生血管生成的分子或药物成为目前研究的热点。以VEGF家族及其相应受体作为靶分子的药物目前正在进行大规模的研究,并取得了较好的效果。值得关注的是几种已通过FDA审批的药物,如作用于 VEGF-A的单克隆抗体Avastin、作用于VEGF165的反义核苷酸类药物Macugen以及几种小分子酪氨酸激酶抑制剂如ZD6474和SU11248(Sutent),等等。比较有潜力的研究领域是利用可溶性VEGFR及其衍生的融合蛋白,通过类似抗体的机制中和VEGF,从而达到抑制VEGF活性的作用。比较有代表性的药物是VEGF-trap,目前已经进入了Ⅲ期临床试验阶段,据称该类药物相对于抗体拥有更高的选择性和亲和力。
另外,抗血管生成治疗和常规的放、化学治疗相结合的联合治疗,也是目前研究的热点之一。大多数研究者都认为,常规治疗与抗血管生成治疗的联用可达到比单一药物更好的效果,但其机理目前尚无定论。可能的解释是肿瘤内新生血管具有血管走向扭曲、内径大小不一、结构紊乱等特征,可导致灌流不足、引起瘤内缺氧,刺激VEGF的生成。而抗VEGF/VEGFR治疗可修剪多余的不成熟的新生血管,重建肿瘤内紊乱的血管生长结构,从而改善血液灌流,减少由于负反馈引起的VEGF增多并增加其它药物到达肿瘤细胞的机会。但值得注意的是联合治疗并不一定增加疗效,如 Kuenen等[34]将SU5416同顺铂、健择的联合应用时,发生了严重的血管栓塞性病变,应引起重视。因此抗血管生成治疗和常规治疗联用的方式,还需进一步的临床试验结果支持,并进行更深入的机理探讨。
在研究中还需认识到,由于VEGF/VEGFR在其他一些生理和病理过程中也发挥了重要作用,如胚胎发育、视网膜病变、风湿性关节炎、宫内膜异位症等,因此针对VEGF及其受体的抗新生血管治疗同样适用于这些疾病。例如在老年性黄斑变性的治疗研究中,抗新生血管是目前研究的热点。有多种该类型药物如Lucentis已进入临床试验阶段,反义核酸类药物Macugen已经上市。随着对VEGF及其受体研究的深入,针对该领域的研究和相关药物的开发将会进入一个快速发展的阶段。
[1]Holash J,Maisonpierre PC,Compton D,et al.Vessel cooption,regression,and growth in tumors mediated by angiopoietins and VEGF[J].Science,1999,284(5422):1994-1998.
[2]Folkman J.Tumor angiogenesis:therapeutic implications[J].N Eng J Med,1971,285(21):41182-41186.
[3]Leung DW,Cachianes G,Kuang WJ,et al.Vascular endothelial growth factor is a secreted angiogenic mitogen[J].Science,1989,246(4935):1306-1309.
[4]Ferrara N.Role of vascular endothelial growth factor in physiologic and pathologic angiogenesis:therapeutic implications[J].Semin Oncol,2002,29(6Suppl 16):S10-14.
[5]Ferrara N,Davis-Smyth T.The biology of vascular endothelial growth factor[J].Endocr Rev,1997,18:24-25.
[6]Napoleone Ferrara.VEGF as a therapeutic target in cancer[J].Oncology,2005,69(Suppl 3):S11-16.
[7]McDermott DF GD.Bevacizumab as a treatment option in advanced renal cell carcinoma:an analysis and interpretation of clinical trial data[J].Cancer Treat Rev,2010,36(3):216-223.
[8]Miller KWM,Gralow J.Paclitaxel plus bevacizumab versus paclitaxel alone for metastatic breast cancer[J].N Engl J Med,2007,357(26):2666-2676.
[9]Jennifer L,Spratlin RBC,Matthew E,et al.Gail Eckhardt phase I pharmacologic and biologic study of ramucirumab(IMC-1121B),a fully human immunoglobulin G1monoclonal antibody targeting the vascular endothelial growth factor receptor-2[J].J Clin Oncol,2010,28(5):780-787.
[10]Motzer RJ HT,Tomczak P.Sunitinib versus interferon alfa in metastatic renal-cell carcinoma[J].N Engl J Med,2007,356(2):115-124.
[11]Smith JK,Mamoon NM,Duhe RJ.Emerging roles of targeted small molecule protein-tyrosine kinase inhibitors in cancer therapy[J].Oncol Res,2004,14(4-5):175-225.
[12]Escudier BET,Stadler WM.Sorafenib in advanced clear-cell renal cell carcinoma[J].N Engl J Med,2007,356(2):125-134.
[13]Llovet JM RS,Mazzaferro V.Sorafenib in advanced hepatocellular carcinoma[J].N Engl J Med,2008,359(4):378-390.
[14]Mendel DB,Schreck RE,West DC,et al.The angiogenesis inhibitor SU5416has long-lasting effects on vascular endothelial growth factor receptor phosphorylation and function[J].Clin Cancer Res,2000,6(12):4848-4858.
[15]Garber K.Angiogenesis inhibitors suffer new setback[J].Nature Biotechnol,2002,20(11):1067-1068.
[16]Mross K,Drevs J,Muller M,et al.Phase I clinical and pharmacokinetic study of PTK/ZK,a multiple VEGF receptor inhibitor,in patients with liver metastases from solid tumours[J].Eur J Cancer,2005,41(9):1291-1299.
[17]Ferrara N,Hillan KJ,Gerber HP,et al.Discovery and developoment of bevacizumab,an anti-VEGF antibody for treating cancer[J].Nat Rev Drug Dis,2004,3(5):391-340.
[18]Pavco PA,Bouhana KS,Gallegos AM,et al.Antitumor and antimetastatic activity of ribozymes targeting the messenger RNA of vascular endothelial growth factor receptors[J].Clin Cancer Res,2000,6(5):2094-2103.
[19]Zhang L,Gasper WJ,Stass SA,et al.Angiogenic inhibition mediated by a DNAzyme that targets vascular endothelial growth factor receptor 2[J].Cancer Res,2002,62(19):5463-5469.
[20]Bernatchez PN,Soker S,Sirois MG.Vascular endothelial growth factor effect on endothelial cell proliferation,migration,and platelet-activating factor synthesis is Flk-1-dependent[J].J Biol Chem,1999,274(43):31047-31054.
[21]Advani R,Lum BL,Fisher GA,et al.A phase I trial of aprinocarsen(ISIS 3521/LY900003),an antisense inhibitor of protein kinase C-alpha administered as a 24-hour weekly infusion schedule in patients with advanced cancer[J].Invest New Drugs,2005,23(5):467-477.
[22]Oza AM,Elit L,Swenerton K,et al.Phase II study of CGP 69846A(ISIS 5132)in recurrent epithelial ovarian cancer:an NCIC clinical trials group study[J].Gynecol Oncol,2003,89(1):129-133.
[23]Kendall RL,Thomas KA.Inhibition of vascular endothelial cell growth factor activity by an endogenously encoded soluble receptor[J].Proc Natl Acad Sci USA,1993,90(22):10705-10709.
[24]Lu D,Jimenez X,Zhang H,et al.Complete inhibition of vascular endothelial growth factor(VEGF)activities with a bifunctional diabody directed against both VEGF kinase receptors,fms-like tyrosine kinase receptor and kinase insert domain-containing receptor[J].Cancer Res,2001,61(19):7002-7008.
[25]Backer MV,Backer JM.Targeting endothelial cells overexpressing VEGFR-2:selective toxicity of Shiga-like toxin-VEGF fusion proteins[J].Bioconjug Chem,2001,12(6):1066-1073.
[26]Li Y,Wang MN,Li H,et al.Active immunization against the vascular endothelial growth factor receptor flk1inhibits tumor angiogenesis and metastasis[J].J Exp Med,2002,195(12):1575-1584.
[27]Niethammer AG,Xiang R,Becker JC,et al.A DNA vaccine against VEGF receptor 2prevents effective angiogenesis and inhibits tumor growth[J].Nat Med,2002,8(12):1369-1375.
[28]Carbone C MT,Zhu C,Paradiso G,et al.Anti-VEGF treatment resistant pancreatic cancers secrete proinflammatory factors that contribute to malignant progression by inducing an EMT cell phenotype[J].Clin Cancer Res,2011,17(17):5822-5832.
[29]Gerber HP OE,Grewal IS.Targeting inflammatory cells to improve anti-VEGF therapies in oncology[J].Recent Results Cancer Res,2010,180:185-200.
[30]Lane HA WJ,McSheehy PM.mTOR inhibitor RAD001(everolimus)has antiangiogenic/vascular properties distinct from a VEGFR tyrosine kinase inhibitor[J].Clin Cancer Res,2009,15(5):1612-1622.
[31]Robert J,otzer TEH,Piotr Tomczak,et al.Figlin overall Survival and updated results for sunitinib compared with interferon alfa in patients with metastatic renal cell carcinoma[J].J Clin Oncol,2009,27(22):3584-3590.
[32]Escudier B ET,Stadler WM.Sorafenib for treatment of renal cell carcinoma:Final efficacy and safety results of the phase III treatment approaches in renal cancer global evaluation trial[J].J Clin Oncol,2009,27(20):3312-3318.
[33]Syrigos KNK,Eleni,Boura,et al.Bevacizumab-induced Hypertension:pathogenesis and management[J].Biodrugs,2011,25(3):159-169.
[34]Kuenen BC,Rosen L,Smit EF,et al.Dose-finding and pharmacokinetic study of cisplatin,gemcitabine,and SU5416 in patients with solid tumors[J].J Clin Oncol,2002,20(6):1657-1667.