虾青素对Aβ25~35诱导小鼠皮层神经元损伤的保护作用
陆亚鹏 刘思园 朱 俐 (南通大学航海医学研究所,江苏 南通 22600)
阿尔茨海默病(AD)是一种病因未明的神经退行性疾病,Aβ在脑组织中的异常增加和沉积是AD主要的病理改变。Aβ通过诱导氧化应激、炎症反应等多种神经毒性,引起海马和皮层等处胆碱能神经元的退变,可能是导致AD患者记忆和认知障碍的主要原因〔1〕。虾青素(AST)属于类胡萝卜素,具有较为突出的抗氧化和抗炎活性〔2〕,能够穿透血脑屏障〔3〕。为了考察虾青素在 AD治疗中的应用潜力,本研究首次以 Aβ25~35诱导小鼠皮层神经元损伤为模型研究虾青素对Aβ的神经毒性的抑制作用,并为深入研究虾青素的神经保护作用机制提供参考。
1 材料与方法
1.1 主要仪器和试剂 CO2培养箱(5400,NAPCO公司),全自动酶标仪(Elx800,BiO-TEK公司),正置荧光显微镜(DM4000B,Leica公司)、倒置荧光显微镜(DMIRB,Leica公司)。Neurobasal Medium/B27、DMEM 培养基(Invitrogen公司),胰蛋白酶 (Cell Signaling Technology 公司),Aβ25~35、AST、多聚赖氨酸、Hoechst 33342、DCFH-DA、MTT、罗丹明123(Sigma公司),DMSO(Amresco公司)。其他试剂均为分析纯。
1.2 小鼠皮层神经元的培养 取胎龄为13~15 d的ICR小鼠,无菌条件下分离出大脑皮层,在 D-Hank′s平衡盐溶液中漂洗3遍,彻底剔除脑膜和表面血管,剪碎后用终浓度为0.125%胰蛋白酶37℃消化10 min,用含15%胎牛血清的DMEM完全培养基终止消化,调整细胞密度为1×106个/ml,接种于预先铺有L-多聚赖氨酸的96孔或24孔培养板中,96孔培养板每孔100 μ l,24 孔培养板每孔 1 000 μ l。 置 37℃、5%CO2培养箱培养24 h后,用Neurobasal Medium/B27全部换液,培养3 d后加入盐酸阿糖胞苷(终浓度为10-5mol/L)作用24 h抑制非神经细胞的生长,以后每隔2~3 d换液1次,培养7 d后用于实验。实验前用神经元特异性烯醇酶(NSE)免疫荧光标记,随机计数300个相邻细胞,证实神经元纯度达90%以上。
1.3 Aβ25~35的孵育 将 Aβ25~35溶于灭菌蒸馏水中,配成浓度250 μ mol/L的母液分装,于-20℃冻存。使用前置入37℃下孵育7d,使其老化、聚集。
1.4 实验分组 正常组:不加任何处理因素;模型组:取5、10、15、20 μ mol/L 4 个浓度的 Aβ25~35处理细胞 24 h,选择合适造模浓度;AST 保护组:分 别用 250、500、1 000、2 000、4 000 nmol/L浓度的AST预处理2 h后加入 Aβ25~35共同孵育24 h。
1.5 MTT法测定神经元活力 将细胞(1×105个/ml)接种于96孔板,培养神经元按实验要求处理后,向96孔板中加入每孔180 μ l Neurobasal无血清培养基和 5 g/L 的 MTT 20 μ l,孵育 4 h后,吸弃上清液,每孔加150 μ l DMSO振荡10 min,用自动酶标检测仪,在570 nm波长处测各孔的吸光度(OD)值。相对细胞活力(%)=处理组的OD值/对照组的OD值 ×100%。
1.6 ROS检测 接种于96孔板中的神经元经实验处理后,用含10 μ mol/L DCFH-DA荧光探针的培养液于37℃细胞培养箱内孵育20 min。用无血清细胞培养液洗涤细胞3次以去除探针。用自动酶标检测仪检测DCF,激发波长488 nm,发射波长525 nm。DCF相对荧光强度(%)=处理组的荧光值/对照组的荧光值 ×100%。
1.7 Hoechst 33342荧光染色检测细胞凋亡 将生长于24孔培养板内盖玻片上的神经元,经过不同处理后用0.01 mol/L PBS洗两遍,加4%多聚甲醛室温下固定1 h,用0.01 mol/L PBS洗3遍后加入5 mg/L Hoechst工作液,4℃避光孵育1 h,用0.01 mol/L PBS洗3遍后将盖玻片附有细胞的一面倒扣在滴加10 μ l缓冲甘油的载玻片上。通过正置荧光显微镜观察,正常细胞核呈弥散均匀的荧光,凋亡的细胞核呈团状或碎块状致密浓染的强荧光。计算凋亡细胞的百分率(%)=凋亡细胞核数/总细胞核数×100%。
1.8 线粒体膜电位的测定 线粒体膜电位测定按照本实验室已建立的方法〔4〕,有少许改动。接种于96孔板中的神经元按实验要求处理后,加入含1 g/L Rhodarmine123的培养液于37℃孵育15 min,0.01 mol/L PBS洗涤3次,用自动酶标检测仪506 nm激发波长,529 nm发射波长检测Rhodarmine123荧光强度。Rhodarmine123相对荧光强度(%)=处理组的荧光值/对照组的荧光值 ×100%。样品在倒置荧光显微镜下观察,拍照。
2 结 果
2.1 MTT测定结果 预实验结果显示AST浓度大于4 000 nmol/L时神经元活力出现下降现象,在250~4 000 nmol/L范围内神经元活力无明显变化,表明该浓度范围对神经元无明显毒性,因此选择250~4 000 nmol/L作为本研究AST的处理浓度范围。经老化处理的Aβ25~35可以剂量依赖性的引起细胞活力下降。 用 5、10、15 和 20 μ mol/L Aβ25~35作用于神经元24 h后,相对细胞活力分别为63.9%±7.4%、46.4%±4.5%、35.2% ±5.4%和18.3%±3.0%,因此本实验选用10 μ mol/L Aβ25~35来制备神经元损伤模型。MTT测定结果如表 1所示,500~4 000 nmol/L的 AST可明显拮抗10 μ mol/L Aβ25~35引起的细胞活力下降,其中 2 000 nmol/L 的AST作用效果最为显著(P<0.01)。
2.2 ROS水平检测结果 神经元内ROS水平检测结果见表1。皮层神经元经10 μ mol/L Aβ25~35处理24 h后细胞内 ROS明显增加,500~4 000 nmol/L AST预处理能有效防止Aβ25~35诱导的胞内ROS积累,与模型组相比,有显著性差异(P<0.01)。
2.3 凋亡检测结果 Hoechst 33342检测结果如图1、表 2所示。正常组神经元细胞核呈弥漫均匀的低强度荧光,而Aβ25~35模型组一些细胞核呈浓染致密的固缩形态和颗粒状荧光,为凋亡的典型形态。2 000 nmol/L AST处理组,固缩形态和颗粒状荧光的细胞核显著减少(P<0.01)。
2.4 线粒体膜电位 线粒体膜电位的检测结果如图2、表2所示。10 μ mol/L Aβ25~35处理皮层神经元24 h导致线粒体膜电位明显下降,表现为神经元内聚集的Rhodarmine 123明显减少。膜电位下降是线粒体受损的重要表现,而用2 000 nmol/L AST预处理对神经元的线粒体功能有明显的保护作用,Rhodarmine 123的荧光值明显高于模型组 (P<0.01)。
表1 AST对Aβ25~35诱导小鼠皮层神经元活力下降和胞内ROS水平上升的影响(±s,n=8)
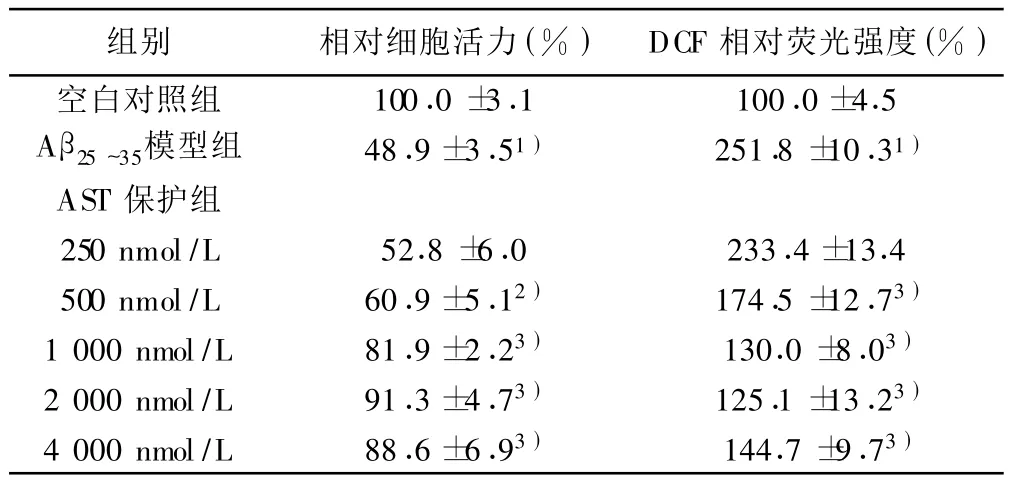
表1 AST对Aβ25~35诱导小鼠皮层神经元活力下降和胞内ROS水平上升的影响(±s,n=8)
与空白对照组比较:1)P<0.01;与A β25~35模型组比较:2)P <0.05,3)P<0.01
组别 相对细胞活力(%) DCF相对荧光强度(%)空白对照组 100.0±3.1 100.0±4.5 Aβ25~35模型组 48.9 ±3.51) 251.8 ±10.31)AST保护组250 nmol/L 52.8 ±6.0 233.4±13.4 500 nmol/L 60.9±5.12) 174.5 ±12.73)1 000 nmol/L 81.9 ±2.23) 130.0 ±8.03)2 000 nmol/L 91.3±4.73) 125.1 ±13.23)4 000 nmol/L 88.6 ±6.93) 144.7 ±9.73)
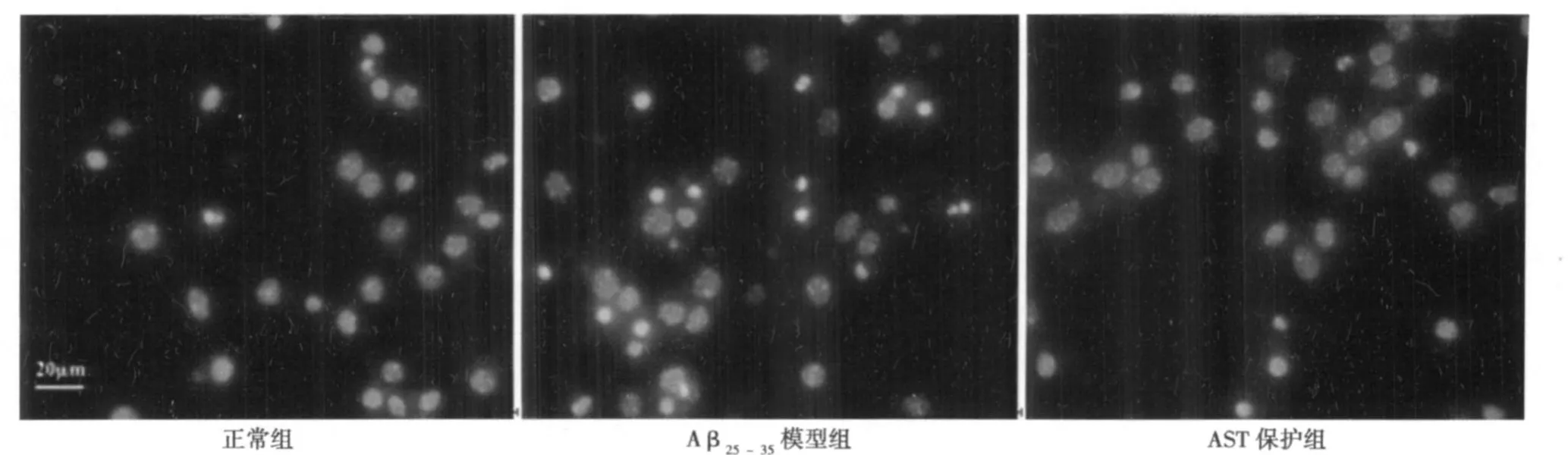
图1 AST对 Aβ25~35诱导小鼠皮层神经元凋亡的影响(bar=20 μ m)
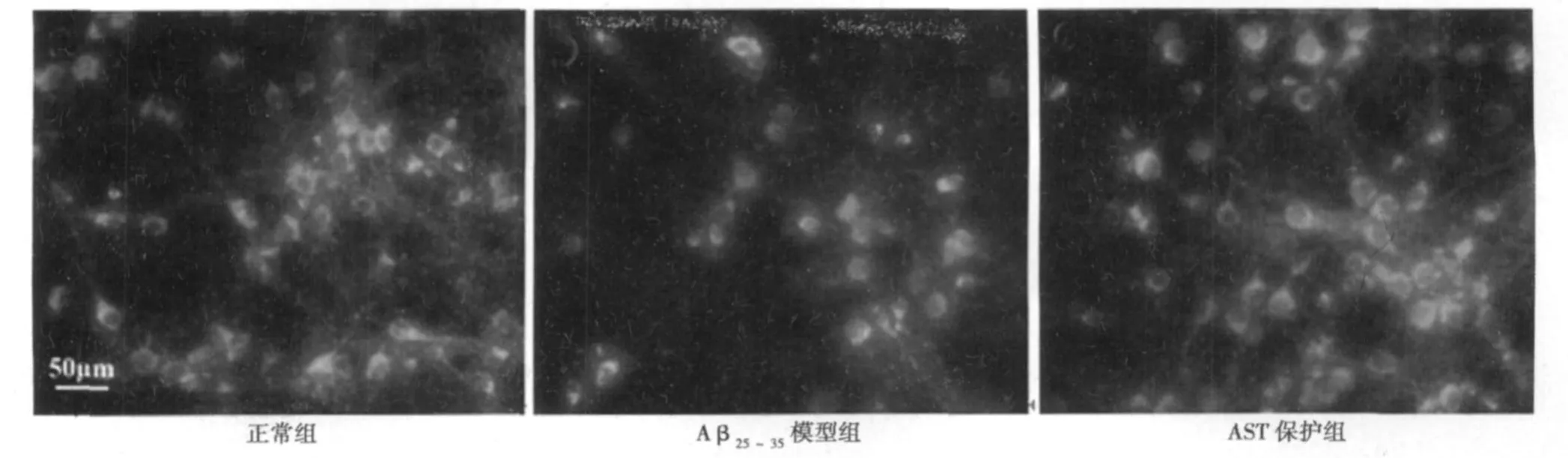
图2 AST对 Aβ25~3 5诱导小鼠皮层神经元线粒体膜电位损伤的影响(bar=50 μ m)
表2 AST对Aβ25~35诱导小鼠皮层神经元凋亡和线粒体膜电位损伤的影响(±s,n=6)

表2 AST对Aβ25~35诱导小鼠皮层神经元凋亡和线粒体膜电位损伤的影响(±s,n=6)
与空白对照组比较:1)P<0.01;与 Aβ25~35模型比较:2)P <0.01
组别 凋亡率(%) Rhodarmine 123相对荧光强度(%)空白对照组 5.2±1.1 100.0±3.0 Aβ25 ~35模型组 43.9 ±3.51) 51.8 ±6.91)AST保护组 18.3±4.92) 84.1±7.22)
3 讨 论
AST具有多种药理活性,在糖尿病、肿瘤和心脑血管疾病的防治方面有很大的临床应用潜力〔5〕。作为类胡萝卜素中唯一被证实能穿透血脑屏障的成员,AST可以对中枢神经系统尤其是对大脑起到保护作用〔6〕。
脑部Aβ的沉积是AD的典型病理特征之一。Aβ由39~43个氨基酸残基组成,Aβ25~35是其主要的毒性片段,对体外培养及在体的神经细胞均有毒性作用〔7〕。胆碱能神经元退行性病变与 AD密切相关,本研究利用 Aβ25~35诱导小鼠皮层神经元损伤作为AD的细胞模型,能很好地模拟AD的病理特征。
本结果可以说明AST具有保护线粒体膜和酶的功能,能够维持细胞的稳态,使神经元死亡率明显降低。Aβ可以通过诱导产生大量的ROS而造成氧化应激损伤。线粒体不仅是细胞中ROS的主要产生场所,也是对氧化损伤非常敏感的细胞器〔8〕。超过正常水平的ROS会影响线粒体膜的性质和功能,损伤线粒体呼吸链及其相关代谢酶,导致线粒体膜电位下降、能量代谢受阻、线粒体肿胀、并可释放细胞色素c等凋亡相关因子,介导细胞死亡〔9〕。本研究发现AST预处理可有效抑制胞内ROS的产生,2 000 nmol/L的AST抑制效果最为明显,能很好地保护线粒体膜电位不受氧化损伤的影响,抑制神经元凋亡。
AST可能通过多种途径发挥抗氧化损伤的作用。AST不仅同其他类胡萝卜素一样在分子中存在共轭双键链,而且在共轭双键链末端的3和3′位置有不饱和酮基和羟基,因此具有更强的清除自由基的能力。另外,由于末端羟基的存在,使AST分子两端亲水,中间疏水,能嵌入生物膜的磷脂双分子层,增加生物膜的机械强度,更好地防止自由基对膜的损伤〔10〕。AST还具有激活内源抗氧化系统的能力,提高超氧化物歧化酶、过氧化氢酶、谷胱甘肽过氧化物酶等内源性抗氧化物酶的表达水平〔3〕。近来有文献报道,AST能呈剂量依赖性和时间依赖性的上调血红素加氧酶-1的表达,从而对 Aβ25~35诱导 PC12细胞的损伤起到明显的保护作用〔11〕。
总之,本文初步确认了AST对AD的神经保护作用机制可能和防止氧化应激损伤和保护线粒体功能有关。但是,Aβ的神经毒性机制和AST防治作用的机制需要深入研究。
1 Nathalie P,Jean-Noel O.Processing of amyloid precursor protein and amyloid peptide neurotoxicity〔J〕.Curr Alzheimer Res,2008;5(2):92-9.
2 杨 艳.虾青素抗氧化活性机制研究进展〔J〕.国外医学·卫生学分册,2008;35(4):231-3.
3 Nakajima Y,Inokuchi Y,Shimazawa M,et al.Astaxanthin,a dietary carotenoid,protects retinal cells against oxidative stress in-vitro and in mice invivo〔J〕.J Pharm Pharmacol,2008;60(10):1365-74.
4 Lu YP,Liu SY,Sun H,et al.Neuroprotective effect of astaxanthin on H(2)O(2)-induced neurotoxicity in vitro and on focal cerebral ischemia in vivo〔J〕.Brain Res,2010;1360:40-8.
5 Hussein G,Sankawa U,Goto H,et al.Astaxanthin,a carotenoid with potential in human health and nutrition〔J〕.J Nat Prod,2006;69(3):443-9.
6 Goswami G,Chaudhuri S,Dutta D.The present perspective of astaxanthin with reference to biosynthesis and pharmacological importance〔J〕.World J Microbiol Biotechnol,2010;26(11):1925-39.
7 张萌涛,钱亦华,杨 杰,等 .丹参酮ⅡA对谷氨酸联合淀粉样蛋白诱导细胞损伤的保护作用〔J〕.中国老年学杂志,2009;10(29):2465-8.
8 张荣超,付 于,于建春,等 .β淀粉样蛋白致线粒体功能障碍的研究现状〔J〕.中国老年学杂志,2010;30(15):156-8.
9 Galindo MF,Ikuta I,Zhu X,et al.Mitochondrial biology in Alzheimer′s disease pathogenesis〔J〕.J Neurochem,2010;114(4):933-45.
10 Shibata A,Kiba Y,Akati N,et al.Molecular characteristics of astaxanthin and beta-carotene in the phospholipid monolayer and their distributions in the phospholipid bilayer〔J〕.Chem Phys Lipids,2001;113(1-2):11-22.
11 Wang HQ,Sun XB,Xu YX,et al.Astaxanthin upregulates heme oxygenase-1 expression through ERK1/2 pathway and its protective effect against beta-amyloid-induced cytotoxicity in SH-SY5 Y cells〔J〕.Brain Res,2010;1360:159-67.

