非清髓性供者造血干细胞移植对肾移植受者免疫功能的影响
吴书一 ,刘文刚 ,董秀娟 ,罗明霞 ,葛永超 ,王志余 ,赵晓武 *
1.郑州市第三人民医院干细胞与器官移植实验室,河南郑州 450000;2.郑州市第三人民医院血液科,河南郑州 450000;3.郑州市第三人民医院泌尿外科,河南郑州 450000
目前,肾脏移植已成为终末期肾病的有效治疗手段之一,随着新型免疫抑制剂的广泛应用,肾移植1年人/肾存活率已经达到90%以上,但移植物长期存活率没有得到明显改善。慢性排斥反应和免疫抑制剂的不良反应仍是影响肾移植长期存活的主要因素[1]。诱导受体对移植肾特异性的免疫耐受可以减少排斥反应的发生、减少免疫抑制剂用量,提高移植肾的长期存活。目前,诱导免疫耐受的方法主要是供者特异性输血和供者特异性造血干细胞移植[2]。本研究对48例肾移植受者进行了非清髓性的供者特异性造血干细胞移植,并观察其免疫功能变化,以探讨其诱导免疫耐受、降低排斥反应的可行性及安全性。
1 资料与方法
1.1 一般资料
收集1998年1月~2005年12月在我院行供体特异性造血干细胞移植的肾移植患者48例,设为观察组,患者均为女性,年龄20~48岁,平均34岁。收集同期接受同一供者另一肾脏的肾移植患者48例,设为对照组,患者均为女性,年龄22~49岁,平均36岁。供者为48例健康男性,年龄20~50岁,平均35岁。供、受者ABO/Rh血型相同,补体依赖性淋巴细胞毒交叉配型试验(CDC)≤10%,受者术前检查群体反应性抗体(PRA)均为阴性,依据氨基酸残基配型原则,HLA-A、B、DRB1为1~2位点错配。供体热缺血时间少于8 min,冷缺血时间少于8 h。
1.2 方法
1.2.1 骨髓采集、处理与移植 取肾的同时,于供者的双侧髂前、髂后上棘及胸骨部位,采集骨髓200~380 ml,ACD抗凝,经过去除脂肪、血浆、部分红细胞后浓缩为80~100 ml,加入等体积的细胞冷冻保护液,经程序降温后置-196℃液氮中保存。常规方法行肾移植,造血干细胞移植的预处理方案采用ATG(德国,Fresenius,兔抗)3 mg/(kg·d),连用 5 d,肾移植术后第14天,将冷冻的骨髓于42℃水浴中快速复温,立即输注,输注的单个核细胞数为(0.9~2.5)×108/kg,台盼蓝拒染率为(93±4)%。
1.2.2 预防排异的治疗方案 移植后应用三联免疫抑制剂环孢素 A 5 mg/(kg·d)[或普乐可复 0.1 mg/(kg·d)]、吗替麦考酚脂1.5 mg/d、泼尼松30 mg/d。两组随访1~10年,观察急性排斥反应发生率及5年人/肾存活率。所有受者均经医院伦理道德委员会讨论批准,并与患者签署知情同意书。
1.2.3 标本采集 于移植后第30、60、90、360天同一时间点留取外周血标本:血清2 ml,肝素抗凝血4 ml。
1.2.4 试剂与仪器 抗 CD3、CD4、CD8、CD19、CD25 购自美国BD 公司(Becton,Dicki-nson and Company);IL-10、TNF-α 细胞因子检测试剂购自深圳晶美生物工程公司;主要仪器FACS Calibur流式细胞仪:美国BD公司,ELX800型酶标分析仪(美国Bio-Tek公司)
1.2.5 检测方法 应用流式细胞仪直接免疫标记技术检测淋巴细胞亚群,T 淋巴细胞选择 CD3+、CD4+、CD8+、CD4+CD25+,B淋巴细胞选择CD19+。酶联免疫法检测细胞因子IL-10、TNF-α。
1.3 统计学处理
应用SPSS 13.0软件包进行统计学处理,计量资料数据以均数±标准差(±s)表示,比较采用t检验,百分率比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果
移植后随着时间延长,观察组CD3+、CD4+、CD19+细胞百分比及TNF-α浓度持续降低,与对照组相比,60 d后CD3+、CD4+、CD19+下降最明显(P<0.05),之后稳定在一个水平;观察组CD8+降低不明显,但CD4+/CD8+比值明显降低;观察组CD4+CD25+百分比及IL-10浓度持续升高,与对照组相比,CD4+CD25+百分比90 d时升高最明显 (P<0.05),IL-10浓度30 d时升高最为明显(P<0.05)。结果见表1。
表1 观察组与对照组,移植后不同时间段免疫学指标变化的比较(±s,n=48)
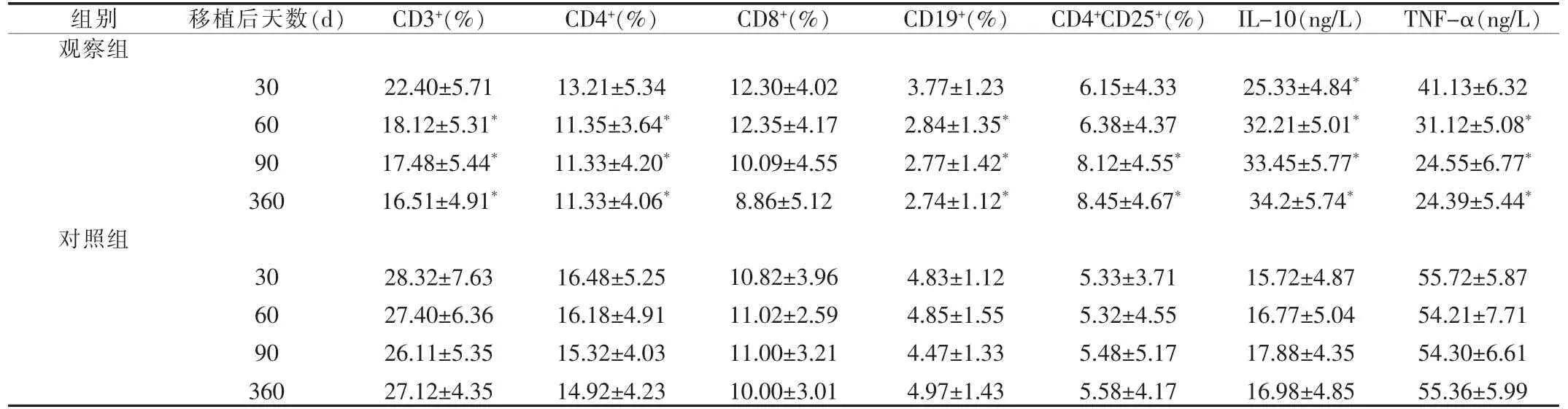
表1 观察组与对照组,移植后不同时间段免疫学指标变化的比较(±s,n=48)
注:移植后同一时间段,与对照组相比,*P<0.05
两组急性排斥反应发生率:观察组为12%,低于对照组(29%),两组比较,差异有统计学意义(P<0.05);随访5年人/肾存活率,观察组为100%/100%,对照组为100%/88%。
3 讨论
非清髓性供体特异性造血干细胞移植是指在肾移植后通过相对较经典、预处理强度较低的非清髓性诱导治疗来抑制受者的免疫应答,使供者造血干细胞在受体内得以植入,再经过免疫抑制剂应用,以期达到宿主和移植物之间的双向免疫耐受,提高肾移植患者长期存活率。Spitzer等[3]报道1例多发性骨髓瘤继发肾功能衰竭患者,经环磷酰胺、抗胸腺细胞球蛋白(ATG)和胸腺照射处理后,采取HLA配型相合的骨髓联合肾脏移植,术后2个月停用免疫抑制剂,肾功能正常,无排斥反应发生。Kawai等[4]报道,肾移植联合骨髓输注患者5例,移植后9~14个月停用免疫抑制剂,移植肾功能仍保持稳定2~5年。傅耀文等[5]报道61例肾移植后接受供者特异性骨髓输注,可以诱导嵌合体发生,提高受者对供者的免疫耐受,降低排斥反应发生率。王志余等[6]报道3例活体亲属肾移植,首先对供体进行外周血动员,采集外周血干细胞,于肾移植后2周分次输注,能更好地促进微嵌合形成,更有利于产生免疫耐受。
本文主要观察供体特异性造血干细胞移植对肾移植受者免疫功能的影响,探讨免疫耐受及排斥反应发生情况。T细胞亚群主要分为CD4阳性辅助性T细胞和CD8阳性抑制性T细胞。CD4辅助性T细胞(Th)又分为Th1和Th2细胞,能介导免疫应答,分泌多种具有调节细胞功能的高活性、多功能低分子蛋白即细胞因子,在移植免疫中发挥重要作用。Th1细胞分泌的细胞因子(IL-2、TNF-α等)能促进细胞免疫应答,激活天然杀伤细胞,特异性杀伤移植物抗原,启动排斥反应。Th2细胞分泌的细胞因子(IL-10等)是一种强有力的免疫抑制和炎症抑制因子,抑制免疫排斥和炎症的发生。Th1和Th2细胞间动态平衡对诱导和维持免疫耐受十分重要[7]。因此,肾移植受者T细胞亚群和T细胞分泌的细胞因子检测,一定程度上反映了T细胞的活化程度,几种不同的细胞因子联合检测可反映不同辅助性T细胞亚群的活化状态。
移植后随着时间延长,观察组CD3+、CD4+细胞百分比持续降低,与对照组相比,60 d 后 CD3+、CD4+下降最明显(P<0.05),之后稳定在一个水平;观察组CD8+降低不明显,但CD4+/CD8+比值明显降低,表明受者免疫功能处于明显的免疫抑制状态,有利于降低排斥反应的发生。CD4+CD25+调控T细胞具有免疫抑制及诱导活化的T细胞成为免疫无能两大功能特征,是机体维持自身耐受的重要组成部分,其对免疫反应具有抑制效应[6]。观察组CD4+CD25+持续升高,与对照组相比,90 d时升高最明显(P<0.05),提示受者形成免疫耐受,呈现低免疫反应状态;IL-10为Th2细胞分泌的抑制性细胞因子,观察组IL-10持续升高,与对照组相比,30 d时升高最为明显 (P<0.05),也提示受者免疫功能受到抑制。TNF-α为Th1细胞分泌的促炎症因子和免疫抑制因子,观察组 TNF-α持续降低,与对照组相比,60 d时降低最为明显(P<0.05),提示可减少炎症反应的发生,降低排斥反应,受者免疫功能受到进一步抑制。CD19+是B淋巴细胞的表面标志,观察组CD19+持续降低,与对照组相比,60 d时下降最明显(P<0.05),之后稳定在一个水平,提示B淋巴细胞功能受到抑制,从而可以减少排斥性抗体的分泌,降低排斥反应的发生率。随访结果表明,观察组急性排斥反应发生率明显低于对照组(12%vs 29%,P<0.05);5 年人/肾存活率,观察组高于对照组(100%/100%vs 100%/88%)。
本研究发现,尽管观察组与对照组都使用了免疫抑制剂环孢素A,但从免疫重建结果来看,观察组的CD4+CD25+调节性T细胞、IL-10明显增多,与环孢素A参与免疫抑制IL-2、TNF-α分泌减少的药理机制无关。显然输注同一供者骨髓干细胞,可以通过抑制性T细胞克隆的增加,改变了受体免疫重建后的淋巴细胞群系,从而可能诱导了受体的免疫耐受。
本组结果提示供体特异性造血干细胞移植能够抑制肾移植受者CD3+、CD4+、CD8+T细胞免疫功能,使患者处于低免疫反应状态;增强CD4+CD25+调节性T细胞功能,有利于诱导免疫耐受;同时,又能够抑制B淋巴细胞,减少排斥性抗体的分泌,降低排斥反应发生率,对提高人/肾存活率具有重要作用。
笔者认为,供体特异性造血干细胞移植是一种安全、有效地诱导肾移植免疫耐受的临床治疗方法,能够降低排斥反应的发生,其更深层次的免疫机制有待进一步探讨。
[1]董磊,段美丽,李昂.肾移植术后不同阶段感染病原学特征分析[J].临床和实验医学杂志,2006,5(4):308-310.
[2]黄君龄,王祥慧.供者特异性输注诱导肾移植受者免疫耐受的研究进展[J].上海交通大学学报:医学版,2009,29(7):877-881.
[3]Spitzer TR,Delnonico F,Tolkoff-Rubin N,et al.Combined histocompatibility leukocyte antigen-matched donor bone marrow and renal transplantation for multiple myeloma with end stage renal disease:the induction of allograft tolerance through mixed lymphohe-matopoietic chimerism[J].Transplantation,1999,68(4):480-484.
[4]KawaiT,CosiniAB,SpitzerTR,etal.HLA-mismatchedrenaltransplantation without maintenance immunosuppression[J].N Engl J Med,2008,358(4):353-361.
[5]傅耀文,王伟刚,周洪澜,等.肾骨髓联合移植与嵌合体发生及急性排斥反应的关系[J].中华医学杂志,2004,84(23):1983-1985.
[6]王志余,葛永超,赵晓武,等.肾-骨髓联合移植诱导免疫耐受:能够促进移植后嵌合体的形成吗?[J].中国组织工程研究与临床康复,2009,13(53):10457-10460.
[7]何维.医学免疫学[M].北京:人民卫生出版社,2005:188-205.

