重组人5型腺病毒在体外对A549细胞的影响
蒋 力,侯 兵,崔珂钒,闵家新
(中国人民解放军第三军医大学新桥医院胸外科,重庆 400037)
肿瘤的发生是多因素、多阶段、多步骤的复杂过程。在本研究中,笔者综合评价了重组人5型腺病毒在体外的抗肿瘤效应,揭示了其对肿瘤细胞生物学效应的影响,现报道如下。
1 材料与方法
1.1 仪器与材料
Model 2300 CO2型细胞孵育箱(美国Shellab公司);移液器(德国Eppedorf公司)。A549细胞(由第三军医大学西南医院脑外科夏永智博士惠赠);重组人5型腺病毒(商品名安柯瑞®,上海三维生物技术有限公司,批号为20110401);RPMI 1640培养基、小牛血清均购自GibcoPBRL公司;Transwell小室、MTT试剂盒均购自美国Sigma公司;TUNEL试剂盒(上海华舜生物工程有限公司)。
1.2 试验方法
1.2.1 A549 细胞培养及传代
将复苏后的A549细胞置含10%胎牛血清的RPMI 1640培养液中,于5%CO2和37℃、饱和湿度的孵育箱中培养,细胞贴壁形态正常,生长良好,隔天换液并传代1次;细胞处于对数生长期、成活率大于95%时,以0.25%胰酶消化培养瓶内单层细胞,将细胞悬液移入离心管内,常温下800~1000 r/min低速离心5 min,吸去上清液,加入无血清RPMI 1640培养基,重悬细胞,计数板计数细胞。在96孔板中分3组,每组设5个复孔,每孔取3×105个/L细胞,放入孵育箱中培养24 h后用于转染。
1.2.2 细胞增殖曲线测定
采用3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)比色法检测加入重组人5型腺病毒(质量浓度分别为5,10,15,20μg/mL)培养时 A549 细胞(试验组)12,24,48,72 h 时内皮细胞的存活率。以正常生长的A549细胞为对照组。用含10%胎小牛血清的培养液配成单个细胞悬液,接种到96孔板,每孔1000~10000个细胞,每孔体积200 μL,培养3~5 d后,每孔加MTT溶液(5 g/L)20 μL,继续孵育4 h,终止培养,小心吸弃孔内培养上清液,每孔加150 μL二甲基亚砜,振荡10 min,使结晶物充分融解,选择490 nm波长在酶联免疫监测仪上测定各孔吸光度值,试验结果用细胞存活率表示。细胞存活率(%)=试验组吸光度值/对照组吸光度值×100% 。
1.2.3 细胞迁徙试验
将小室放入24孔培养板中,在上室加入300 μL预温的无血清培养基,室温下静置15~30 min,使基质胶水化,吸去剩余培养液,制备无血清细胞悬液(2~3×105个/mL);24孔板下室加入500 μL含20%胎牛血清(FBS)的RPMI 1640培养基,取细胞悬液200 μL加入Transwell小室,注意防止下层培养液和小室间产生气泡,常规培养12~24 h;取出小室,用棉签擦去基质胶和上室一侧的细胞,用手术刀将膜切下,用90%酒精常温固定30 min,0.1%结晶紫常温染色10 min,清水漂净,用棉签轻轻擦掉上层未迁移细胞,取3~5个视野计数细胞个数。将上室液更换为质量浓度为20μg/mL的重组人5型腺病毒培养液,重复以上试验步骤。
1.2.4 细胞周期检测
将A549细胞分为对照组及试验组,每组12孔,接种到24孔板内。24 h后,A549细胞试验组换为质量浓度为20μg/mL的重组人5型腺病毒无血清培养液,培养3 d后,以0.25%胰酶消化,收集细胞,800 r/min离心5 min,0.01 mol/L磷酸盐缓冲液漂洗,吹打成单细胞悬液,70%冷乙醇4℃下固定24 h,RNAase消化,碘化丙啶标记,在激发光波长488 nm、检测光波长610 nm下用流式细胞仪检测细胞周期。
1.2.5 细胞凋亡试验
将A549细胞分别按每孔4×104个/mL、每组12孔接种到24孔板,共两组。24 h后,一组12孔更换为质量浓度为0.20μg/mL的重组人5型腺病毒无血清培养液,设为A549细胞试验组,其余为对照组。72 h后将细胞用3.7%中性福尔马林固定10 min,经100%,95%,70%梯度浓度的酒精各水化5 min,磷酸盐缓冲液室温荡洗10 min,每孔滴加 50 μL Cytonin,室温 30 min,DNase-free水洗 2 次,每次2 min,加入新鲜配置的3%H2O2溶液,室温5 min,磷酸盐缓冲液洗1 min,TdT标记缓冲液室温孵育5 min,每孔滴加50 μL标记反应混和液,37℃ 1 h后用TdT终止缓冲液室温作用5 min,倒置荧光显微镜下观察,绿色荧光颗粒者为凋亡细胞。
2 结果
2.1 重组人5型腺病毒对细胞增殖的影响
结果见表1。
表1 不同质量浓度重组人5型腺病毒对A549细胞存活率的影响(%,)

表1 不同质量浓度重组人5型腺病毒对A549细胞存活率的影响(%,)
注:与对照组相比,*P<0.01;与同一浓度前一时相比较,△P<0.01。
2.2 细胞迁徙试验
结果见图1。重组人5型腺病毒能显著抑制A549细胞的迁徙能力。正常A549细胞与加入20μg/mL重组人5型腺病毒培养的A549细胞比较,迁徙试验结果有显著性差异(P<0.01)。

图1 重组人5型腺病毒对A549细胞迁徙的影响
2.3 重组人5型腺病毒对内皮细胞细胞周期的影响
以含重组人5型腺病毒质量浓度为20μg/mL培养液培养72 h后,经细胞周期测定,试验组G0/G1期A549细胞所占比例为77.41%,S 期细胞 22.41%,G2-M 期细胞占 2.19%;对照组 G0/G1期A549细胞所占比例为76.97%,S期细胞占9.21%,G2-M期细胞占13.62%。结果显示,试验组细胞被阻滞于S期,细胞增殖显著被抑制(P <0.01)。结果见图 2。
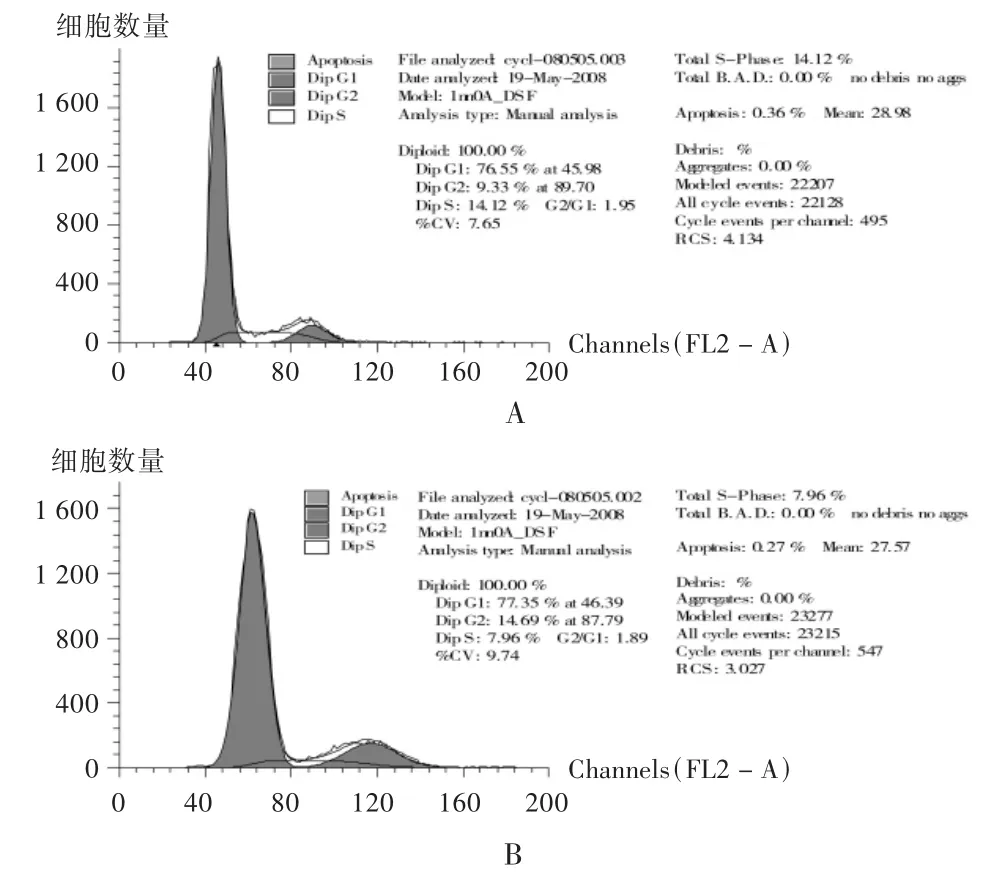
图2 重组人5型腺病毒对A549细胞周期分布的影响
2.4 重组人5型腺病毒对细胞凋亡的影响
以含重组人5型腺病毒质量浓度为20μg/mL的培养液培育A549细胞72 h后,TUNEL法检测细胞凋亡。结果显示,加入重组人5型腺病毒培养后,A549细胞凋亡数较正常培养A549细胞明显增加(n=20,P <0.01),见图 3。

图3 重组人5型腺病毒对细胞凋亡的影响
3 讨论
肿瘤形成是一个多因素、多基因参与的过程,其中p53基因的失活对肿瘤形成起着重要作用。p53基因与人类50%的肿瘤有关,目前发现的有肝癌、乳腺癌、膀胱癌、胃癌、结肠癌、前列腺癌、软组织肉瘤、卵巢癌、脑瘤、淋巴细胞肿瘤、食道癌、肺癌、成骨肉瘤等[2]。重组人5型腺病毒是利用基因工程技术对人5型腺病毒(Ad5)进行基因重组而得到的一种溶瘤腺病毒,其删除了人5型腺病毒的E1B-55 kD和E3区19 kD基因片段,能在肿瘤细胞中特异性复制而最终溶瘤[3]。
重组人5型腺病毒注射液特异性杀死肿瘤细胞的原理有:直接在肿瘤细胞中复制、包装,最终导致肿瘤细胞裂解;增加受感染肿瘤细胞对由细胞因子等引起的免疫反应的敏感性,加速受感染细胞的死亡;所表达的抗原诱发MHC I在被感染肿瘤细胞表面的表达,引导机体产生针对性的T细胞免疫反应;E1A区可增强肿瘤细胞对化学治疗的敏感性[4]。
本研究证实,重组人5型腺病毒在体外能明显抑制A549细胞的生长并促进其调亡。但是,将重组人5型腺病毒制成临床抗癌药物仍需克服一些难题,如药效的特异性及局部药物浓度过低等。
[1]Kenneth R,Rog Lski,Svend O,et al.In Vivo Antitumor Activity of ONYX-015 Is Influenced by p53 Status and Is Augmented by Radiotherapy[J].Cancer Research,2000,60:1193-1196.
[2]Thomas Rothmann,Arnd Hengstermann,Noel J,et al.ONXY-015,Replication of ONYX-015,a Potential Anticancer Adenovirus,Is Independent of p53 Status in Tumor Cells[J].Journal of Virology,1998,72(12):9470-9478.
[3]Brett R,Dix,Sara J.Braithwaite.Does the antitumor adenovirus ONYX-015/dl1520 selectively target cells defective in the p53 pathway[J].Journal of Virology,2001,75(12):5443-5447.
[4]Cheng-Ta Yang,Liang You,Kazutsugu Uematsu,et al.P14ARF Modulates the cytolytic effect of ONYX-015 in mesothelioma Cells with wild-type p53[J].Cancer Research,2001(61):5959-5963.

