人乳铁蛋白肽的分子改良及在大肠杆菌中的表达研究
蔡 屾,叶 江,张惠展
(华东理工大学 生物反应器工程国家重点实验室,上海 200237)
当前,由于抗生素的滥用而造成细菌耐药性的形成使细菌性感染和疾病呈上升趋势。在寻求新型抗菌策略的研究中,抗菌肽因其非特异性的作用方式,使病原微生物对其不能产生抗性,优势逐渐显现。其中乳铁蛋白肽不含稀有氨基酸及外源化学成分,安全、健康,具有替代抗生素的巨大潜在优势[1]。
乳铁蛋白肽是乳铁蛋白在酸性环境下经胃蛋白酶水解,从其N端解离出的一段多肽,具有广谱的抑菌和杀菌能力,能抑制真菌和病毒的增殖、抑杀癌细胞等[2,3]。hLF18-40是人乳铁蛋白肽(Human lactoferrin)N端18~40位氨基酸组成的抗菌肽,其氨基酸序列为:TKCFQWQRNMRKVRGPPVSCIKR,具有抗贾第虫及抑制白色念珠菌的活性,对包括氟康唑和二性霉素B抗性分离菌株在内的所有念珠菌属菌株都有抗性。hLF18-40对白色念珠菌的最小抑菌浓度(MIC)为18.7 μmol·L-1;且在高盐浓度(60 mmol·L-1NaCl溶液)下仍能发挥抑菌活性;杀菌机制是通过破坏白色念珠菌的细胞膜而致其死亡[4]。此外,hLF18-40对大肠杆菌也有抑制作用,小鼠口服hLF18-40后,肾脏分泌可将其转移到感染位点从而发挥抗感染及抗炎功效[5]。
作者在此采用大肠杆菌系统表达人乳铁蛋白肽,以期实现其高效表达;同时对人乳铁蛋白肽hLF18-40的抑菌活性进行研究,以期寻找具有抗菌活性的最短抗菌肽。
1 实验
1.1 材料
革兰氏阴性菌EscherichiacoliATCC25922、EscherichiacoliJM83、EscherichiacoliBL21(DE3)均为自行保存。酵母粉等LB培养基成分购自UNIPATH公司,MH肉汤培养基购自青岛高科园海博生物技术有限公司。质粒抽提等试剂盒购自捷瑞公司。
1.2 引物的设计
选用pET-43.1a(+)和pET-41b(+)质粒作为表达载体构建表达盒。设计引物时,根据Fast Seamless Cloning技术的要求,在目的基因的前后两端均添加表达载体的同源序列;同时,根据重叠区基因扩增拼接法(SOE-PCR)的技术要求,各引物之间相互重叠15 bp左右。以pET-43.1a(+)为载体设计引物:
TGATGACGACGACAAGACCAAATGCTTTCAGTGGCAGCGCAACATGCGCAAAGTGCGCGGCCCGCCGGTGAGCTGCATCAAACGCTAAAGTCCGGGAGCTCGT
ACTACTGCTGCTGTTCTGGTTTACGAAAGTCACCGTCGCGTTGTACGCGTTTCACGCGCCGGGCGGCCACTCGACGTAGTTTGCGATTTCAGGCCCACGAGCA
1.3 DNA的同源重组
按摩尔比1∶3将线性化质粒与外源DNA混合,在Fast Seamless Cloning Enzyme的作用下进行同源重组克隆,反应条件为25 ℃温育30 min。
1.4 融合蛋白的表达纯化
在新鲜的LB培养基中将重组菌及对照菌培养至OD600为0.6左右时,加入IPTG诱导表达(终浓度为1 mmol·L-1),在诱导0.5 h、2.5 h、4.5 h后,分别适当取样,测定OD600,以新鲜的LB培养基为对照。收集菌体,洗涤、悬浮、超声破碎,离心收集超声上清液。
Ni2+柱亲和层析:将Ni2+装柱后,用10 BV的NTA-0缓冲溶液平衡Ni2+柱;将上述超声上清液注入平衡好的Ni2+柱使其牢固结合;再用10 BV的NTA-0缓冲溶液洗涤;最后依次用5 BV的NTA-20、NTA-30、NTA-50、NTA-200缓冲溶液洗脱,收集各梯度洗脱液,用SDS-PAGE分析蛋白质的分布。
1.5 融合蛋白的切割
用肠激酶切割融合蛋白,25 ℃温育16 h。反应体系如下:10×重组牛肠激酶反应缓冲溶液5 μL;融合蛋白40 μL;重组牛肠激酶0.5 U;ddH2O 4.5 μL;总体积50 μL。
1.6 最小抑菌浓度测定[6]
人乳铁蛋白肽hLF18-40及其8条改良肽的MIC采用微量肉汤稀释法[4]测定。将培养至对数生长期的大肠杆菌菌液稀释至2×105~7×105cfu·mL-1;用PBS(磷酸钠缓冲溶液,pH值7.0)将抗菌肽配制为最高待测浓度10倍的储备液,再进行梯度稀释,得到系列稀释浓度的抗菌肽溶液;向无菌的96孔聚丙烯培养板中的1~10孔分别加入100 μL稀释的菌悬液,11孔加入100 μL MH肉汤培养基;再向1~10孔分别加入10 μL相应浓度的待测抗菌肽,11孔加入10 μL无菌蒸馏水作为细菌阳性对照;将培养板置于37 ℃培养箱中保温培养24 h后观察结果。以能阻止细菌生长的最小抗菌肽浓度作为MIC。
2 结果与讨论
2.1 hLF18-40重组表达质粒的构建
根据设计好的各引物,以SOE-PCR技术进行扩增,结果见图1。
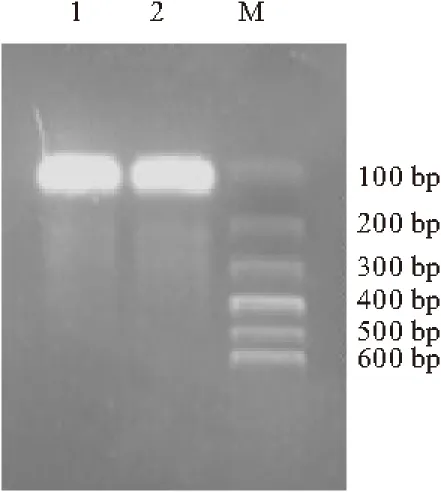
1,2.以pET-43.1a(+)为载体的PCR产物 M.DNA Marker
由图1可看出,PCR反应产物在107 bp处有粗而明亮的DNA条带,浓度较高,表明基因扩增效果较好。
用PshAⅠ酶切得到线性化的pET-43.1a(+),再与PCR产物在Fast Seamless Cloning Enzyme的作用下进行同源重组克隆。转化后以PCR法对重组子进行筛选,并经测序鉴定出正确阳性克隆。
2.2 融合蛋白的表达纯化
以IPTG诱导重组菌pET-43.1a-hLF18-40/BL21(DE3)进行表达,结果见图2。
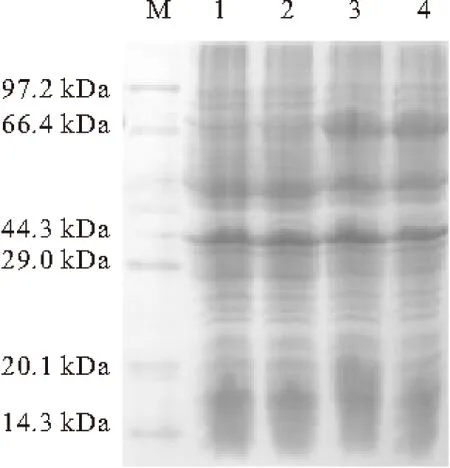
1~4.诱导0 h、0.5 h、2.5 h、4.5 h的pET-43.1a-hLF18-40/BL21(DE3) M.DNA Marker
由图2可看出,pET43.1a-hLF18-40/BL21(DE3)得到了明显的表达产物条带,且蛋白条带大小与理论值63.2 kDa相一致。
由于融合蛋白上有His· Tag标记,因此可采用Ni2+柱亲和层析的方法进行纯化,结果见图3。

1.pET43.1a-hLF18-40超声上清 2.pET43.1a-hLF18-40超声沉淀 3.超声上清 4.流穿液 5.洗涤液 6~9.咪唑洗脱液,浓度(mmol·L-1)分别为20、30、50、200 M.DNA Marker
由图3A可以看出,融合蛋白Nus-hLF18-40均存在于超声上清液中,由图3B可以看出,当咪唑洗脱液的浓度为50 mmol·L-1时可以得到较高浓度的目的蛋白,且杂蛋白较少。收集含目的蛋白的该洗脱液后,用超滤离心管浓缩除盐,Bradford法测定其蛋白浓度为4.62 mg·mL-1。
2.3 融合蛋白Nus-hLF18-40的裂解
用肠激酶切割融合蛋白可将hLF18-40与Nus分离,理论上肠激酶切割后的Nus为60.4 kDa、hLF18-40为2.8 kDa,取肠激酶酶切液进行Tricine-SDS-PAGE分析;同时将化学合成的hLF18-40溶解于磷酸盐缓冲溶液(pH值7.0)中,得到的0.4 mmol·L-1蛋白溶液作为对照,为了突出比较多肽的大小,将一条相同浓度的2 kDa的人乳铁蛋白肽作为对照,结果见图4。
由图4可以看出,肠激酶酶切液中出现了与化学合成的hLF18-40同样大小的条带,与酶切之前相比,大片段的条带有所减少,说明肠激酶已将Nus-hLF18-40完全切开,释放出了hLF18-40。
2.4 人乳铁蛋白肽hLF18-40的分子改良研究
据报道,hLF18-31对E.coliATCC25922无抑制作用。为了探索具有抑菌活性的最短人乳铁蛋白肽,将hLF18-40的C末端氨基酸逐一缩短,化学合成hLF18-40~hLF18-32共9条肽。采用改进微量肉汤稀释法对以上9条肽进行抑菌活性测定,指示菌为E.coliATCC25922,结果见表1。
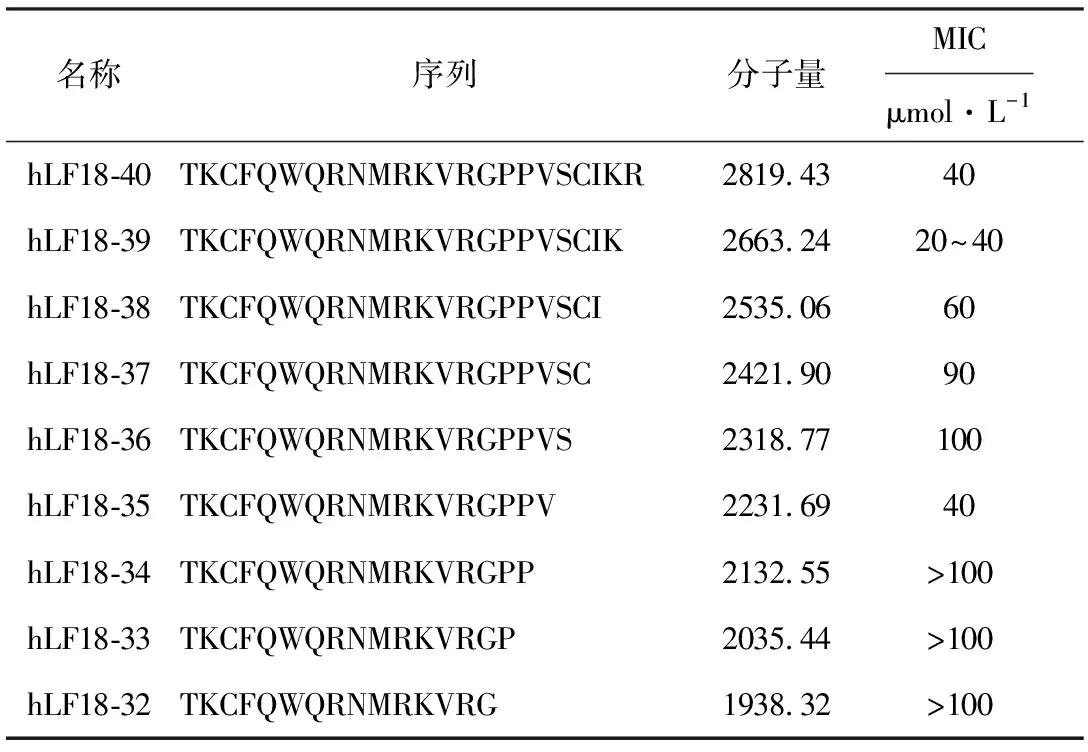
表1 抗菌肽的氨基酸序列和体外最小抑菌浓度
由表1可知,hLF18-40的C末端缩短一个氨基酸(hLF18-39)时,其抑菌活性有所上升,MIC略微降低;再继续缩短,抑菌活性逐渐下降,MIC逐渐增大;但缩至hLF18-35时,抑菌活性又突然上升,MIC与hLF18-40相同;而与其只相差一个氨基酸的hLF18-34的抑菌活性却迅速下降,直到hLF18-32,抑菌活性均较低。
2.5 讨论
首先,利用基因工程技术在大肠杆菌中表达hLF18-40,根据大肠杆菌的密码子偏爱性,采用重叠区基因扩增拼接法,设计并合成了hLF18-40的编码基因;采用融合表达策略,利用基因同源重组技术构建了hLF18-40的大肠杆菌表达质粒pET-43.1a-hLF18-40,并将质粒转入宿主菌BL21(DE3)中表达,结果显示hLF18-40在pET-43.1a(+)中获得了较高的可溶性融合表达;最后将融合蛋白Nus-hLF18-40进行Ni2+柱亲和层析,平均每升细菌培养物获得约150 mg融合蛋白,纯度达到了85%以上,经进一步的除盐和浓缩后,肠激酶切割释放抗菌肽hLF18-40,浓度约为0.76 mg·mL-1。
其次,将hLF18-40的C末端氨基酸逐一缩短直至hLF18-32,用化学法合成hLF18-40、hLF18-39、hLF18-38、hLF18-37、hLF18-36、hLF18-35、hLF18-34、hLF18-33和hLF18-32共9条人乳铁蛋白肽,采用改进微量肉汤稀释法分别测定以上9条肽对E.coliATCC25922的MIC。结果发现,去掉hLF18-40 C端的Arg后其抑菌活性有所上升(20 μmol·L-1 建立了人乳铁蛋白肽hLF18-40的大肠杆菌表达系统,模拟其重组异源表达及规模化生产的各个工艺环节,解决可能出现的技术问题,打通整条工艺路线,包括构建重组表达质粒、融合蛋白分离纯化、目的蛋白切割释放,为今后基因工程法表达人乳铁蛋白肽提供了依据;同时对hLF18-40进行分子改良,探索其活性变化,得到了具有抑菌活性的最短抗菌肽hLF18-35,为进一步提高其抑菌活性奠定了基础。 [1]冯兴军,王建华,杨雅麟,等.乳铁蛋白肽(Lactoferricin)作用机制研究进展[J].中国生物工程杂志,2004,24(1):23-26. [2]Gifford J L,Hunter H N,Vogel H J.Lactoferricin:A lactoferrin——derived peptide with antimicrobial,antiviral,antitumor,and immunological properties[J].Cell Mol Life Sci,2005,62(22):2588-2598. [3]Farnaud S, Evans R W.Lactoferrin——A multifunctional protein with antimicrobial properties[J].Molecular Immunology,2003,40(7):395-405. [4]Viejo-Díaz M,Andrés M T, Fierro J F.Different anti-Candidaactivities of two human lactoferrin-derived peptides,Lfpep and kaliocin-1[J].Antimicrob Agents Chemother,2005,49(7):2583-2588. [5]Haversen L A,Engberg I,Baltzer L,et al.Human lactoferrin and peptides derived from a surface-exposed helical region reduce experimentalEscherichiacoliurinary tract infection in mice[J].Infect Immun,2000,68(10):5816-5823. [6]Wiegand I,Hilpert K,Hancock R E W.Agar and broth dilution methods to determine the minimal inhibitory concentration (MIC) of antimicrobial substances[J].Nature Protocols,2008,3(2):163-175. [7]Jenssen H.Anti herpes simplex virus activity of lactoferrin/lactoferricin——An example of antiviral activity of antimicrobial protein/peptide[J].Cell Mol Life Sci,2005,62(24):3002-3013. [8]Strom M B,Haug B E,Rekdal O,et al.Important structural features of 15-residue lactoferricin derivatives and methods for improvement of antimicrobial activity[J].Biochem Cell Biol,2002,80(1):65-74.3 结论

