紫杉醇、硒酸酯多糖序贯给药对乳腺癌MCF-7细胞抑制作用的研究
陈春影,凌 娜,徐艳艳,季宇彬
(1.哈尔滨商业大学 生命科学与环境科学研究中心,黑龙江 哈尔滨 150076;2.国家教育部抗肿瘤天然药物工程研究中心,黑龙江 哈尔滨 150076)
乳腺癌现已成为我国女性发病率最高的恶性肿瘤之一,严重威胁女性的生命健康。开发对乳腺癌患者更合理、更有效的治疗方法是我们关注的焦点[1]。近些年的研究表明,细胞增殖和凋亡的平衡决定着乳腺癌组织对放、化疗及肿瘤药物的反应性。因此,不同药物对乳腺癌细胞生长抑制情况及药物作用机制的深入研究,可为临床上对乳腺癌的治疗提供有效的依据[2]。紫杉醇(paclitaxel,Taxol)是一种促进细胞微管聚合、抑制微管解聚的新型抗肿瘤药。目前临床上已被用于治疗卵巢癌、肺癌和乳腺癌[3]。硒酸酯多糖又称硒化卡拉胶(k-selenocarrageenan,KSC),研究发现KSC在体内外具有显著的抗肿瘤免疫调节作用。可抑制肿瘤细胞增殖、诱导细胞凋亡、增强免疫功能,并且能降低化疗药物的毒副作用[4]。本实验采用MTT法、SRB法及流式细胞仪体外观察Taxol与KSC联合给药对乳腺癌MCF-7细胞生长的抑制作用,并探讨两者联合的作用机制。
1 材料与方法
1.1 材料
细胞:乳腺癌 MCF-7;试剂:RPMI1640培养基(GIBCO BRL生产),胎牛血清(杭州四季青),硒酸酯多糖(上海天赐福生物工程有限公司,含硒量1.68%),紫杉醇(成都天源天然产物有限公司),噻唑蓝(MTT)、二甲基亚砜(DMSO)、磺酰罗丹明B(SRB)均为sigma公司产品。仪器:酶标仪(美国Bio-Rad公司),CO2培养箱(美国NBS公司),倒置显微镜(日本OLYMPUS公司),流式细胞仪(美国BECKMAN-COULTER公司),超净工作台(苏州净化设备厂),分析电子天平(Sartorius),TDL80-2B低速离心机(上海安亭科学仪器厂)。
1.2 方法
1.2.1 细胞培养
肿瘤细胞培养于RPMI-1640培养基中,含10%新生胎牛血清(56℃、灭活 30min)青霉素 100IU/mL,链霉素100U/mL。在孵化箱传代培养。
1.2.2 MTT法检测 KSC、Taxol序贯给药对乳腺癌MCF-7细胞抑制作用
用胰蛋白酶消化细胞,调整浓度至2×104个/mL细胞悬液,按2000个/孔接种于96孔板中。24h后加入不同浓度的药物,KSC(30mg/L)、Taxol(0.5、1、2、4nmol/L),同时给药组(30mg/L KSC+各浓度Taxol)、序贯给药组1(先30mg/L KSC-24h后+各浓度Taxol)、序贯给药组2(先各浓度Taxol-24h后+30mg/L KSC)。给药时间为48h、72h后,每孔加100μL的 MTT,继续培养4h后,加 DMSO 150μL,微量振荡器摇匀,用酶标仪在参考波长490nm,检测波长570nm条件下测定OD,用如下公式计算药物对肿瘤细胞的抑制率,并计算IC50。
抑制率(%)=(对照组平均OD值-加药组平均OD值)/对照组平均OD值×100%
1.2.3 SRB法检测 KSC、Taxol序贯给药对乳腺癌MCF-7细胞抑制作用
用胰蛋白酶消化细胞,调整浓度至2×104个/mL的细胞悬液,接种于96孔板中。24h后加入不同浓度的药物,给药浓度同上。培养48h、72h。弃上清液,加50%三氯乙酸(TCA)液,4℃固定lh,弃固定液,用双蒸水洗5遍,干燥后加4mg/mL SRB染液,室温放置30min;弃染液用l%醋酸洗5遍,室温干燥,加10mmoL/L的Tris缓冲液,10min后测OD值,计算细胞50%生长抑制所需的药物质量浓度(GI50),细胞完全生长抑制所需的质量浓度(TGI),杀死50%细胞所需的药物质量浓度(LG50)。
1.2.4 流式细胞仪检测MCF-7细胞周期及细胞凋亡率
对数生长期的细胞消化后,调整浓度至3×105个/mL的细胞悬液,接种于6孔板。24h后加入不同浓度的药物,Taxol(0.5nmol/L),KSC(30mg/L),0.5nmol/L Taxol+30 mg/L KSC,先30mg/L KSC-24h后+0.5nmol/L Taxol,0.5nmol/L Taxol-24h后+30mg/L KSC培养48h。胰酶消化,PBS洗涤后,加入70%冰乙醇固定。检测前PBS冲洗细胞,调整细胞浓度为106/mL,加入800μL PI染色液(终浓度为50mg/L),混匀,室温避光染色30min,300目尼龙网过滤后流式细胞仪检测,激发波长488nm,发射波长520nm测定细胞周期和凋亡率。
1.2.5 统计学处理
2 结果
2.1 MTT法检测KSC、Taxol序贯给药对乳腺癌MCF-7细胞增殖影响
KSC、Taxol单独可明显抑制乳腺癌MCF-7细胞生长,其抑制率随药物浓度、作用时间增加而升高,具有时间和剂量依赖性,与对照组相比差异显著(P<0.01);联合用药组与对应浓度的单一用药组相比,对MCF-7细胞作用更加显著,联合作用于 MCF-7细胞72h的IC50值是0.2561 nmol/L,远小于 Taxol单独作用浓度(1.7734nmol/L)。序贯给药组与对应浓度单一用药组相比,对MCF-7的抑制作用明显。序贯给药组2(先Taxol后KSC)优于序贯给药组1(先KSC后Taxol),同时用药组显著优于序贯给药作用效果(见图1、2)。

图1 MTT法检测Taxol作用48h对MCF-7细胞增殖影响
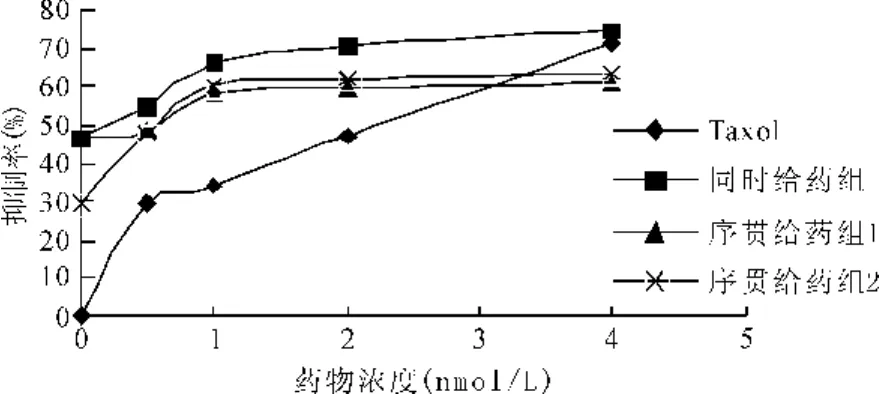
图2 MTT法检测Taxol作用72h对MCF-7细胞增殖影响
实验结果显示,30mg/L KSC与0.5~2nmol/L Taxol同时应用表现协同作用(q>1.15),与4nmol/L Taxol表现为相加作用(q=0.85~1.15)。序贯给药组1(先给KSC后给Taxol)表现是拮抗作用(q<0.85),序贯给药组2(先给Taxol后给KSC)表现是相加作用(q=0.85~1.15)(见表1)。
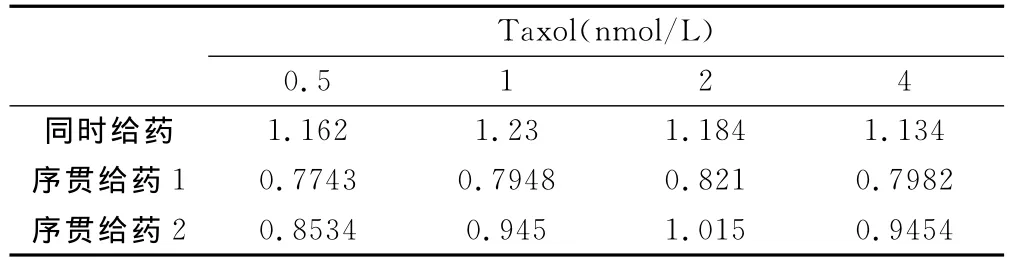
表1 30mg/L KSC与Taxol联合作用q值
2.2 SRB法检测KSC、Taxol序贯给药对乳腺癌 MCF-7细胞增殖影响
SRB法检测KSC、Taxol单独及联合作用48h对乳腺癌 MCF-7细胞的GI50、LG50、TGI值结果如表2。

表2 KSC、Taxol序贯给药对MCF-7细胞生长的影响(SRB)
2.3 流式细胞仪检测KSC、Taxol序贯给药对MCF-7细胞周期及凋亡率影响
FCM结果显示,药物对 MCF-7细胞作用48h,与空白组相比,Taxol作用组G1期细胞比例增多,S和G2/M期细胞减少;KSC作用组G1期细胞比例减少,G2/M期略有上升,S期增加;联合给药组较单独给药效果更明显,G1期比例明显下降,G2/M期和S期细胞明显增加,表明Taxol使MCF-7细胞阻滞在G1期,KSC阻滞在S期,联合给药组使细胞阻滞在G2/M期和S期(图3)。KSC与Taxol单独及联合作用对MCF-7细胞均有凋亡现象,联合给药组凋亡率小于Taxol单独给药组。

图3 KSC、Taxol序贯给药对 MCF-7细胞周期及凋亡率的影响
3 讨论
硒酸酯多糖是一种新型有机硒化合物,具有免疫调节、抗肿瘤和降低化疗药物毒副作用等多重生物功效,可诱导人乳腺癌、白血病、肝癌等多种肿瘤细胞凋亡。赖洵等[5]发现联合用药组杀伤力高于单用药组且联合用药的凋亡峰高于单用药物。李新莉等[6]发现紫杉醇单独及与VC联合均抑制MCF-7生长,将细胞阻滞在G2/M期及诱导细胞凋亡,给药顺序影响药物作用效果。凌娜等[7]发现KSC与Taxol均能抑制HepG2细胞增殖,具有时效-量效关系,联合组效果优于单一用药组。流式细胞术显示两药均作用于S期,联合组既可在S期发生周期阻滞现象,又可诱导凋亡。Shashi Mehta等[8]发现两药联合使细胞阻滞于G2/M和S期。
本研究结果显示KSC与Taxol同时给药效果更佳。KSC与Taxol同时合用时,既可产生协同效果,又可避免大剂量Taxol对病人产生毒副作用,提高对化疗药物耐受性。序贯给药组1(先KSC后Taxol)表现序贯拮抗效应,原因可能由于先加入KSC抑制细胞增殖,使细胞处于非增殖状态,而非增殖期细胞对Taxol较耐受引起的。序贯给药2(先Taxol后KSC)可产生相加作用,原因可能是Taxol主要阻断细胞从G0-G1期向S期转化,而S期细胞则为KSC敏感杀伤时期之一,这样KSC就可有效地杀伤那些侥幸逃过了G0-G1期Taxol对其产生杀伤作用而进入S期细胞。在G0-G1和S期两期同时对细胞产生杀伤作用,由此产生序贯相加。流式细胞仪分析单一及联合给药对MCF-7细胞周期及凋亡率的影响,结果表明Taxol单独作用与对照组相比0.5~2nmol/L对 MCF-7作用在G1期,4~8nmol/L作用在G2/M和S期。Taxol与KSC联合给药对 MCF-7细胞表现为作用在G2/M和S期,既出现凋亡峰又出现G2/M和S期周期阻滞现象,同时给药组凋亡率高于序贯给药组,Taxol单独给药组凋亡率高于联合给药组,两药具有协同作用。因此,Taxol与KSC两药共同作用产生协同效应,提示了临床应用的可能性,同时联合作用的时间和顺序也是临床医生必需考虑和注意的问题。
[1]钟英,孙强,徐雅莉,等.30年乳腺癌治疗趋势的变化[J].中国普外基础与临床杂志,2009,11(16):911-916.
[2]蔡莉,臧家兰,随广杰.乳腺癌中抗凋亡基因研究现状[J].中国肿瘤临床,2008,35(14):837-840.
[3]余元龙,季明芳,何洁冰,等.紫杉醇、5-氟脲嘧啶抑制肝癌细胞BEL-7402生长和诱导凋亡的比较[J].第一军医大学学报,2005,25(7):864-867.
[4]张哲文,魏虎来,苏海翔.硒酸酯多糖的免疫调节与抗肿瘤作用[J].兰州大学学报:医学版,2005,31(2):88-91.
[5]赖洵,华映坤,沈晓梅,等.紫杉醇联合INF-a-2b对 K562细胞的诱导凋亡作用[J].实用癌症杂志,2003,6(18):586-588.
[6]李新莉,何栋成,黄苏君,等.维生素C和紫杉醇联合作用对乳腺癌MCF-7增殖、细胞周期和凋亡的影响[J].营养学报,2011,31(1):40-48.
[7]凌娜,邓丹,陈春影,等.硒酸酯多糖与紫杉醇联合应用对肝癌HepG-2细胞生长的抑制作用[J].中国海洋药物杂志,2010,29(4):34-38.
[8]SHASHI MEHTA,DILSHAD BLACKINTON,IMRAN OMAR,et al.Combined cytotoxic action of paclitaxel and ceramide against the human Tu138head and neck squamous carcinoma cell line[J].Cancer Chemother Pharmacol,2000,46:85-92.

