LINE-1 ORF-1p过表达对肝癌细胞株SMMC7721增殖和锚定非依赖性生长的影响*
高旭东 陆荫英 冯帆 王春平 王 常秀娟 杨永平
研究证实反转座子LINE-1,又称长散布核元件(Long Interspersed Nucleotide acids Element-1,L1),与肿瘤的发生密切相关。在正常成体组织和细胞中L1均处于沉默状态,其主要相关机制是启动子区的甲基化修饰和RNAi,但在生殖细胞、胚胎细胞发育早期及肿瘤细胞中,L1启动子发生去甲基化[1~3],进而被广泛激活,引发反转座的发生,并调控相关宿主基因表达,从而影响细胞增殖、分化、凋亡等生物学行为。此外,L1的表达与反转座还能够对基因组产生相当的破坏,如诱发突变和基因组的不稳定性[3~5],在大多数恶性肿瘤细胞中呈明显高表达[6],与肿瘤细胞的生物学特性密切相关[7]。人的L1基因长约6 kb,分别编码开放读码框 -1p(open reading frame-1p,ORF-1p)和ORF-2p两个蛋白。ORF-2p自身具有核酸内切酶活性,能切割靶基因位点并以靶基因DNA为引物,以自身RNA为模板在其自身反转录酶活性作用下完成反转座过程[7];而ORF-1p则与RNA以及单链DNA有高亲和力,是ORF-2p调节反转座必要的伴侣,被认为与肿瘤细胞中L1的高表达及促进肿瘤细胞的增殖密切相关[8]。
本研究利用带Flag标签的L1 ORF1p表达载体,研究在肝癌细胞SMMC7721中表达的ORF-1p对肿瘤细胞生物学特性及肝癌相关调控蛋白报告基因表达的影响,结果发现L1 ORF1p能够单独发挥作用,参与调节肿瘤细胞的增殖,为阐明各种肿瘤的发生机制开辟了一个新的思路。
材料与方法
一、细胞与试剂 肝癌细胞SMMC7721、大肠杆菌 DH5α、pCDNA3.0-Flag-ORF1、pCDNA3.0-Flag、p15-luc、p21-luc和p53-luc报告基因等由军事医学科学院八所七室保存并提供。质粒提取试剂盒和MTT为Ameresco公司产品。其他包括DMEM(Gibco公司)、胰酶(Ameresco)、特级胎牛血清(Gibco公司)、细胞转染试剂(LipofectAMINE 2000 Invitrogen公司)、抗L1-ORF1p单克隆抗体(本室自制)、兔抗GADPH 多克隆抗体(Sigma公司)和辣根过氧化物酶偶联的羊抗兔IgG(Santa Cruz公司)等。
二、细胞转染 复苏SMMC7721细胞,接种到6cm平皿中,使用含10%小牛血清的DMEM培养基,在37℃,5%CO2常规条件下培养。当细胞密度达到80%时,使用Lipofectamine 2000按照说明书所述方法转染pCDNA3.0-Flag-ORF1表达载体和相应空载体,转染48h后收集细胞。
三、Western blotting检测细胞L1 ORF1p的表达 收集细胞,加入50μL SDS-裂解缓冲液,煮沸10 min变性,将上述变性的细胞总蛋白离心后取上清进行12.5%SDS-PAGE电泳。电泳结束后,将蛋白转移至硝酸纤维素膜上,用5%脱脂奶粉(用1×TBST配制)于室温下进行封闭1h,然后加入兔抗ORF-1p单克隆抗体(1:500),室温轻摇1h,用TBST洗膜3次,然后加入辣根过氧化物酶偶联的羊抗兔IgG(1:5000),于室温下孵育1h后,用TBST洗膜3次,最后加入化学发光底物1ml,室温下作用5min,将膜放到曝光盒内,在暗室中取出感光胶片加盖在膜上,压盖曝光10s后冲洗胶片。另检测内参蛋白GADPH表达,方法同前,其中的一抗为兔抗GADPH多克隆抗体。
四、细胞增殖检测 取SMMC7721细胞铺于96孔培养板中,分别转染Flag-ORF1表达载体和相应空载体,采用MTT法对活细胞计数,以平均值绘制生长曲线。
五、肿瘤细胞软琼脂成集落实验 取SMMC7721细胞,分别转染表达载体和相应空载体。预先配置1.2%和0.7%的琼脂溶液,灭菌。预先用1.2%琼脂铺平皿,待其凝固,备用。培养转染的SMMC7721细胞,24h后用配置20%血清的两倍DMEM重悬细胞,取细胞(1×104个)悬液,与0.7%琼脂溶液等体积混合,加于上层。培养17~20日,观察、计数。
六、Luciferase报告基因转录活性测定 利用荧光素酶和β-半乳糖苷酶活性测定方法检测p21、p15和p53报告基因转录活性。取SMMC7721细胞,分别转染表达载体和相应空载体,同时转染各种报告基因以及表达β-半乳糖苷酶质粒,转染24h后,收集并震荡裂解细胞,离心收集上清,分别测荧光素酶活性及β-半乳糖苷酶活性,间接评价各种报告基因的转录活性。
七、统计学处理 采用SPSS13.0统计分析软件,数据以±s表示,组间差异采用t检验,P<0.05被认为有统计学意义。
结果
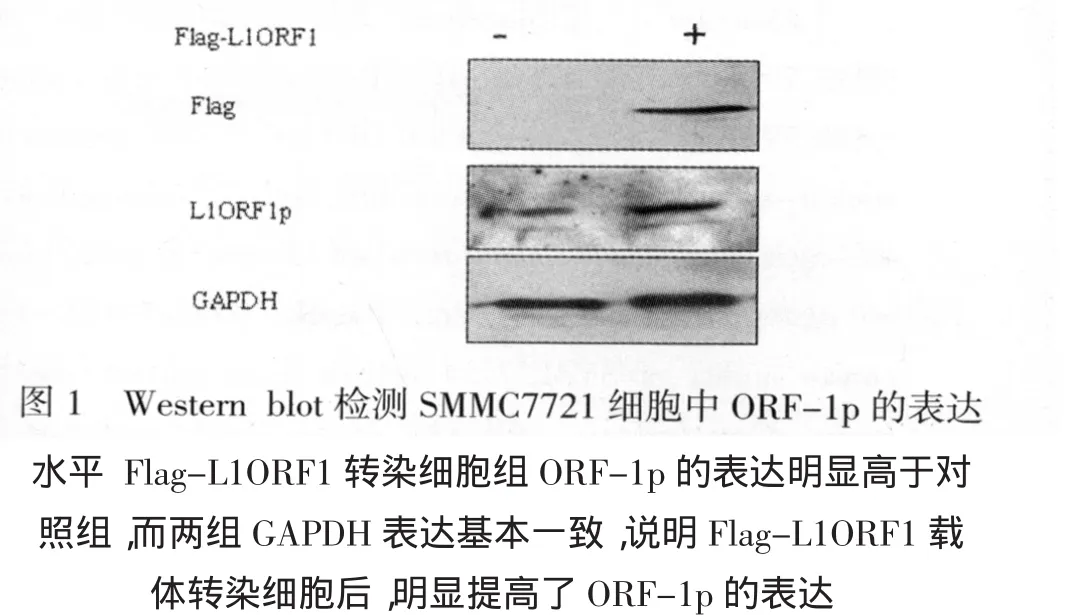
一、L1 Flag-ORF-1p能够在SMMC7721细胞中表达 肝癌细胞SMMC7721转染Flag-L1ORF1后,应用Western blot法检测各组细胞ORF-1p的表达水平。结果发现,Flag-L1ORF1转染细胞ORF-1p的表达明显高于对照组(P<0.05,图 1)。
二、ORF-1p能够促进肝癌SMMC7721细胞的生长 在实验组细胞表达ORF1p后,细胞增殖能力明显强于对照组(P<0.05,图 2),说明 ORF1p 能促进肿瘤细胞的生长。

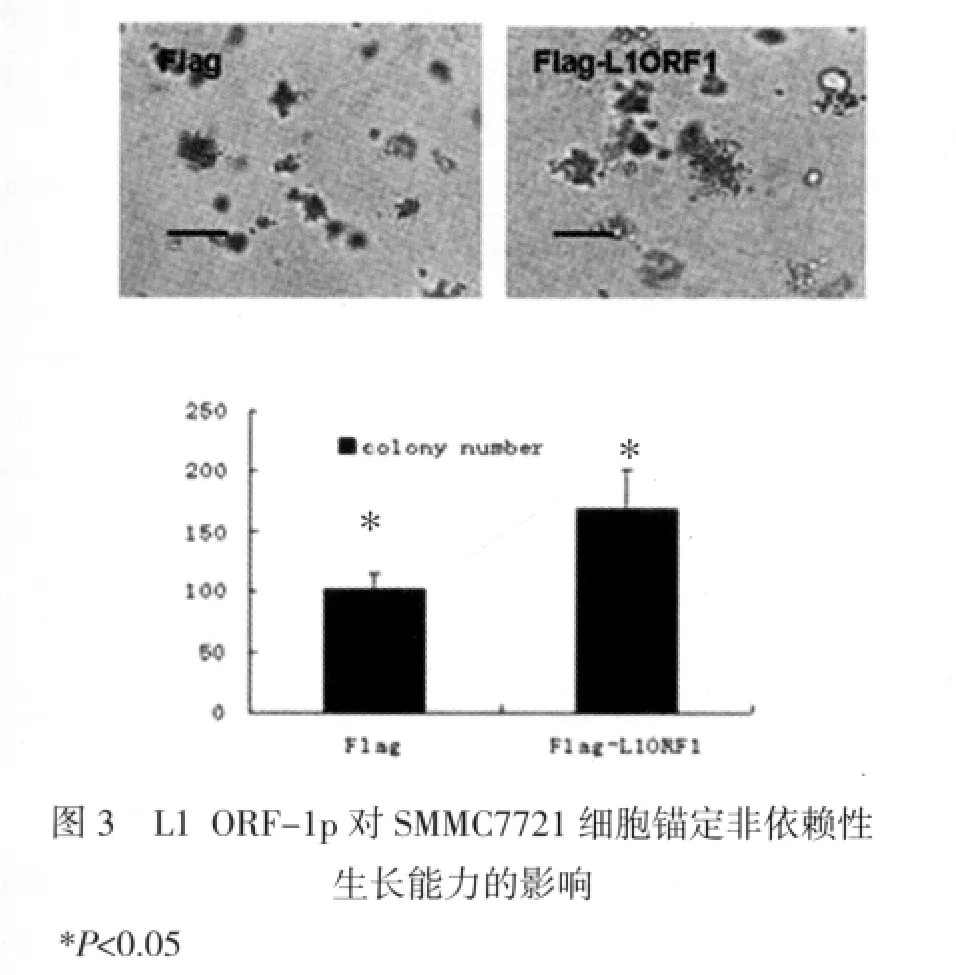
三、ORF-1p能够促进SMMC7721细胞的锚定非依赖性生长(anchorage-independent growth) 锚定不依赖性生长是肿瘤细胞的特性之一,也是其发生转移的前提。将SMMC7721细胞转染Flag-L1ORF1表达载体和相应空载体,24h后进行软琼脂成集落实验,检测细胞的集落大小和数量,能反应SMMC7721细胞锚定非依赖性生长能力的改变。结果显示:ORF-1p能够显著增大SMMC7721细胞集落的数量和面积(P<0.05,图 3)。
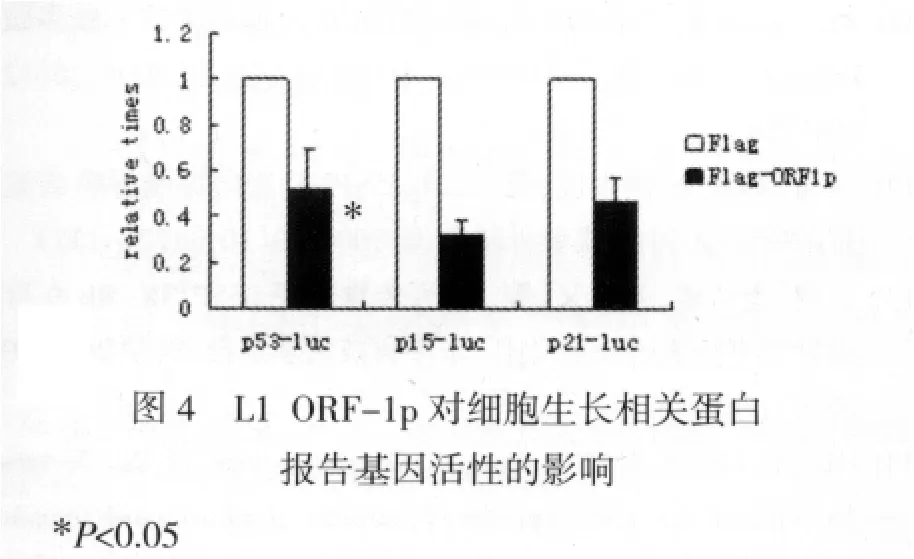
四、L1 ORF-1p能够影响细胞增殖相关基因的表达 我们选择与肝癌细胞生长密切相关的p21、p15和p53基因,对其转录活性进行检测,以对应孔荧光素酶活性与β-半乳糖苷酶活性比值作为其转录活性的相对水平。其中,β-半乳糖苷酶起着校正细胞转染效率的作用。实验结果表明,细胞过表达ORF1p后,p53、p15和p21等报告基因的转录活性均有不同程度的降低(P<0.05,图 4),可能系 ORF1-1p 抑制了它们的表达。
讨论
随着功能基因组研究的深入,过去曾被称作“垃圾DNA”的反转座子L1由于与肿瘤形成、进展密切相关而逐渐受到关注。在其编码的两个蛋白ORF-1p和ORF-2p中,ORF2p已被证实与L1反转座过程密切相关,而ORF-1p大小仅40kDa,表达量远远高于ORF2p,与其它任何蛋白缺乏序列相似性,其功能尚不十分清楚。
为研究ORF-1p在肿瘤细胞中的具体作用,我们曾利用RNAi干扰技术降低肺癌细胞A549 ORF1p的表达,发现A549细胞生长减慢,成瘤能力明显减弱[9]。由此我们推测,L1 ORF-1p具有促进肿瘤细胞增殖和侵袭的能力。为明确L1 ORF-1p是否与肝细胞癌的发生、发展相关,在本研究中,我们设计构建了L1 ORF-1p相关表达载体并进行了相关研究。我们将构建好的pCDNA3.0-Flag-ORF1真核表达载体在肝癌细胞系SMMC7721中表达,经检测表明,在实验组ORF1p的表达明显高于对照组,证实L1 Flag-ORF-1p能够在SMMC7721细胞中表达。进一步检测显示在SMMC7721细胞,过表达ORF-1p能使细胞的增殖能力明显增强;同时软琼脂锚定的克隆形成试验显示,实验组细胞的集落形成能力明显增加,表现为集落形成数目增加,集落体积增大。由上述实验可以看出,ORF-1p能促进细胞增殖和锚定生长。
野生型p53(wtp53)蛋白能够调节p21和p15等多个基因的表达,从而控制细胞增殖、抑制细胞转化,阻止癌变过程。在细胞受损后p53通过停止细胞分裂或者触发分子信号级联反应造成细胞凋亡来保护机体。p21属于CKIs中的Cip/Kip家族成员,能与CDK结合而抑制CDK的活性[10]。有报道p21可以抑制SMMC-7721细胞的细胞周期进程,对抗凋亡的发生,并参与肝癌的侵袭转移过程。p15是CDK4的负调控因子,能特异性地抑制细胞周期依赖激酶CDK4/CDK6活性,抑制Rb蛋白磷酸化,从而抑制细胞的增殖,同时P15也是TGF-β介导的诱导分化和生长抑制的效应因子,p15基因失活可导致细胞逃避TGF-β介导的生长抑制作用[11]。因此,p53、p15和p21基因的表达与肝癌细胞的增殖和侵袭密切相关,上述癌基因的表达失活将使细胞失去正常的生长调控,促进肿瘤形成和进展。因此,我们利用Luciferase报告基因活性测定法进一步检测在L1 ORF-1p过表达的SMMC-7721细胞中p53、p15和p21报告基因的转录活性,结果显示L1 ORF-1p的表达能够明显降低p53、p15和p21报告基因的转录活性,从而抑制相关蛋白质产物的表达,影响下游调控作用的发挥。由此我们推测:ORF-1p有可能在细胞中通过影响p21、p53和p15等的表达,促进细胞增殖和肿瘤侵袭。
[1]ROMAN-GOMEZ J,JIMENEZ-VELASCO A,AGIRRE X,et al.Promoter hypomethylation of the LINE-1 retrotransposable elements activates sense/an tisense transcription and marks the progression of chronic myeloid leukemia[J].Oncogene,2005,24:7213-7223.
[2]GOODIER JL,ZHANG L,VETTER MR,et al.LINE-1 ORF1 protein localizes in stress granules with other RNA-binding proteins,including components of RNA interference RNA-induced silencing complex[J].Mol Cell Biol,2007,27:6469-6483.
[3]PORNTHANAKASEM W,KONGRUTTANACHOK N,PHUANGPHAIROJ C,et al.LINE-1 methylation status of endogenous DNA double-strand breaks[J].Nucleic Acids Res,2008,36(11):3667-3675.
[4]GASIOR SL,WAKEMAN TP,XU B,et al.The human LINE-1 retrotransposon creates DNA double-strand breaks[J].J Mol Biol,2006,357:1383-1393.
[5]XING J,ZHANG Y,HAN K,et al.Mobile elements create structural variation:analysis of a complete human genome[J].Genome Res,2009,19:1516-1526.
[6]ESTECIO MR,GHARIBYAN V,SHEN L,et al.LINE-1 hypomethylation in cancer is highly variable and inversely correlated with microsatellite instability[J].PLoS ONE,2007,2(5):e399.
[7]SINIBALDI-VALLEBONA P,LAVIA P,GARACI E,et al.A role for endogenous reverse transcriptase in tumorigenesis and as a target in differentiating cancer therapy[J].Genes Chromosomes Cancer,2006,45(1):1-10.
[8]MARTIN SL.The ORF1 protein encoded by LINE-1:structure and function during L1 retrotransposition[J].J Biomed Biotechnol,2006,2006(1):45621.
[9]高旭东,胡明明,朱运峰.下调LINE-1编码蛋白ORF-1p对肺癌细胞A549生物学特征的影响 [J].中国生物工程杂志,2010,30(6):14-20.
[10]BUNZ F,DUTRIAUX A,LENGAUER C,et al.Requirement for p53 and p21 to sustain G2 arrest after DNA damage[J].Science,1998,282(5393):1497-1501.
[11]SCOTT MT,MORRICE N,BALL KL.Reversible phosphorylation at the C-terminal regulatory domain of p21(Waf1/Cip1)modulates p roliferating cell nuclear antigen binding[J].J Biol Chem,2000,275(15):11529-11537.

