乙型肝炎病毒rtN238H变异与阿德福韦酯耐药的相关性研究*
朱华 钟彦伟 许智慧 刘佳慧 刘妍 苏何玲 徐东平
研究表明,应用阿德福韦酯(ADV)1年、2年、3年、4年和5年的相关耐药突变累积发生率分别为0%、3%、11%、18%和 29%[1]。目前,明确的 ADV经典耐药变异有rtN236T和 rtA181V,这两种变异单独或联合出现后可引起HBV对ADV的敏感性下降2~20倍,引起病毒学和生化学反跳[2~4]。还有一些与ADV耐药相关变异的报道,但未被公认,被称为提议(proposed)、次要(minor)或争议(debating)变异,包括rtV84M、rt181T、rtV214A、rtQ215S、rtL217R、rtI233V 和rtN238D/T等[5,7]。如果对ADV的敏感性下降仅3倍(其他3种药物均在50倍以上)即可引起临床耐药,使表型耐药分析结果不易判断[8]。我们在对HBV感染患者的检测中发现,在rtN238位点上rtN238H变异较rtN238D/T更为常见,且在ADV经治患者中的检出率高于ADV未治患者。本文对HBV rtN238H进行了进一步分析研究,以明确该变异是否与ADV耐药有关。
对象与方法
一、研究对象 2005年~2010年期间解放军第302医院收住的慢性乙型肝炎和乙型肝炎肝硬化患者1789例,均接受了HBV DNA序列测定。另于2005年12月收住慢性乙型肝炎患者(男,33岁)1例,取血进行HBV表型耐药分析,患者HBsAg、HBeAg和抗-HBc阳性,HBV DNA阳性,给予ADV(美国葛兰素公司)治疗,病情逐渐好转,纳差症状消失,谷丙转氨酶(ALT)和谷草转氨酶(AST)恢复正常,HBV DNA转为阴性。2007年8月患者自行停用ADV,20天后再次出现乏力纳差表现,血清HBsAg、HBeAg、抗-HBe和抗 -HBc阳性,总胆红素 /直接胆红素(T/DBIL)21.3/7.2μmol/L,ALT 557U/L、AST 188U/L,HBV DNA 7.295×105copies/mL。于2007年10月再次入院,给予ADV治疗,病情未见好转,HBV DNA仍为4.40×103copies/ml,HBV DNA序列测定检出rtN238H变异,未检出rtA181V、rtN236T或其它经典耐药变异,前C/BCP区有A1762T+G1764A双联变异,无G1896A变异;其HBV基因型分型为C型。
二、HBV DNA序列测定 HBV基因扩增的单管巢式PCR方法为我室建立,扩增测序的两个基因片段(nt 541378、nt 15832227)分别包括了HBV逆转录酶区和前C/基本核心启动子区。根据测序结果进行HBV基因变异分析和基因分型[9,10]。
三、HBV基因定点突变 提取血清HBV DNA,经巢式PCR扩增后克隆到pGEM-Teasy载体中(美国Promega公司),根据需要合成定点变异引物,将rtN238H回复突变为野生序列。采用的定点试剂为美国Applied Biosystems公司产品,引物序列和定点突变操作按照我室以前发表的文献方法进行[11]。随机挑选3~5个克隆测序,获得该患者HBV野生株(wt)。
四、病毒表型耐药与体外复制力检测 取HepG2细胞购于美国模式培养物集存库(ATCC),经DMEM(含 10%FBS,青霉素 100U/ml,链霉素 10μg/ml)培养;转染试剂 FuGENE HD Transfection Reagent购于Roche公司,pTriEx-HBV1.1表达载体由法国里昂大学Zoulim教授惠赠,HBV载量荧光定量试剂盒为上海复兴医学科技发展有限公司产品。提取含有HBVT基因的质粒,用Xho I和Nco I双酶切目的基因片段及pTriEx-HBV1.1表达载体,电泳后回收目的基因片段(1250bp)及pTriEx-HBV1.1表达载体片段,连接后转化大肠杆菌,随机挑取克隆进行测序,确定HBV表达载体构建成功。将ADV溶于DMSO,配制成浓缩液(10mmol/L),临用前稀释成所需浓度。将HepG2细胞接种于24孔板(10万/孔),18小时后每孔转染0.25μg质粒,5小时后,细胞用1×PBS洗3遍,加入含不同浓度的培养液培养(ADV的浓度为 0、0.033、0.1、0.33、1.00和3.33μmol/L),隔天换液一次。换液后2天,收集细胞培养上清,用DNase消化游离DNA后,加入终浓度为5mmol/LEDTA 75℃15min灭活DNase,裂解释放Dane颗粒中的DNA,进行定量检测,计算药物的半数有效浓度(EC50)值,变异与野生株的EC50比值代表对药物敏感性的改变程度,未加药孔细胞上清HBV DNA水平代表病毒的复制力水平。
结果
一、rtN238H变异发生率情况 在1789例慢性乙型肝炎患者中,共在rt238位点上检出各类变异231例(12.9%),其中 rtN238H变异 181例(10.1%),后者16例(0.89%)与经典ADV耐药变异(rtN236V/rtA181V)共存;另检出 rtN238T 10例(0.56%),rtN238D 3例(0.17%),rtN236S 19例(1.06%),rtN236X 8例(0.45%),rtN236K 5例(0.28%),rtN236Q 2例(0.11%),rtN236Y、rtN236L和rtN236A各1例(0.06%)。
在181例rtN238H变异患者中,男153例,女28例,年龄 36.7±12.9 岁,ALT 118.0±202.7U/L,TBIL 23.4±41.3μmol/L,HBV DNA载量为lg7.78±3.34copies/ml。ADV经治和未治患者分别为130例(71.8.%)和51例(28.2%),其中对ADV治疗产生临床应答(含部分应答)的占82.3%(107/130),无应答或出现病毒学反跳的占17.7%(23/130)。181例中HBV B基因型感染为151例(83.4%),C基因型感染为30例(16.6%)。
二、病毒复制力与表型耐药情况 将含有rtN238H变异和对应的野生型序列的HBV表达载体瞬时转染HepG2细胞,并经ADV处理,取转染细胞分泌培养上清进行定量,取3次独立实验的平均值(表1)。按照不同ADV药物浓度计算N238H变异株EC50=0.10±0.07μmol/L,回复突变野生株 EC50=0.08±0.04μmol/L,变异株是野生株的1.25倍(图 1)。
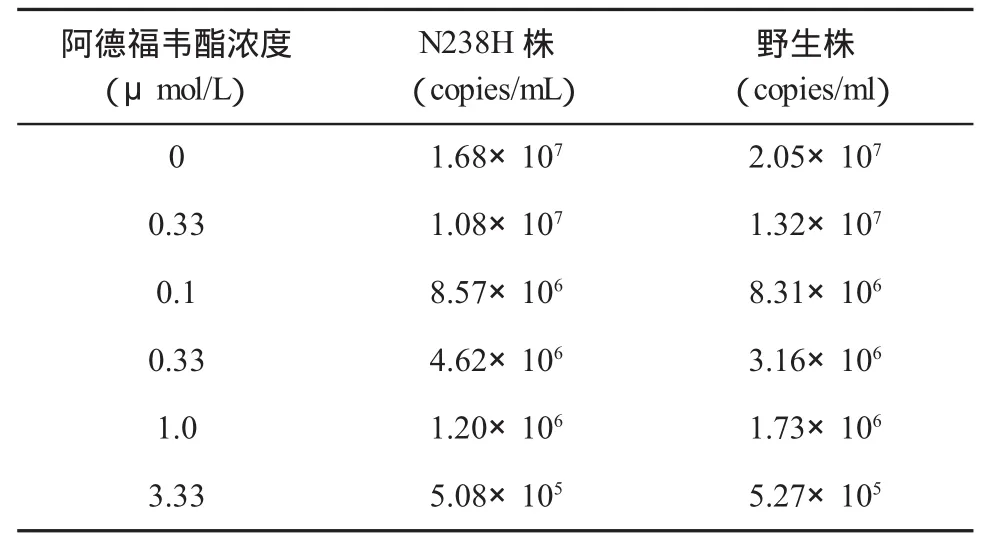
表1 rtN238H变异株和野生株在不同药物浓度下的复制水平

图1 阿德福韦对HBV rtN238H变异株和野生株抑制率的比较
讨论
由于在HBV复制过程中存在逆转录过程,其多聚酶/逆转录酶缺乏纠错能力,容易产生变异(大约为10-7/核苷酸/天),但由于HBV基因组各读码框架间存在编码基因共用,使变异对病毒产生损害的机率增加;变异病毒需要进入其生命周期中独特的cccDNA池才能相对稳定,因而HBV变异株的产生机率又低于HCV、HIV等RNA病毒[12]。核苷(酸)类药物长期应用,可以使对环境压力适应力强的变异病毒获得适应性突变和选择性扩增,或使已存在于准种群中的极少量变异株获得选择性扩增,产生的变异如果引起病毒对药物敏感性的显著下降,被称为原发耐药变异;如变异虽不影响药物敏感性,但可显著增强耐药变异株的复制力,被称为复制力补偿变异。这两种类型的变异均对临床耐药具有意义。耐药相关病毒变异具有以下几个特征:①与应用治疗药物相关;②临床上出现病毒学反弹和(或)病情反复;③表型耐药分析能证明变异病毒对治疗药物的敏感性降低或引起病毒复制力增强;④可能出现在多个病例;⑤停药后病毒有可能恢复为野生型[13]。
我们在对临床大样本的HBV进行变异检测中发现rtN238H有较高的发生率,同时注意到有文献报道该位点发生的rtN238D和rtN238T变异与ADV耐药相关。为此,我们对rtN238H与ADV耐药相关性进行了分析。结果表明,HBV rtN238H变异的检出率为10.1%,明显高于 rtN238T(0.56%)和 rtN238D(0.17%),且ADV经治患者中rtN238H变异的检出率明显高于ADV未治患者。为此,我们通过表型耐药和体外复制力分析实验进一步明确该变异是否与阿德福韦耐药相关,但结果表明,rtN238H变异株的体外复制力与野生株接近,对ADV的EC50值为野生株的1.25倍,而文献报道引起ADV耐药变异EC50值至少升高2倍,我们对经典的rtN236T变异株和A181V变异株的表型耐药分析结果也显示它们的ADV EC50较野生株上升了3~18倍,说明rtN238H变异对ADV耐药无直接联系。从临床应答分析,该患者虽然产生了rtN238H变异,但ADV治疗期间患者血清HBV病毒载量从7.295×105copies/ml下降至 4.4×103copies/ml,病毒未能转阴的原因可能与ADV抑制病毒效果相对较弱有关。在所有检出rtN238H变异的ADV经治患者(181例)中,临床取得完全或部分应答的占82.3%,也提示rtN238H与ADV耐药可能没有直接的关系。
本研究选择克隆了一个代表病例HBV rtN238H变异株,同时通过回复点突变获得了与变异株背景序列完全相同的野生株。本文采用pTriEx-HBV1.1和HepG2细胞系统用于瞬时表达HBV进行病毒复制力和表型耐药测定,该系统可以获得较高的病毒复制表达水平,便于进行表型耐药分析[14]。我们建立了时实荧光定量PCR方法进行表型耐药分析,对拉米夫定等经典耐药变异的表型耐药分析取得了良好的效果[15]。用细胞培养上清HBV DNA定量进行表型耐药分析已在一些研究中应用[3,16,17]。我们通过对多种典型耐药变异HBV的表型耐药分析,表明定量检测上清病毒与定量检测核心颗粒来评估病毒水平的结果一致性良好(结果未列出)。
在研究中我们发现在rtN238H变异,B基因型感染的比例为83.4%,而C基因型为16.6%,而总样本中C基因型感染患者占到80%,远远高于B基因型感染患者。国内外不少研究表明C基因型感染较B基因型感染更易发生慢性化和肝癌。我们的研究表明在我国北方地区,HBV C2基因型/B2基因型感染在急性肝炎、慢性肝炎、肝硬化、慢加急性肝衰竭和肝癌患者中的比值分别为 1.7、5.7、7.5、8.0 和 15.3[18]。但 rtN238H 变异是否对不同基因型感染的临床意义产生影响尚待进一步研究。总之,本研究也为分析临床检出的HBV特殊变异形式与耐药的相关性建立了方法学基础,通过对大样本变异的临床资料和体外表型耐药分析证实rtN238H对ADV敏感性和复制力无直接的影响。
[1]PAPATHEODORIDIIS GV,MANOLAKOPOULOS S,DUSHEIKO G,et al.Therapeutic strategies in the management of patients with chronic hepatitis B virus infection[J].Lancet Infect Dis,2008,8(3):1671-1678.
[2]LOK AS,ZOULIM F,SOCARMINNI S,et al.Antiviral drugresistant HBV:standardization of nomenclature and assays and recommendations for management[J].Hepatology,2007,46(1):254-265.
[3]BORROTO-ESODA K,MILLER MD,ARTERBUM S.Pooled analysis of amino acid changes in the HBV polymerase in patients from four major adefovir dipivoxil clinical trials[J].J Hepatol,2007,7(4):492-498.
[4]QI X,XIONG S,YANG H,et al.In vitro susceptibility of adefovir-associated hepatitis B virus polymerase mutations to other antiviral agents[J].Antivir Ther,2007,12(3):355-362.
[5]SCHILDGEN O,SIRMA H,FUNK A,et al.Variant of hepatitis B virus with primary resistance to adefovir[J].N Engl J Med,2006,54(17):1807-1812.
[6]LACOMBE K,OLLIVET A,GOZLAN J,et al.A novel hepatitis B virus mutation with resistance to adefovir but not to tenofovir in an HIV-hepatitis B virus-coinfected patient[J].Aids,2006,20:2229-2231.
[7]ILVIA G,VALERIA B,ANTONINA S,et al.Lamivudine-resistant chronic hepatitis B:An observational study on adefovir in monotherapy or in combination with lamivudine[J].J Hepatol,2008,48(4):540-547.
[8]徐东平.乙型肝炎病毒耐药的检测与判断 [J].中华肝脏病杂志,2009,17:61-63.
[9]XU Z,LIU Y,XU T,et al.Acute hepatitis B infection associ ated with drug-resistant hepatitis B virus[J].J Clin Virol,2010,48(4):270-274.
[10]LIU Y,ZHONG Y,ZOU Z,et al.Features and clinical implications of hepatitis B virus genotypes and mutations in basal core promoter precore region in 507 Chinese patients with acute and chronic hepatitis B[J].J Clin Virol,2010,47(3):243-247.
[11]JI D,LIU Y,SI LL,et al.Variable influence of mutationalpatterns in reverse-transcriptase domain on replication capacityof hepatitis B virus isolates from antiviral -experiencedpatients[J]. Clin Chim Acta,2011,412(3-4):305-313.
[12]SORIANO V,PERELSON AS,ZOULIM F.Whyarethere different dynamics in the selection of drug resistance in HIV and hepatitis B and C viruses[J].J Antimicrob Chemother,2008,62(1):1-4.
[13]徐东平,李进,张玲霞.恩替卡韦治疗慢性乙型肝炎的研究进展[J]. 中华医学杂志,2006,86(28):2014-2016.
[14]ZOULIM F.In vitro models for studying hepatitis B virus drug resistance[J].Semin Liver Dis,2006,26(2):171-180.
[15]刘禄,郝瀚,刘永明,等.HBV表型耐药方法的建立及对临床分离株的表型耐药分析[J].解放军医学杂志,2010,35(6):632-634.
[16]AMINI-BAVIL-OLYAEE S,HERBERS U,SHELDON J,et al.The rtA194T polymerase mutation impacts viral replication and susceptibility to tenofovir in hepatitis B e antigen-positive and hepatitis B e antigen-negative hepatitis B virus strains[J].Hepatology,2009,49(4):1158-1165.
[17]INOUE J,UENO Y,WAKUI Y,et al. Four -year study oflamivudine and adefovir combination therapy in lamivudine -resistant hepatitis B patients:influence of hepatitis B virusgenotype and resistance mutation pattern [J]. J Viral Hepat,2011,18(3):206-215.
[18]LI X,WANG L,ZHONG Y,et al. Hepatitis B virus(HBV)subgenotypes C2 and B2 differ in lamivudine -and adefovir -resistance -associated mutational patterns in HBV -infectedChinese patients[J]. J Clin Microbiol,2010,48(12):4363-4369.

