黑米花青素对大鼠肠道菌群调节作用及抗氧化研究
李帅,陈玮,刘洪,荣晓,伍秀华,余小平
(成都医学院公共卫生系,四川成都 610083)
研究证实,黑米的保健作用与其米皮中的花青素(BRACs)密切相关[1,2]。BRACs因其较高的抗氧化能力,有着较强的益生保健作用[3]。肠道菌群被称为体外器官,参与机体健康的维系,多种疾病的发生与肠道菌群的失调有着密切关系[4]。作为保健食品,黑米通过肠道消化和吸收,其是否对肠道菌群有调节作用值得探讨。本研究采用灌胃给予BRACs,测定大鼠体内氧化水平和肠道主要菌群的变化,探讨BRACs是否能提高大鼠的抗氧化能力,改善肠道生态,增进机体健康,为阐明黑米的保健作用机制提供实验证据。
1 材料与方法
1.1 材料
1.1.1 动物 清洁级Spregue-Dawley大鼠,体重(180±20)g,雌雄不限,由四川省医学科学院实验动物研究所提供。
1.1.2 仪器 超净工作台由苏净集团生产;厌氧培养系统由荷兰 Mart B.V公司制造,UV1102分光光度计由上海天美科学仪器有限公司生产,恒温培养箱由上海苏进仪器设备厂制造。
1.1.3 试剂 BRACs由中山大学凌文华教授提供;考马斯亮蓝蛋白测定试剂盒、脂质过氧化产物丙二醛(malondialdehyde,MDA)检测试剂盒、抗氧化酶系超氧化物歧化酶(Superoxide dismutase,SOD)检测试剂盒、谷脱甘肽过氧化物酶(glutathione peroxedasg,GSH-Px)检测试剂盒、谷胱甘肽转移酶(glutathione S-transferase,GST)测定试剂盒购自南京建成生物工程研究所;TPY琼脂、麦康凯培养基、MRS培养基、肠球菌琼脂购自青岛高科园海博生物技术有限公司。
1.2 方法
1.2.1 实验动物分组及灌胃 24只Sprague-Dawley大鼠正常饲养1周后,随机分成对照组(n=6)和BRACs组(n=18)。BRACs组以生理盐水稀释BRACs,分别按50,100,150mg/kg·bw剂量,定时每天灌胃1次,对照组则用等量生理盐水灌胃,连续15d。
1.2.2 实验动物一般情况观察 实验期间,每日观察大鼠体态、进食、饮水、活动和粪便等情况,同时记录日进食量和体重。
1.2.3 大鼠肠道菌群的检测 实验开始后,分别在0、7、15d定时无菌取大鼠新鲜粪便,称重,无菌生理盐水10倍稀释(振荡器震荡),然后依次稀释至10-2、10-3、10-4、10-5、10-6、10-7。选择合适的稀释度,分别吸取50μl稀释液,涂布于以下各选择培养基。肠球菌:肠球菌琼脂;肠杆菌:麦康凯培养基;乳杆菌:MRS培养基;双歧杆菌:TPY培养基。肠球菌和肠杆菌直接在37℃恒温培养箱培养,乳杆菌和双歧杆菌经过厌氧系统处理,厌氧灌37℃恒温培养箱培养。待菌落长出后以菌落形成单位(CFU/g)进行计数。
1.2.4 大鼠体内氧化水平的分析测定 实验完毕,乙醚麻醉大鼠,眼眶采血,肝素抗凝,低速离心(3500 r/min,10min)后,取上清,按检测试剂盒说明书操作,分别测定 MDA含量和SOD、GSH-PX与GST活性。
1.2.5 统计学分析 数据处理采用SPSS 13.0进行分析,结果以均数±标准差(±s)表示。ANOVA单因素方差分析检验比较组间差异,P<0.05为差异有统计学意义。
2 结果
2.1 BRACs对大鼠进食和体重的影响
实验期间,BRACs组和对照组动物均未见异常。各组动物的进食量和体重净增量间无显著差异(P>0.05)。提示本实验所用BRACs剂量对大鼠正常生理活动未产生明显不良影响(表1)。
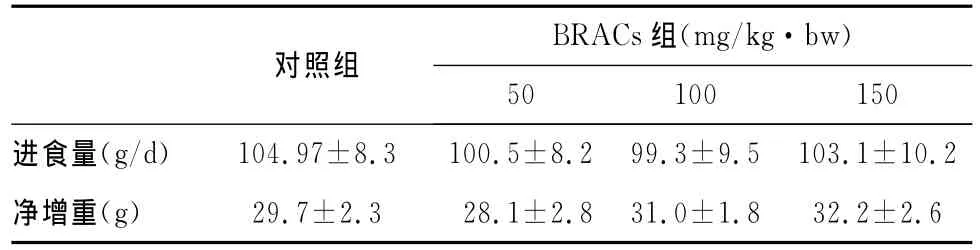
表1 大鼠日进食量和实验前后体重净增重Tab.1 Daily food-intake and growth increment in weight before and after experiment in rats
2.2 BRACs对大鼠肠道菌群的影响
菌落计数结果显示,BRACs连续灌胃15d后,50,100,150mg/kg·bw 3个剂量组的肠球菌和肠杆菌数量均比对照组明显降低(P<0.05),而双歧杆菌和乳杆菌数量与对照组相比则无显著差异(P>0.05);3个剂量组间在4个菌群数量上均无显著性差异(P>0.05)(图1)。
2.3 BRACs对大鼠抗氧化能力的影响
检测结果显示,BRACs组血清脂质过氧化产物MDA含量均显著低于对照组(P<0.01),而100和150mg/kg·bw 组低于50mg/kg·bw 组(P<0.05);BRACs组SOD、GSH-PX和 GST活性显著高于对照组,而BRACs不同剂量间无显著差异(P>0.05)(表2)。

表2 大鼠血清MDA含量和SOD、GSH-PX与GST活性测定结果Tab.2 MDA content in serum and SOD,GSH-PX and GST activity

3 讨论
肠道菌群是机体健康不可或缺的重要成分,其在维持肠道的正常结构和生理功能,拮抗病原微生物的定植与感染、调控宿主的免疫功能等方面具有重要作用[4]。研究表明,肠道菌群失调与多种非感染性疾病特别是慢性代谢性疾病的发生密切相关[5-6]。
正常肠道菌群主要包括双歧杆菌、乳杆菌、肠球菌、肠杆菌、拟杆菌、梭菌等,其中双歧杆菌和乳杆菌具有益生作用,是肠道微生态中最为重要的组成部分。研究发现,肠道内源性专性厌氧菌具有抑制消化道中主要属于需氧菌的潜在致病菌群数量的能力,即肠道微生物定植抗力[4,7],其大小可衡量肠道菌群健康正常是否。
益生制剂可提高肠道微生物定植抗力,促进机体健康[8,9]。花色苷是花青素的糖苷衍生物,周波等[10]发现小鼠灌服玉米花色苷后,其肠道双歧杆菌和乳杆菌数量无显著变化,而肠杆菌数量则明显降低。Kylli等[11]的研究结果也显示植物多酚类化合物(含花青素)对肠道病原菌(杆菌)有抑制作用。本研究观察了BRACs灌胃对大鼠肠道菌群的调节作用,结果显示50、100、150mg/kg·bw 3个剂量的BRACs均能明显降低肠球菌和肠杆菌的数量,而对双歧杆菌和乳杆菌无明显作用。该结果与已往文献报道基本一致[10,11]。本研究中BRACs组益生菌双歧杆菌和乳杆菌数量并未明显增加,但需氧菌肠球菌和肠杆菌的数量却显著减少,从而使BRACs组大鼠的肠道微生物定值抗力皆有所提高,提示BRACs灌胃对大鼠肠道菌群有良性调节作用。
BRACs是黑米的主要活性成分,其多种益生功能与其强大的抗氧化能力密切相关[1-3]。Jakesevic等[12]发现膳食补充富含花青素的花楸果或越橘果实可以减少缺血再灌注小鼠的肠道乳杆菌数量,并降低其脂质过氧化水平。我们发现,BRACs灌胃可使乳杆菌数量一定程度下降,但在统计学上无显著差异。而脂质过氧化水平和主要抗氧化酶活性分析结果显示,BRACs灌胃显著抑制大鼠血清脂质过氧化水平,并能提高抗氧化酶SOD、GSH-PX和GST的活性。提示BRACs灌胃可显著提高大鼠的抗氧化能力。
综上所述,BRACs灌胃可提高大鼠的抗氧化能力,提高肠道微生物的定值抗力,良性调节肠道菌群。这为阐明BRACs保健益生的作用机制提供了基础实验资料。
[1]Xia M,Ling W,Zhu H,et al.Antho-cyanins attenuates CD40-mediated endothelial cell activation and apoptosis by inhibiting CD40-induced MAPK activation [J ].Atherosclerosis,2009,202(1):41-47.
[2]Xia M,Hou M,Zhu H,et al.Antho-cyanins induce cholesterol efflux from mouse peritoneal macrophages:the role of the peroxisome proliferator-activated receptor{gamma}-liver X receptor{alpha}-ABCA1pathway[J].J Biol Chem,2005,280(44):36792-367801.
[3]Hui C,Bin Y,Xiaoping Y,et al.Anti-cancer activities of an anthocyanin-rich extract from black rice against breast cancer cells in vitro and in vivo[J].Nutr Cancer.2010,62(8):1128-1136.
[4]Hao WL,Lee YK.Microf1ora of the gastrointestinal tract:a review[J].MethodsMol Biol,2004,268:491-502.
[5]Bajzer M,Seeley RJ.Physiology:obesity and gut flora[J].Nature,2006,444(7122):1009-1010.
[6]Wen L,Ley RE,Volchkov PY,et al.Innate immunity and intestinal micro biota in the development of Type 1diabetes[J].Nature,2008,455(7216):1109-1113.
[7]吴仲文,李兰娟,马伟杭,等.肠道微生物定植抗力的新指标-B/E值[J].浙江预防医学,2000,12(7):4-5.
[8]王坚镪,丁在咸,张曼,等.益生菌对炎症性肠病小鼠肠道菌群紊乱及细菌移位的影响[J].上海交通大学学报(医学版),2010,30(2):186-190.
[9]张树和,韩羿斌,金双喜,等.大豆多糖对双歧杆菌及人肠道菌群生长的影响[J].中国微生态学杂志,2008,20(2):135-136.
[10]周波,王晓红,宋儒,等.玉米紫色植物花色苷色素对小鼠肠道菌群的影响[J].中国微生态学杂志,2008,20(1):23-24.
[11]Kylli P,Nohynek L,Puupponen-Pimia R.et al.Rowanberry phenolics:compositional analysis and bioactivities[J].J Agric Food Chem,2010,58(22):11985-11992.
[12]Jakesevic M,Aaby K,Borge GI,et al.Antioxidative protection of dietary bilberry,chokeberry and Lactobacillus plantarum HEAL19in mice subjected to intestinal oxidative stress by ischemia-reperfusion[J].BMC Complement Altern Med,2011,11:8-19.

