丝裂原活化蛋白激酶在染料木黄酮抑制血管内皮细胞中的作用
余小平,程道梅,彭晓莉,贾皓,韩彬,2
(1.成都医学院公共卫生系,四川 成都 610083;2.遵义医学院公共卫生学院,贵州 遵义 563003)
血管内皮细胞(ECs)的活化、肿瘤细胞及ECs中促血管生成因子分泌的增加均可促进肿瘤的血管生成[1-3]。血管内皮生长因子(VEGF)是促肿瘤血管生成中最强的生长因子,通常由好氧细胞产生。VEGF与ECs表面的VEGF受体结合,不仅可通过丝裂原活化蛋白激酶(MAPK)信号转导通路提高原ECs的活性[4],还增加基质金属蛋白酶(MMPs)的分泌[5]。1987年,Akiyama等[6]首次证实染料木黄酮(genistein,Gen)是一种强效的蛋白酪氨酸激酶(protein tyrosine kinase,PTK)抑制剂。前期的研究证实,Gen可通过抑制HER-2/neu受体磷酸化和PTK活性而下调促血管生成因子的表达[7],ECs参与了实体肿瘤的血管生成[8]。本研究旨在探讨MAPK信号通路在Gen抑制ECs活性中的作用,揭示Gen抗血管生成的可能分子机制。
1 材料与方法
1.1 材料
Gen标准品和VEGF购自美国Sigma-Aldrich公司。[γ-32P]ATP购自北京Yahui生物医学工程公司。氨基端激酶(JNK)抑制剂(SP600125)、p38抑制剂(SB203580)和 ERK1/2抑制剂(PD98059)购自美国Promega公司。基质金属蛋白酶抑制因子(MMP)-2/-9、TIMP-2/-9 酶 链 免 疫 吸 附 测 定(ELISA)试剂盒、Caspase-3活性分析试剂盒购自武汉Boster生物科学有限公司。抗phospho-JNK、抗phospho-p38、抗 phospho-ERK1/2、抗 phospho-MMP-2、抗phospho-MMP-9、通用型二抗以及增强化学发光系统(ECL)购自北京Santa Cruz生物技术公司。Ⅱ型和Ⅳ型胶原酶分析试剂盒购自日本Yagai公司。
1.2 人脐静脉内皮细胞(HUVECs)培养和处理
采用胰酶消化法分离健康非异常妊娠母亲经阴道所产健康胎儿的新鲜脐带HUVECs,然后在含有20%特级胎牛血清、100U/ml盘尼西林、100μg/ml链霉素和75μg/ml内皮细胞生长添加剂(ECGS)的RPMI1640培养液,37℃,5%CO2条件下培养。经形态学及免疫细胞化学法(F-3520抗体)鉴定后将第3~6代HUVECs接种于24孔培养板,分别用5 μg/ml VEGF或1、10、100μmol/L Gen处理24h。对照组用等量的二甲基亚枫(DMSO)替代VEGF和(或)Gen处理,DMSO的终浓度≤0.1%(v/v)。
1.3 聚丙烯酰胺凝胶电泳(SDS-PAGE)酶谱检测和反相酶谱检测
酶谱检测中,将HUVECs培养液的上清冷冻液浓缩后在10%SDS-PAGE(含有1mg/ml凝胶)电泳。反相酶谱检测中,将浓缩上清液在12%SDS-PAGE(0.5mg/ml凝胶+10%的幼仓鼠肾细胞)4℃电泳,然后将凝胶用2.5%TritonX-100冲洗2次,每次15min以除去SDS。冲洗后的凝胶在酶谱缓冲液(50mmol/L Tris,pH 7.4,10mmol/L CaCl2,0.05%Brij 35)中37℃孵育过夜,考马斯亮蓝染色,最后用图像分析软件(Bio-Rad)对酶谱进行定量分析。
1.4 蛋白免疫印迹检测
条件培养基离心超滤、冷冻浓缩10倍,然后进行SDS-PAGE电泳并转印至聚偏二氟乙烯(PVDF)膜(Millipore)上。为阻断非特异性结合,5% 脱 脂 奶 粉/Tris-缓 冲 液/0.2% 吐 温 20 稀 释MMP-2/-9抗体(1∶200)、MAPK抗体(抗-JNK/p38和抗-phospho-JNK/p38(1∶200)。采用 ECL 检测蛋白表达情况。
1.5 MMPs表达分析
收集培养液上清,使用ELISA试剂盒按照说明书分析 MMPs(MMP-2/-9)及其抑制剂(TIMP-2/-9)的表达情况,450nm下测吸光度[A,旧称光密度(OD)]值,每个样品测3次。
1.6 溶胶原和明胶分解活性分析
取新鲜分离的培养液上清,按II型和IV型胶原蛋白酶分析试剂盒操作指南进行,检测荧光标记底物的清除情况,分析溶胶原和明胶分解活性。
1.7 统计分析方法
2 结果
2.1 Gen阻断VEGF诱导HUVECs的MMPs分泌和活性
与对照相比较,VEGF处理后MMP-2和MMP-9水平显著提高。Gen以剂量依赖方式(1~100μmol/L)降低 MMP-2(图1A)和 MMP-9(图1B)水平。电泳分析结果显示,VEGF处理24h显著增加MMP-2和MMP-9溶胶原活性,而Gen以剂量依赖性方式降低MMP-2和MMP-9溶胶原活性(图1C)。结果提示,Gen处理HUVECs将减少VEGF诱导的MMP-2/-9的分泌,并降低其酶解活性。
为进一步确定实验中观察到的Gen对HUVECs的抑制作用不是由于Gen直接与培养基中的蛋白酶相互作用引起的,将1、10或100μmol/Gen孵育HUVECs 24h后除去培养基,将培养的细胞继续在5μg/L VEGF中孵育4h。二次孵育终点时收集培养基,并用荧光标记底物进行分析。结果 发 现,Gen 对 MMP-2(图 1E)and MMP-9(图1F)活性仍表现出抑制效应,因而溶胶原和凝胶分解活性的下降是由于HUVECs释放的MMP-2/-9蛋白数量的减少(图1G)。

此外,还发现VEGF对TIMP-2/-9的分泌和活性均没有影响,且Gen对TIMP-2/-9的含量及活性均也没有显著的影响(数据未显示),由此认为Gen对MMPs活性的抑制作用不是由于增加MMPs抑制剂TIMPs活性而导致的。
2.2 Gen抑制VEGF诱导的内皮细胞中JNK和p38活化
已有研究显示,VEGF介导的信号可通过MAPK磷酸化引起增殖反应[9,10]。为确证 MAPK是否参与了VEGF诱导的增殖过程,分别利用JNK抑制剂 SP600125、p38抑制剂SB203580、ERK1/2抑制剂PD98059证实MAPK信号分子在VEGF信号通路中的可能作用。细胞凋亡率(图2A)及凋亡蛋白酶capase-3活性(图2B)结果显示,SP600125(10μmol/L)和SB203580(10μmol/L)特异性地阻断了VEGF诱导的内皮细胞活化。VEGF诱导的MMP-2/-9的分泌也减少(图2D)。而PD98059(10 μmol/L)不能降低 VEGF诱导的 MMP-2/-9的分泌,同时对细胞凋亡和死亡也没有明显影响。上述结果提示p38和JNK活化可能参与VEGF诱导MMPs生成。
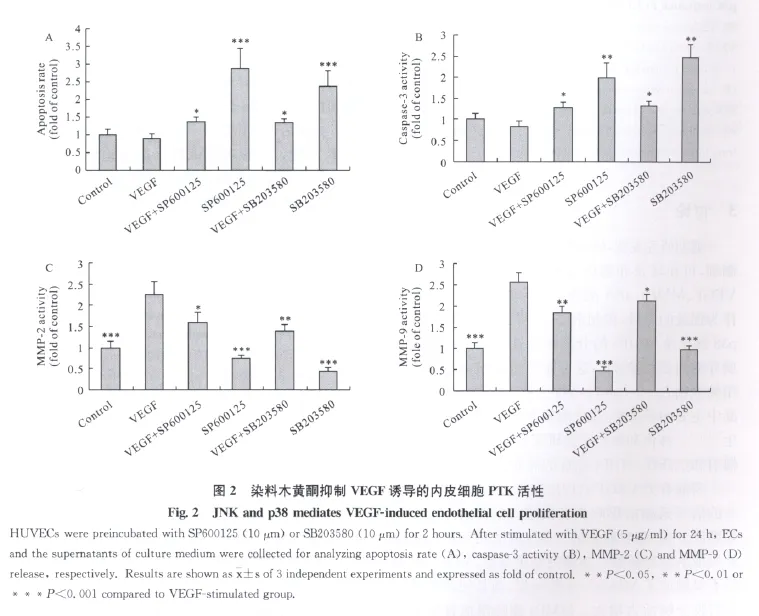
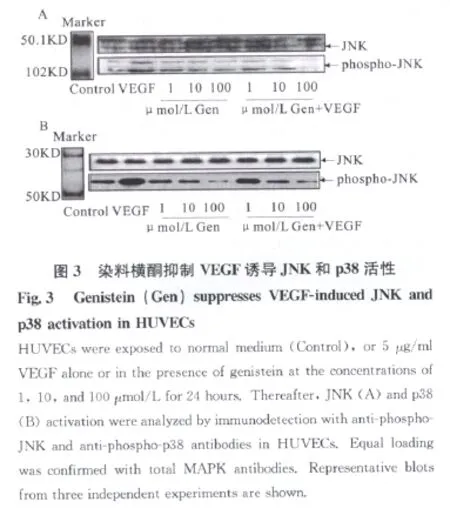
用抗磷酸化JNK(图3A)和抗磷酸化p38(图3B)抗体检测发现,HUVECs经Gen处理后,剂量依赖性地减弱了VEGF介导的JNK和p38活化,Gen对VEGF诱导的ERK1/2活化作用没有明显影响,提示Gen可抑制内皮细胞中VEGF诱导的JNK和p38的活化。
3 讨论
前期研究发现,Gen是一种强效的PTK活性抑制剂,可在转录和翻译水平下调促血管生成因子VEGF、MMPs、uPA 的表达[7]。本研究结果显示,作为强效的PTK抑制剂Gen,可通过抑制JNK和p38活化及MMPs的分泌和活性从而抑制VEGF诱导的内皮细胞活化,这可能是Gen抗血管生成作用的机制之一。Gen(4,5,7三羟异黄酮)为大豆产品中主要的异黄酮,在动物模型中能够抑制癌症发生[11,12]。体内和体外实验研究也显示,Gen具有抗辐射和抗药性,可用于癌症的辅助治疗[13]。
目前有关VEGF对内皮细胞,尤其对HUVECs中的信号通路的影响少有报道。正常成人的ECs是高度分化、相对静止的。ECs的活化和增殖是血管生成的起始阶段。本研究结果显示,VEGF刺激后不仅增加了MMP-2/-9的分泌,而且使其溶胶原和明胶分解活力增大。MMPs能降解血管生成中肿瘤细胞外基质成分,该类酶通常都是以原酶的形式出现,在发挥降解基质时需要活化[14-16]。Gen处理减少内皮细胞中 MMP-2/-9的分泌,并使其活性降低,提示Gen具有抗血管生成作用,这与课题组前期的研究结果一致[7]。但对TIMPs的分泌及活性不影响,表明Gen对MMPs活性的抑制作用不是通过TIMPs实现的。
我们发现Gen以剂量依赖性抑制VEGF诱导的JNK和p38的磷酸化。该结果与已往文献报道一致,即Gen可有效抑制位于肿癌组织或其他组织中的内皮细胞 MAPK活性[17,18],但 Gen未能显著降低内皮细胞ERK-1/2的磷酸化水平,这与Sawai等[19]报道Gen能抑制二萜醇酯类诱导的ERK-1/2磷酸化的研究结果不一致。这种差异或许是因于实验条件的不同而导致的。
Gen在体内无法达到实验中使用的浓度100 μmol/L[6,13]。单独摄入大豆膳食时,人血浆中 Gen的最大浓度可达1~4μmol/L[20]。本研究中,将HUVECs暴露于10μmol/L和更高浓度的Gen后导致MMP-2/9生成减少。在本实验中使用的浓度范围内,Gen同时可作为非选择性酪氨酸激酶抑制剂和内皮生长因子受体激酶抑制剂[7,21]。高浓度Gen处理后使 MMP-2/9生成减少,可归因于抑制PTK活性。尽管未对该假设进行论证,事实上在Gen抑制酪氨酸激酶浓度范围内,Gen已被用于探讨对MMPs生成的抑制作用研究[22]。同时更高浓度Gen(20~370μmol/L)已被用于研究其对脑内皮细胞中环前列腺素生成的影响[23]。
[1]Grimm D, Bauer J, Schoenberger J. Blockade of neoangiogenesis,a new and promising technique to control the growth of malignant tumors and their metastases[J].Curr Vasc Pharmacol,2009,7(3):347-357.
[2]Saphir A.Angiogenesis:the unifying concept in cancer[J].J Natl Cancer Inst,1997,89(22):1658-1659.
[3]Heath VL,Bicknell R.Anticancer strategies involving the vasculature[J].Nat Rev Clin Oncol,2009,6(7):395-404.
[4]Kǔdo JM,Ogawara KI,Werner N,et al.Molecular pathways of endothelial cell activation for(targeted)pharmacological intervention of chronic inflammatory diseases[J].Curr Vasc Pharmacol,2005,3(1):11-39.
[5]Lutsenko SV,Kiselev SM,Severin SE.Molecular mechanisms of tumor angiogenesis[J].Biochemistry(Mosc),2003,68(3):286-300.
[6]Akiyama T,Ishida J,Nakagawa S,et al.Genistein,a specific inhibitor of tyrosine-specific protein kinases[J].J Biol Chem,1987,262(12):5592-5595.
[7]余小平,糜漫天,朱俊东.三羟异黄酮对HER-2/neu高表达乳腺癌细胞血管生成相关因子表达的影响[J].实验生物学报,2004,37(3):251-253.
[8]Furuya M,Yonemitsu Y,Aoki I.III.Angiogenesis:complexity of tumor vasculature and microenvironment[J].Curr Pharm Des,2009,15(16):1854-1867.
[9]Xu J,Liu X,Jiang Y,et al.MAPK/ERK signalling mediates VEGF-induced bone marrow stem cell differentiation into endothelial cell[J].J Cell Mol Med,2008,12(6A):2395-2406.
[10]Issbrücker K,Marti HH,Hippenstiel S,et al.p38MAP kinase——a molecular switch between VEGF-induced angiogenesis and vascular hyperpermeability[J].FASEB J,2003,17(2):262-264.
[11]Banerjee S,Li Y,Wang Z,et al.Multi-targeted therapy of cancer by genistein[J].Cancer Lett,2008,269(2):226-242.
[12]Lambert JD,Kwon SJ,Ju J,et al.Effect of genistein on the bioavailability and intestinal cancer chemopreventive activity of(-)-epigallocatechin-3-gallate[J].Carcinogenesis,2008,29(10):2019-2024.
[13]Sarkar FH,Li Y.Soy isoflavones and cancer prevention[J].Cancer Invest,2003,21(5):744-757.
[14]Sprenger CC,Plymate RR,Reed MJ.Extracellular influences on tumour angiogenesis in the aged host[J].Br J Cancer,2008,98(2):250-255.
[15]Huang SC,Sheu BC,Chang WC,et al.Extracellular matrix proteases-cytokine regulation role in cancer and pregnancy[J].Front Biosci,2009,14:1571-1588.
[16]Sounni NE, Noel A. Membrane type-matrix metalloproteinases and tumor progression[J].Biochimie,2005,87(3-4):329-342.
[17]Liu D,Homan LL,Dillon JS.Genistein acutely stimulates nitric oxide synthesis in vascular endothelial cells by a cyclic adenosine 5'-monophosphate-dependent mechanism [J].Endocrinology,2004,145(12):5532-5539.
[18]Huang X,Chen S,Xu L,et al.Genistein inhibits p38map kinase activation,matrix metalloproteinase type 2,and cell invasion in human prostate epithelial cells[J].Cancer Res,2005,65(8):3470-3478.
[19]Sawai H,Okada Y,Funahashi H,et al.Activation of focal adhesion kinase enhances the adhesion and invasion of pancreatic cancer cells via extracellular signal-regulated kinase-1/2signaling pathway activation[J].Mol Cancer,2005,4:37-48.
[20]King RA,Bursill DB.Plasma and urinary kinetics of the isoflavones daidzein and genistein after a single soy meal in humans[J].Am J Clin Nutr,1998,67(5):867-872.
[21]Nichols MR,Morimoto BH.Tyrosine kinase-independent inhibition of cyclic-AMP phosphodiesterase by genistein and tyrphostin 51[J].Arch Biochem Biophys,1999,366(2):224-230.
[22]Kim MH. Flavonoids inhibit VEGF/bFGF-induced angiogenesis in vitro by inhibiting the matrix-degrading proteases[J].J Cell Biochem,2003,89(3):529-538.
[23]Parfenova H,Balabanova L,Leffler CW.Posttranslational regulation of cyclooxygenase by tyrosine phosphorylation in cerebral endothelial cells[J].Am J Physiol Cell Physiol,1998,274(1ptl):72-81.

