黑米花青素对大鼠视网膜光化学损伤感光细胞凋亡和Caspase-1表达的影响
陈玮,贾皓,余小平*,伍秀华,李帅,刘洪,廖纪如,凌文华
(1.成都医学院公共卫生系,四川 成都 610083;2.中山大学公共卫生学院,广东 广州 510080)
视网膜光损伤包括机械损伤、热损伤和光化学损伤,其中光化学损伤是造成视网膜病变最为重要的因素[1,2]。在视网膜色素变性(RP)中,感光细胞的死亡和丢失主要是由光氧化应激所诱导的细胞凋亡所致[1,2]。多种抗氧化剂皆能在一定程度上减轻氧化应激水平,抑制细胞凋亡,防护 RP[3-5]。花青素(Anthocyanins,ACs)是一类天然的植物多酚类化合物,具有较强的抗氧化和抗凋亡能力[6]。黑米花青素(BRACs)来自黑米皮,我们在前期研究中发现[7,8],BRACs膳食干预能明显抑制光氧化应激诱导的视网膜脂质过氧化,有效维护视网膜形态结构的完整。Caspase-1在视神经细胞凋亡中发挥关键作用[9]。本研究拟进一步观察BRACs防护RPD中的抗凋亡作用,并检测凋亡关键蛋白Caspase-1的表达水平,以探讨BRACs防护RPD的作用机制。
1 材料与方法
1.1 材料
BRACs由中山大学凌文华教授提供;托吡胩胺滴眼液购自武汉五景药业有限公司;RNA提取试剂盒、逆转录聚合酶链反应(RT-PCR)试剂盒及引物合成皆由大连宝生物工程有限公司提供;原位末端标注(TUNEL)试剂盒、Caspase-1抗体和免疫组织化学检测试剂购自武汉博士德生物有限公司;清洁级Spregue-Dawley大鼠由四川省医学科学院实验动物研究所提供;CMC-I型辐照仪、ST-80型数字式照度计由本课题组与西南大学联合研制。FV1000激光共聚焦显微镜购自日本Olympus公司;PCR仪和核酸蛋白凝胶成像仪购自美国Bio-Rad公司。
1.2 实验分组及处理
60只Spregue-Dawley大鼠,鼠龄6周,平均体重(160±15)g,雌雄不限,饲以AIN-93基础饲料正常光照适应1周后,随机分为对照组(n=30)和BRACs组(n=30),二者均饲以基础饲料,12h明/12h暗循环光照,其中BRACs组按100mg/kg·bw剂量给予BRACs,每天灌胃1次,对照组则予等量生理盐水灌胃1次。处理15d后,两组动物同时给予(3000±200)lux强度的白色荧光持续光照24h,RP模型参照文献[5]的方法建立。
1.3 组织取材与切片制作
大鼠光照后,乙醚麻醉,迅速摘取眼球,其中左眼球提取总RNA,右眼球则置于10%的福尔马林液中固定24h,然后常规脱水,浸蜡、石蜡包埋,经视神经矢状纵切,制成5μm厚切片,用于TUNEL和免疫组织化学检测。
1.4 细胞凋亡检测
视网膜细胞凋亡检测采用TUNEL法。取前述制备的视网膜石蜡切片,按试剂盒说明进行操作,激光共聚焦显微镜观察并分析。凋亡结果以凋亡指数(apoptotic index,AI)表示(AI=凋亡细胞数/细胞总数×100%)。
1.5 视网膜总RNA提取及RT-PCR
按RNA提取试剂盒说明提取左眼球总RNA,核酸蛋白微量检测仪测定其含量与纯度,-80℃保存。
RT-PCR按试剂盒说明进行,内参GAPDH上游引物:5'-GTG CTG AGT ATG TCG TGG AGT CT-3',下 游 引 物:5'-GTG GAA GAA TGG GAG TTG CTG T-3',扩 增 长 度 610 碱 基 对 (bp);Caspase-1 上 游 引 物:5'-GTG GAG AGA AAC AAG GAG TGG T-3',下 游 引 物:5'-TCA GTG GTT GGC ATC TGT AGT C-3',扩增长度310bp。扩增条件为:94℃预变性2min,94℃变性30s,58℃退火30s,72℃延伸1min,循环33次。
RT-PCR产物经2%琼脂糖凝胶电泳,Bio-Rad凝胶成像分析系统扫描分析。半定量PCR特异条带值以相对吸光度(intensity)×面积(mm2)表示,mRNA表达结果以各组的吸光度与内参GAPDH吸光度的比值表示(V value)。
1.6 免疫组织化学法检测Caspase-1蛋白表达
免疫组织化学染色法按博士德公司说明书操作。石蜡切片常规脱蜡至水,30ml/L H2O215min,灭活内源性过氧化物酶,抗原修复,正常羊血清封闭组织非特异性抗原,15min,弃上清,滴加Caspase-1抗体[阴性对照用磷酸盐缓冲液(PBS)代替一抗],37℃、孵育1h;PBS荡洗,滴加生物素化二抗,37℃、孵育30min;PBS荡洗,滴加辣根过氧化物酶(HRP)标记的链霉卵白素,37℃、30min,PBS冲洗,二氨基联苯胺(DAB)显色,苏木精复染,反蓝,脱水透明封片,普通光学显微镜观察,拍照。
1.7 统计学处理
实验数据用SPSS 13.0统计软件进行分析,结果以均数±标准差(±s)表示。ANOVA单因素方差分析检验同一组内不同光照时相点差异,t检验比较组间差异,P<0.05为差异有统计学意义。
2 结果
2.1 BRACs对视网膜光化学损伤中感光细胞凋亡的影响
TUNEL法检测结果显示,光照后视网膜感光细胞阳性率显著增加(P<0.01),而BRACs组感光细胞凋亡阳性率显著低于对照组(P<0.01)(图1)。
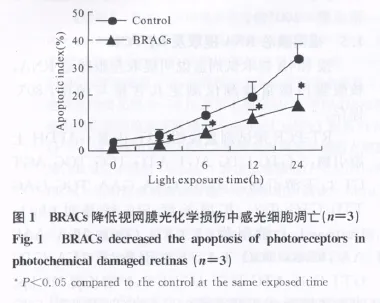
2.2 BRACs对视网膜感光细胞 Caspase-1mRNA表达的影响
RT-PCR检测结果显示,光照后视网膜感光细胞Caspase-1mRNA表达增加。而BRACs干预使其表达下调,并在0、3、24h处显著低于对照组(P<0.05)(图2)。
2.3 BRACs对视网膜感光细胞Caspase-1蛋白表达的影响
免疫组织化学染色结果显示,Caspase-1阳性染色呈棕黄色。未光照的大鼠视网膜未见明显着色(图3A);光照24h对照组和BRACs组视网膜外核层和内核层均出现阳性染色(图3B);而相对于对照组,BRACs组视网膜的阳性染色强度明显低于对照组,即BRACs干预抑制光照后Caspase-1蛋白的表达(图3B,3C)。
3 讨论
氧化应激和氧化应激诱导的细胞凋亡在视网膜光化学损伤过程中起着关键作用[1,2]。前期研究发现,BRACs干预能够明显减轻光诱导的氧化应激水平,维护视网膜组织形态的完整[7,8]。本研究进一步探讨了BRACs对RPD感光细胞凋亡和凋亡蛋白caspase-1表达的影响。
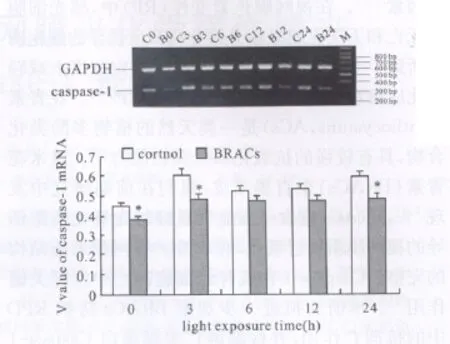
图2 BRACs降低视网膜感光细胞caspase-1mRNA表达(n=3)Fig.2 BRACs down-regulated the mRNA expression of caspase-1in photochemical damaged retinas(n=3)
细胞凋亡在视网膜的发育和病变过程中发挥着重要作用。研究表明,急性光损伤中感光细胞丢失的主要方式是凋亡[1,2]。已有研究显示,各种内源和外源的抗氧化剂能降低光氧化应激,抑制感光细胞凋亡[3-5]。本研究结果显示,BRACs干预显著降低凋亡感光细胞的数量,具有明显的抗凋亡作用。结合前期研究发现BRACs的抗氧化作用,进一步证实氧化应激及其诱导的凋亡在视网膜光化学损伤中的关键作用。
半胱氨酸蛋白酶家族在细胞凋亡过程中起着关键作用。其级联活化是细胞凋亡的中心环节。Caspase-1是该家族中第一个被发现和命名的成员,主要负责白细胞介素(IL)-1β的成熟和转运,参与炎症反应[9]。
Katai等[10]首先发现,Caspase-1在感光细胞凋亡中具有重要作用。Krishnamoorthy等[11]的体外实验证实,抑制Caspase-1可以保护光诱导的感光细胞凋亡。Wu等[12]发现,在视网膜光化学损伤中,高强度的持续光照可使小鼠视网膜感光细胞内NF-κB活性降低,Caspase-l表达增加,从而促进感光细胞凋亡。前期研究发现,膳食添加牛磺酸可下调Caspase-l表达,抑制光氧化应激诱导的感光细胞凋亡[5]。本研究结果提示,BRACs灌胃干预能有效防护细胞凋亡,显著抑制Caspase-l的mRNA和蛋白表达水平,进一步证实了Caspase-l在视网膜光损伤病变中的重要作用。
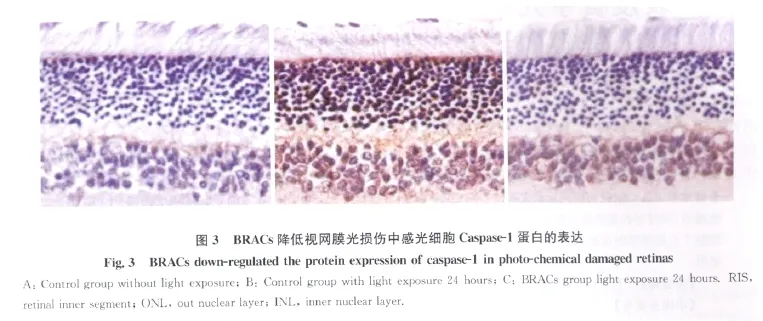
综上所述,本研究结果显示,BRACs可能通过下调Caspase-l表达,抑制感光细胞凋亡,有效降低光氧化应激诱导的视网膜光化学损伤,而有关BRACs通过何种途径调节Caspase-1表达,则有待深入研究加以探讨。
[1]Youssef PN,Sheibani N,Albert DM.Retinal light toxicity[J].Eye(Lond),2011,25(1):1-14.
[2]Organisciak DT,Vaughan DK.Retinal light damage:mechanisms and protection[J].Prog Retin Eye Res,2010,29(2):113-134.
[3]Imai S,Inokuchi Y,Nakamura S,et al.Systemic administration of a free radical scavenger,edaravone,protects against light-induced photo-receptor degeneration in the mouse retina[J].Euro J Pharmacol,2010,642(1-3):77-85.
[4]Xie Z,Wu X,Gong Y,et al.Intraperitoneal injection of Ginkgo biloba extract enhances anti-oxidation ability of retina and protects photo-receptors after light-induced retinal damage in rats[J].Cur Eye Res,2007,32(5):471-479.
[5]Yu X,Chen K,Wei N,et al.Dietary taurine reduces retinal damage produced by photo-chemical stress via antioxidant and anti-apoptotic mechanisms in Sprague-Dawley rats[J].Brit J Nutr,2007,98(4):711-719.
[6]Kong JM,Chia LS,Goh NK,et al.Analysis and biological activities of anthacyanins[J].Phyto Chemistry,2003,64(5):923-933.
[7]陈玮,凌文华,余小平,等.黑米花青素在大鼠视网膜光化学损伤中的抗氧化作用研究[J].营养学报,2010,32(4):341-344.
[8]陈玮,凌文华,吕小飞,等.花青素对大鼠视网膜光化学损伤防护作用[J].中国公共卫生,2011,27(4):464-465.
[9]Zhang WH,Wang X,Narayanan M,et al.Fundamental role of the Rip2_caspase-1pathway in hypoxia and ischemiainduced neuronal cell death[J].PNAS,2003,100(2-6):16012-16017.
[10]Katai N,Kikuchi T,Shibuki H,et al.Caspaselike proteases activated in apoptotic photoreceptors of royal college of surgeons rats[J].Invest Ophthalmol Vis Sci,1999,40(8):1802-1807.
[11]Krishnamoorthy RR,Crawford MJ,Chaturvedi MM,et al.Photo-oxidative stress down-modulates the activity of nuclear factor-kB via involvement of Caspase-1,leading to apoptosis of photoreceptor cells[J].J Bio Chem,1999,274(6):3734-3743.
[12]Wu T,Chiang SK,Chau FY,et al.Light-induced photoreceptor degeneration may involve the NFκB/Caspase-1 pathway in vivo[J].Brain Res,2003,967(1-2):19-26.

