紫苏乙醇提取物抑菌活性研究
程道梅,王中凤,曾凡坤,余小平
(1.成都医学院公共卫生系,四川 成都 610083;2.西南大学食品科学学院,重庆 400716)
高效、安全或具有一定的营养保健功能的天然食品防腐剂的研发已成为营养与食品卫生领域研究的热点之一[1,2]。紫苏(Perilla frutescens(L.)Britt)是我国卫生部公布的药食两用植物之一,在医药、食品等领域具有重要开发价值,但关于其抗菌活性,国内外的研究大多局限于紫苏精油[3,4]。本研究以紫苏茎叶为原料,对其乙醇提取物的抗菌性能及相关影响因素进行了比较系统的分析,以期为紫苏抗菌资源的合理开发利用提供一定的理论基础。
1 材料与方法
1.1 材料
紫苏茎叶购自重庆市中药研究所标本园。大肠杆菌Escherichia coli;枯草芽孢杆菌Bacillus subtilis;金黄色葡萄球菌Staphylococcus arueus;总状毛霉Mucor racemosus;米根霉Rhizopus oryzae;青霉Penicillium sp;黑曲霉Aspergillus niger723;热带 假 丝 酵 母 Candia tropicalis(Castellani)Berkhout;啤酒酵母Sacharomyces cerevisiae JW-23。分别由西南农业大学食品学院、资源环境学院和动物养殖学院微生物教研室提供。霉菌用培养基:高盐察氏培养基[5]。细菌用培养基:牛肉膏蛋白胨培养基[6]。酵母菌用培养基:麦氏琼脂[5]。结晶紫染色液、沙黄复染液、革兰氏碘液[6]。伊红美蓝琼脂培养基:上海市医学化验所试剂厂。
1.2 方法
1.2.1 抗菌成分提取工艺流程 紫苏茎叶→干燥→粉碎→浸提→过滤→浓缩→过滤除菌→提取液原液(1g/ml,即1ml提取液相当于1g紫苏干物质[7])。
1.2.2 抗菌性试验方法-滤纸片法[8]菌悬液的制备:梯度稀释法。恒温培养后,以菌能长满整个培养皿且分布均匀为适宜的菌液浓度。滤纸片的制备:将滤纸制成直径为8mm的圆片,160℃干热灭菌2h,浸入各提取液及乙醇中,4h后取出,无菌条件下晾干备用。抑菌效力的测定:将滤纸片放到涂布了菌悬液的平板培养基表面,恒温培养后,量取抑菌圈直径,直径越大抗菌活性越强。
1.2.3 最低抑菌浓度(MIC)的测定-平板稀释法[5,6]取适量提取液原液加入到无菌培养皿中与培养基混合均匀,使提取液的浓度分别为10%、5%、2.5%、1.25%、0.625%、0.313%。吸取适宜浓度的菌悬液,恒温培养。以完全无菌生长的最低浓度作为紫苏提取液的最低抑菌浓度(MIC)。以乙醇作对照。
1.2.4 抗菌活性pH值范围的测定 用0.1mol/L柠檬酸溶液和2%NaOH溶液分别调节培养基pH 值为3、4、5、6、7、8。然后用各菌的 MIC浓度的提取液进行抗菌性试验,以乙醇作对照,确定其pH活性范围(方法同MIC)。
1.2.5 抗菌活性成分的热稳定性试验 将提取液原液分别置于80、100、121℃的湿热条件下处理15min后,以对各菌的MIC浓度的提取液进行抗菌试验,考察抗菌活性成分的热稳定性。
1.2.6 食盐、蔗糖对紫苏提取液抗菌活性的影响试验 在基础培养基中分别加入氯化钠和蔗糖,使氯化钠含量分别达到3%、5%、7%、9%,蔗糖含量分别为30%、40%、50%,以比各菌的 MIC低一个浓度梯度的提取液原液进行抗菌试验,以乙醇为对照(方法同MIC测定)。
2 结果
2.1 紫苏乙醇提取液抗菌谱
紫苏茎叶的95%乙醇提取液抗菌谱较广,对所试细菌、酵母和霉菌均有明显的抑制效果,抑制强度依次为细菌、酵母、霉菌(表1)。

表1 乙醇提取液的抗菌活性Tab.1 Antimicrobial activity of Perilla frutescens alcohol extracts
2.2 紫苏乙醇提取液对各菌的最低抑菌浓度(MIC)
提取液浓度为0.625%时,3种细菌的生长即完全受到抑制;提取液浓度为1.25%时,酵母菌和霉菌的生长被完全抑制。而对照培养皿中各菌均表现出强的生长势。因此,紫苏提取液对所试细菌的MIC为0.625%,对所试酵母菌和霉菌的 MIC为1.25%。(表2)
2.3 pH对紫苏乙醇提取液抗菌活性的影响
在pH3~7范围内,当提取液的浓度分别为0.625%(对细菌)和1.25%(对酵母菌和霉菌)时,均能完全抑制所试微生物的生长,随着pH进一步升高,达到8时,抑制活性有所减弱,微生物有所生长,但其生长势比对照弱。未添加紫苏提取液的基质,在pH<5时,各菌的生长受到较大程度抑制,但当pH为6以上时,对各菌的生长抑制减弱(表3)。

表2 乙醇提取液浓度对其抑菌效力的影响Tab.2 Antimicrobial potency of different Perilla frutescens extract concentration
2.4 紫苏提取液抗菌活性的热稳定性试验
100℃,加热15min,紫苏提取液的抗菌活性不受影响,121℃,15min的高温处理会使其抗菌活性减弱(表4)。
2.5 食盐、蔗糖对紫苏提取液抗菌活性的影响
与对照相比,以0.313%紫苏提取液+3%食盐培养的细菌生长势明显减弱。当食盐浓度为5%时,细菌的生长完全受到抑制。以0.625%紫苏提取液+3%~5%食盐培养的酵母菌和霉菌的生长势较对照减弱,食盐浓度为7%以上时,其生长完全被抑制,而对照皿中,当食盐浓度为7%以上时,所试各菌仍能生长(表5)。
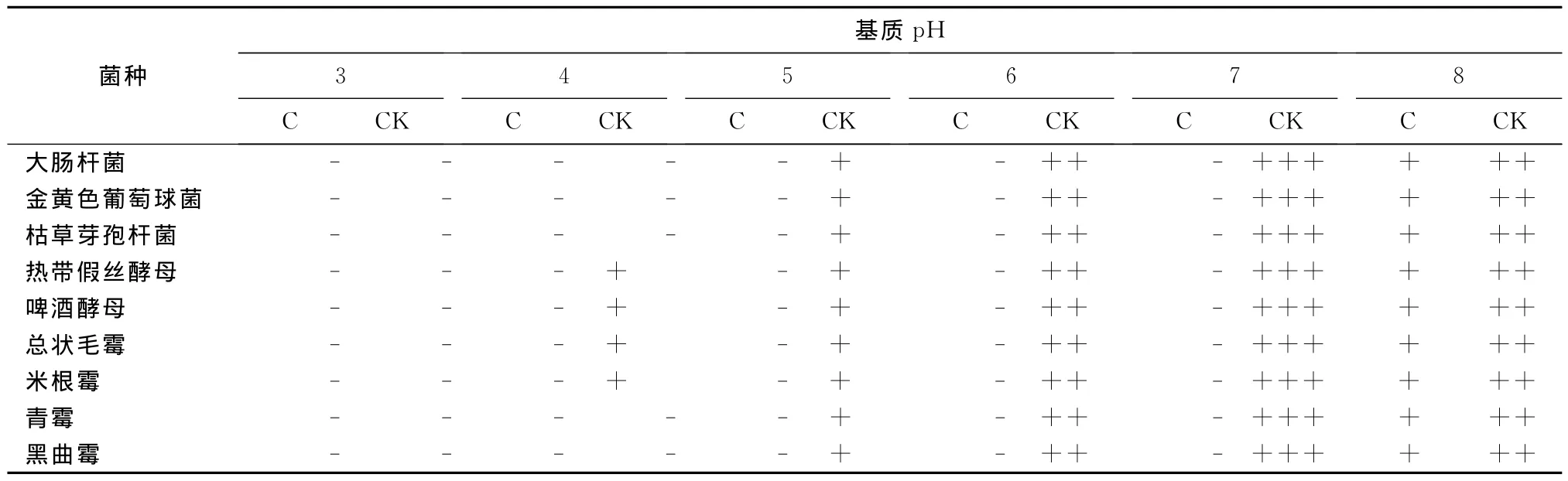
表3 基质pH对紫苏抗菌活性的影响Tab.3 Effect of base pH on antimicrobial activity of Perilla frutescens
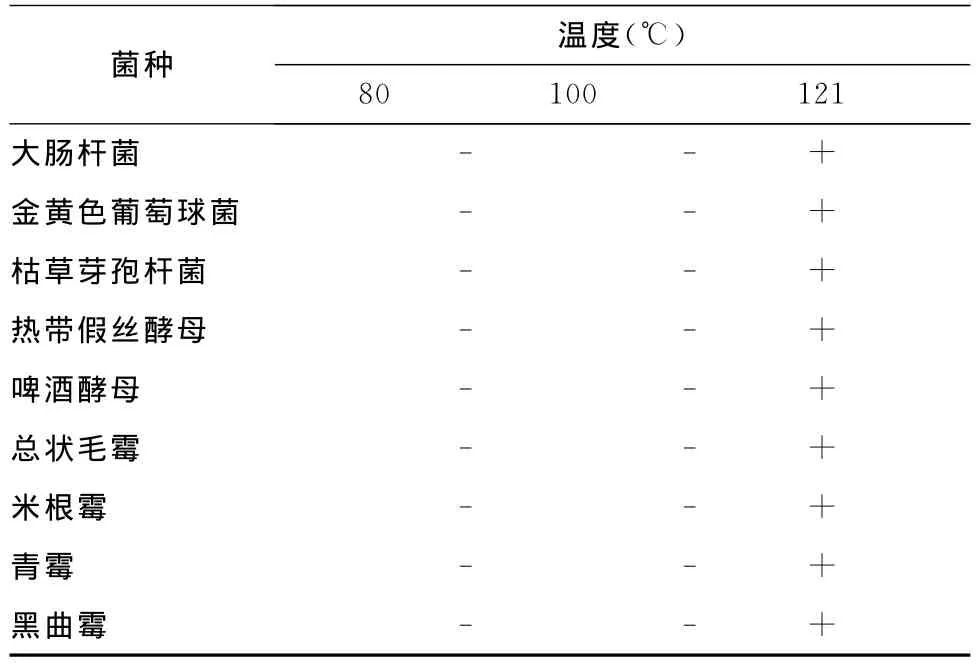
表4 热处理对提取液抗菌活性的影响Tab.4 Effect of heat-treatments on antimicrobial activity of perilla frutescens extract
紫苏提取液浓度为0.313%,蔗糖浓度为40%时,细菌的生长即完全受到抑制。当其浓度为0.625%,蔗糖浓度为30%~40%时,酵母菌和霉菌的生长势较对照减弱,而对照皿中,当蔗糖浓度为50%时,各菌仍能生长(表6)。
3 讨论
性能良好的食品防腐剂应具有广谱、高效、安全、热稳定性好等特性[9]。紫苏为“药食两用”植物资源,具有抗氧化、抑酶、抑菌等特性[10],在食品、药品领域均有悠久的应用历史。紫苏中含有紫苏醛、丁香酚、苏烯酮、紫苏醇、柠檬烯、柠檬醛、多酚类等多种生物活性物质[11,12],尤其是多酚类和黄酮类,可通过作用于微生物的细胞亚结构而具有广谱的抑菌作用[13]。有学者通过对紫苏抗菌作用的研究发现,紫苏油中的挥发性成分紫苏醛和柠檬醛具有一定的协同抗真菌能力。还有研究表明,紫苏油和桂皮油对蜂蜜的保藏存储中自然污染的霉菌和酵母菌的抑制能力明显高于尼泊金乙酯和苯甲酸。本研究的结果也显示紫苏提取液抑菌谱较广,对细菌、霉菌和部分酵母菌抑制作用较强,最低抑菌浓度MIC较低(细菌0.625%;霉菌、酵母菌:1.25%),与黄丹和刘达玉[14]的研究结果一致。
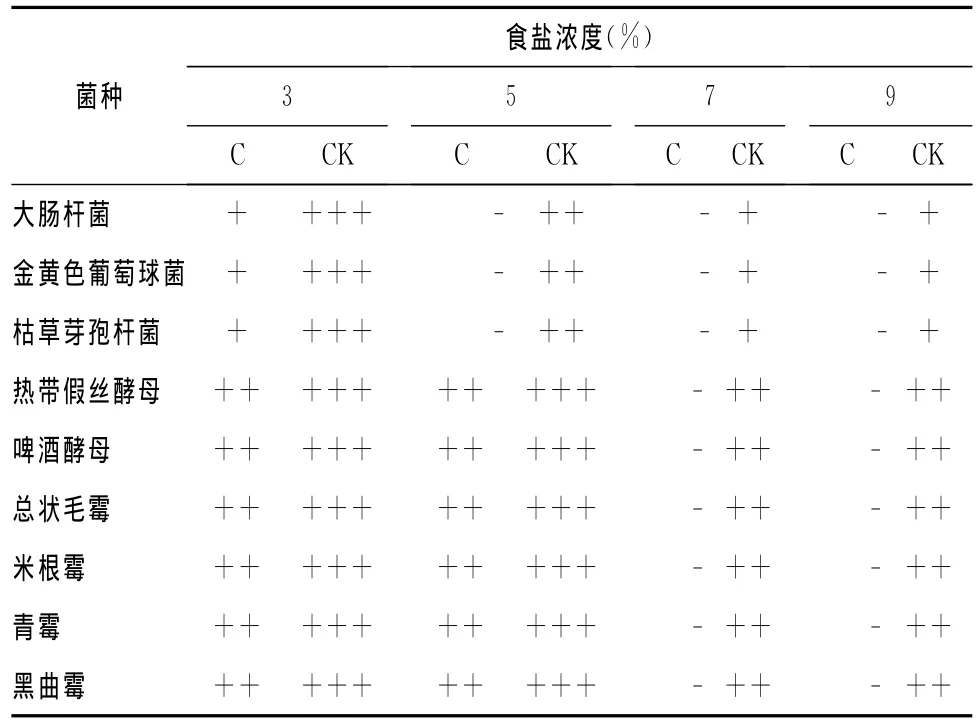
表5 紫苏提取液与食盐的协同抑菌作用Tab.5 Synergic antimicrobial effect between Perilla frutescens extract and salt
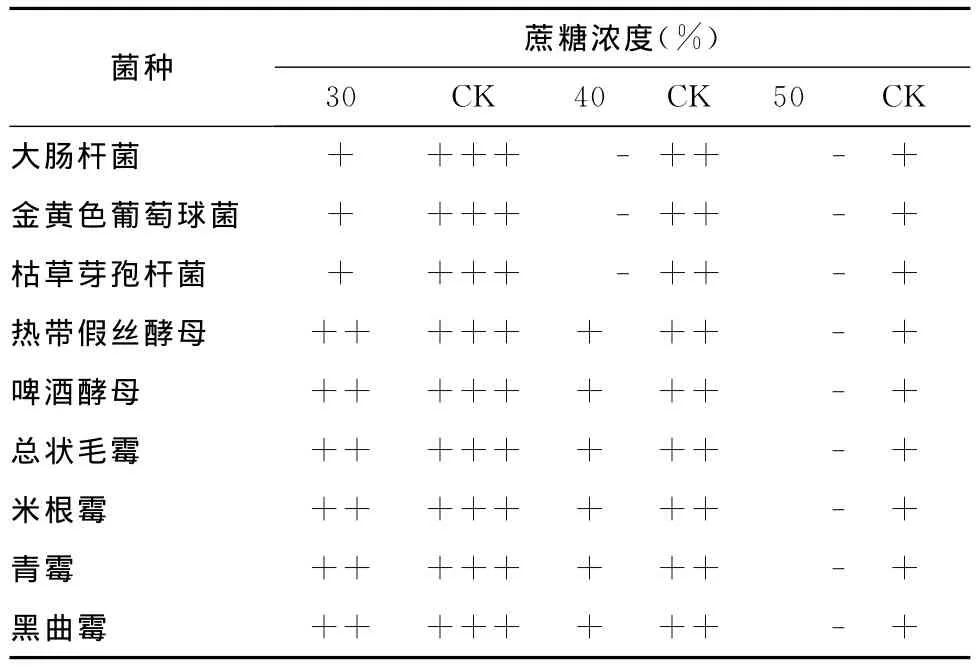
表6 蔗糖对紫苏提取液抗菌活性的影响Tab.6 Effect of sucrose on antimicrobial activity of Perilla frutescens extract
常用的苯甲酸、山梨酸及其盐类为酸性防腐剂,在酸性条件下才能发挥较好的防腐效果[15]。本研究结果显示在pH3~8范围内,紫苏提取液能较好抑制所试微生物的生长,可见其具有较宽的pH值范围,不仅可用于酸性食品,还可用于弱碱性食品的保藏。
加热是食品加工与保藏中最重要的处理方法之一,防腐剂要发挥其抑菌作用必须具有一定的耐热性。本研究结果显示,紫苏提取液热稳定性较好,100℃加热15min抗菌活性不受影响。
此外,食盐和蔗糖为食品中的常见成分,均会对防腐剂的功能发挥产生一定影响[15,16]。而本研究结果显示紫苏提取液与5%以上食盐及40%以上浓度的蔗糖存在明显协同抑菌作用。提示可将其应用于腌渍等食品中。我国民间早有将紫苏叶放入泡菜坛中抑制白膜生长的实践,效果良好。高建华和秦燕[17]将紫苏醛应用在肉制品防腐试验中,发现可有效降低微生物的生长能力,减少其生长量。综上所述,紫苏可作为一种优质的天然抗菌植物资源加以开发利用。本课题组的另一篇文章将报道紫苏茎叶乙醇提取物在卤肉等食品中的防腐效果及其抑菌活性成分的分离方法,为进一步研究其抑菌机理提供线索。
[1]肖素荣,李京东.天然食品防腐剂及其发展前景[J].中国食物与营养,2007,10(6):130-133.
[2]李娟萍,吕嘉枥.生物防腐剂在乳制品中的应用[J].食品研究与开发,2007,28(1):162-165.
[3]郭群群,杜桂彩,李荣贵.紫苏叶挥发油抗菌活性研究[J].食品工业科技,2003,24(9):25.
[4]Chen JH,Xia ZH,Tan RX.High-performance liquid chromatographic analysis of bioactive triterpenes in Perilla frutescens[J].J Pharma Bio Anal,2003,32(1):1175-1179.
[5]沈萍,范秀容,李广武.微生物学实验[M].北京:高等教育出版社,1999:157.
[6]孟昭赫.食品卫生检验方法注解-微生物学部分[M].北京:人民卫生出版社,1990:50.
[7]周邦靖.常用中药的抗菌作用及其测定方法[M].重庆:科学技术出版社重庆分社,1987:289.
[8]郑钧镛,王光宝.药品微生物学及检验技术[M].北京:人民卫生出版社,1989:351-352.
[9]高彦祥.食品添加剂[M].北京:中国轻工业出版社,2011:15.
[10]黄丹,严芳,刘达玉,等.紫苏提取物的特性及应用[J].安徽农业科学,2010,38(10):5094-5096.
[11]于长青,赵煜,朱刚,等.紫苏叶的药用研究[J].中国食物与营养,2008,11(1):52-53.
[12]蒲海燕,李影球,李梅.紫苏功能性成分及其产品开发[J].中国食品添加剂,2009,30(2):133-137.
[13]郭群群,杜桂彩,李荣贵,等.紫苏抗菌活性成分的研究[J].高等学校化学学报,2006,27(7):1292-1294.
[14]黄丹,刘达玉.紫苏提取物抑菌特性研究[J].食品工业,2007,28(3):11-13.
[15]刘钟栋.食品添加剂原理及应用技术[M].北京:中国轻工业出版社,2000:4-7.
[16]万素英,李琳,王慧君.食品防腐与防腐剂[M].北京:中国轻工业出版社,1998:95.
[17]高建华,秦燕.一些天然防腐剂的抗菌效果[J].广州食品工业科技,1997,13(3):5-7.