免疫亲和柱净化-高效液相色谱法测定大米、玉米、辣椒中的橘霉素
许艳丽,鲍 蕾,吴振兴,吕 宁,赵 峰,梁成珠
免疫亲和柱净化-高效液相色谱法测定大米、玉米、辣椒中的橘霉素
许艳丽,鲍 蕾,吴振兴,吕 宁,赵 峰,梁成珠
(山东出入境检验检疫局检验检疫技术中心,山东 青岛 266001)
建立免疫亲和柱净化-高效液相色谱法测定农产品中橘霉素的方法。试样经甲醇-水提取,稀释、过滤后通过含有橘霉素特异性抗体的免疫亲和柱净化,洗脱液用C18色谱柱、乙腈-三氟乙酸溶液(60:40,V/V)分离,荧光检测器测定(激发波长331nm,发射波长500nm),外标法定量。结果表明:色谱峰面积与橘霉素含量之间有良好的线性关系,方法的检出限为10μg/kg,定量限为30μg/kg,加标回收率为61%~96.6%,相对标准偏差为3. 72%~6.40%。该方法操作简便、准确,回收率高、精密度良好、重现性好,可用于大米、玉米、辣椒中橘霉素的测定。
橘霉素;农产品;免疫亲和柱净化;高效液相色谱
橘霉素是由青霉属和曲霉属的某些菌株产生的真菌毒素,经常出现于面粉、大米、玉米和饲料当中[1]。橘霉素可溶于有机溶剂。红曲霉可产生色素、抑菌素多种次级代谢产物, 能够降低胆固醇、降血压、降血糖,为人类造福,但是红曲色素的提取采用有机溶剂提取,故采用目前工艺得到的红曲色素可能含有橘霉素;橘霉素的存在也会污染红曲色素及红曲产品,如酶、酱、红曲米、功能性红曲、红曲米粉、红曲红色素(粉状、液态)、红曲黄色素(粉状)、酿酒用曲、红曲类保健食品等;实验证明红曲霉菌产橘霉素是普遍性的问题,橘霉素是红曲霉固有的次级代谢产物,这是菌种本身特性(基因)所决定的[2]。近年来的调查研究发现,在许多农产品如玉米、大米、奶酪、苹果、梨和果汁等食品和农产品中都有可能检测到橘霉素和分离到产橘霉素的菌株,不同的菌株之间产毒能力和产毒条件差异很大,为预防和控制带来了困难。因此,橘霉素引起的污染问题越来越受到人们的关注。
日本厚生省在2000年版的“日本食品添加剂标准”中率先制订出红曲色素中橘霉素国家限量标准0.2mg/kg[3],这一剂量是当时能够检出的橘霉素的最低剂量,德国等西方国家也都制定了针对我国出口的红曲相关产品的新标准,规定橘霉素的含量必须低于规定值,否则严禁进口销售,韩国规定限量为50μg/kg,考虑到欧美对我国产品的要求,我国新的行业标准中确定限量为50μg/kg。但目前在我国,还没有建立其他农产品如大米、玉米和辣椒中橘霉素含量测定的国标方法及限量标准。
目前,国内外对橘霉素的检测方法主要有比色法、色谱法、酶联免疫分析等方法[4-10]。比色法的样品回收率低,灵敏度较差;薄层层析法的灵敏度低且重现性差,所以多用于橘霉素的定性检测;酶联免疫分析的方法检测橘霉素灵敏度高,但抗体制备复杂、费用较高不适合批量检测,干扰因素较多,重现性差。而且目前现有的检测方法多用于红曲及红曲制品中橘霉素的检测,对于其他农产品中橘霉素的检测很少有报道[11-18]。本实验拟采用免疫亲和柱净化-高效液相色谱法,建立大米、玉米、辣椒中橘霉素的检测方法。
1 材料与方法
1.1 试剂与仪器
橘霉素标准品 美国Alexis公司;橘霉素免疫亲和柱 美国Vicam公司;甲醇、乙腈(均为色谱纯);三氟乙酸 Sigma公司;标准储备液:将1mg橘霉素粉末以甲醇溶解并定溶至10.0mL作为标准储备液;2mol/L Toledo NaOH溶液:称取80.0g固体NaOH,溶于1000mL水中;三氟乙酸溶液:1000mL超纯水中加入0.5mL三氟乙酸,用2mol/L NaOH溶液调节pH2.5;稀释液:用2mol/L的NaOH溶液将三氟乙酸水溶液调节pH7.5。
1200高效液相色谱仪(配荧光检测器) 美国Agilent公司:PM480称量天平 瑞士Mettler Toledo公司;Ultra-turrax T-25高速均质器 美国IKA公司;Maxi mixⅡ混匀器 美国Thermolyne公司;纯水系统 美国Millipore公司;玻璃纤维滤纸 美国Vicam公司。
1.2 方法
1.2.1 样品提取
称取粉碎样品(2mm)10.0g(精确至0.1g)于500mL具塞锥形瓶中,加入50mL甲醇-水(70:30,V/V)提取液,以均质器高速搅拌提取2min,过滤。移取1.0mL上步的滤液,置于另一干净的容器中,加入49mL稀释液稀释、混匀。以玻纤滤纸过滤几次,直至滤液澄清,随即进行免疫亲和柱净化。
1.2.2 免疫亲和柱净化
将免疫亲和柱连接于10mL玻璃针筒下,准确移取10.0mL(相当于0.04g试样)上述澄清滤液过免疫亲和柱,以1~2滴/s的流速全部通过亲和柱,再使2~3mL空气流经亲和柱;加入5mL稀释液以1~2滴/s的流速淋洗柱子,弃去全部流出液;准确加入1.0mL洗脱液进行洗脱,洗脱流速为1~2滴/s。收集全部洗脱液于玻璃试管中,供检测用。
1.2.3 色谱条件
色谱柱:Agilent ZORBAX SB-C18(150mm×4.6mm, 5μm);流动相:乙腈-三氟乙酸水溶液(60:40,V/V);流速:1.0mL/min;激发波长331nm,发射波长500nm;进样量:100μL。
1.2.4 色谱测定
用橘霉素标准储备液分别配制5个不同浓度的标准溶液,在1.2.3节色谱条件下测定,进样量为100μL,以响应度为纵坐标、出峰时间为横坐标,绘制标准曲线,以保留时间定性、外标法定量。
2 结果与分析
2.1 色谱条件的优化
2.1.1 不同流动相对色谱图的影响

图1 不同流动相条件下的橘霉素色谱图Fig.1 Chromatograms of citrinin using different mobile phase composition (various mixture of water and acetonitrile or methanol)
本实验比较了甲醇和乙腈作为流动相对橘霉素色谱峰形的影响(图1)。从图1可以看出,以甲醇作为流动相时,保留时间为4.107min,橘霉素峰拖尾现象严重且峰形不好;乙腈作为流动相时,橘霉素保留时间为3.423min,峰形良好,陈蕴等[18]在测定红曲样品中的橘霉素时用甲醇溶液作为流动相,也发现橘霉素峰的拖尾现象较严重,并且与杂质无法分离,会造成橘霉素保留时间不稳定,故选择乙腈为流动相。
2.1.2 流动相不同比例对色谱图的影响
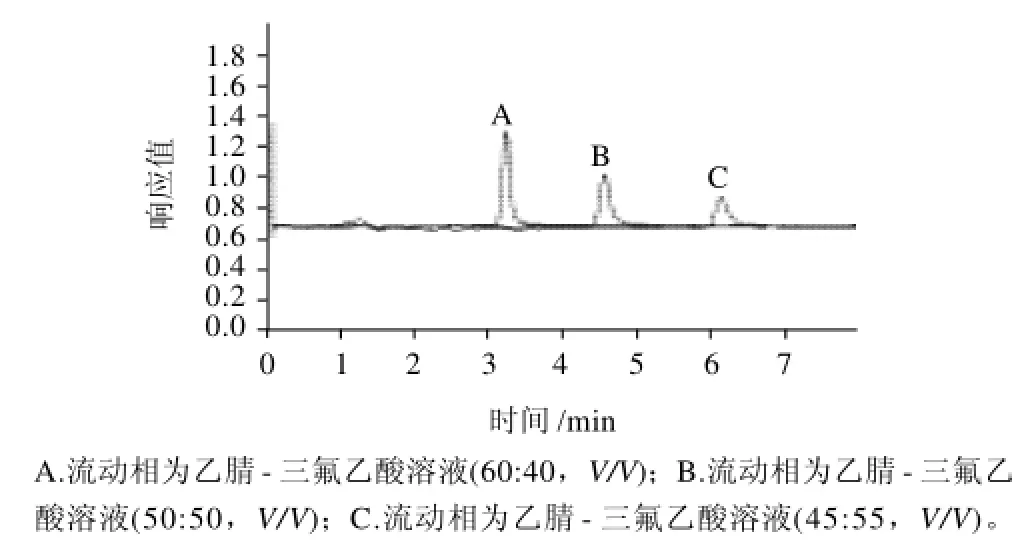
图2 不同流动相配比条件下的橘霉素色谱图Fig.2 Chromatograms of citrinin using mixed acetonitrile and TFA aqueous solution at various ratios as a mobile phase
采用乙腈-三氟乙酸水溶液作为流动相,分别考察了乙腈-三氟乙酸水溶液3种不同比例对色谱图的影响(图2)。
由图2可以看出,随着乙腈比例的降低,橘霉素的保留时间逐渐延后,当乙腈体积分数60%时,出峰时间为3.2min,当乙腈体积分数降为45%时,出峰时间为6.2min,但是色谱图拖尾且峰形不好,所以本实验选取乙腈-三氟乙酸溶液体积配比为60:40。
2.1.3 不同流速对分离效果的影响
本实验在流动相比例为60:40的条件下设计了几个不同的流速(图3)。

图3 不同流速对橘霉素峰形的影响Fig.3 Effect of flow rate on peak shape of citrinin during separation
由图3可以看出,随着流速的降低,橘霉素的保留时间也在逐渐延后,但是橘霉素的峰拖尾现象也比较严重;当流速为1mL/min时,橘霉素的保留时间为3.2min,色谱峰形很好。

图4 添加橘霉素的辣椒粉色谱图Fig.4 Chromatogram of pepper powder spiked with citrinin standard
辣椒中色素含量比较高,在提取过程中色素杂质易与目标物质结合,使分离效果差,由图4可以看出,流动相比例为60:40、流速为1mL/min时,样品中的橘霉素峰与杂质峰可以有效分离,不会影响样品中橘霉素的检测。
2.2 方法可靠性评价
2.2.1 线性范围
按上述色谱测定方式,配制62.5、125、250、500、 1000μg/kg的标准溶液作标准曲线,在1.2.3节色谱条件下测定,结果相关系数为0.99992,在62.5~1000μg/kg范围内有良好的线性关系。
2.2.2 方法检出限和检测限
经测定信噪比(RSN)确定,方法的检出限为10μg/kg (RSN≥3),见图5;方法的定量限为30μg/kg(RSN≥10),见图6。本方法能够满足国际中的限量要求。

图5 橘霉素检出限液相色谱图(10μg/kg)Fig.5 Chromatogram of citrinin at the detection limit level (10μg/kg)

图6 橘霉素定量限液相色谱图(30μg/kg)Fig.6 Chromatogram of citrinin at a concentration of 30μg/kg
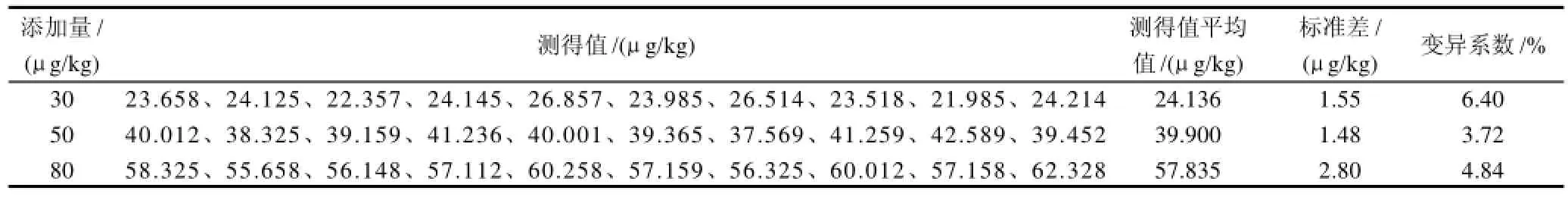
表1 精密度实验结果Table 1 Results of precision experiments
2.2.3 方法回收率
以空白样品(大米粉、玉米粉、辣椒粉)为基底,添加3个水平(30、50、80μg/kg),按1.2节操作,每水平进行10次平行实验,结果显示大米粉不同添加水平的回收率在66.0%~96.5%之间;玉米粉不同添加水平的回收率范围在61.0%~96.6%之间;辣椒粉不同添加水平的回收率范围在62.3%~91.9%之间。
2.2.4 方法的精密度
在空白样品(玉米粉)中添加橘霉素标准溶液,添加3个水平为 30、50、80μg/kg,每水平进行10次平行实验,结果如表1所示。
3 结 论
本研究建立了免疫亲和柱净化-高效液相色谱法检测农产品中橘霉素的方法。免疫亲和柱净化,能够快速、特异地将橘霉素从样品中分离出来,净化程序简单、净化率高,适合玉米、大米、辣椒等农产品中橘霉素的检测。方法的定量限为30μg/kg,相对标准偏差3.72%~6.40%。该方法特异性高、简便快速、灵敏准确、可重复性好、应用范围广,满足出入境检验工作的要求。方法采用先进的生物技术,而不使用有毒的有机溶剂如氯仿、二氯甲烷等,所以对操作人员的安全更有保障。
[1]刘仁荣, 许杨. 橘青霉素简介及其免疫学检测方法研究紧张[J]. 卫生研究, 2004, 33(1): 124-127.
[2]赖卫华, 许杨. 红曲霉产橘霉素的研究动态[J]. 食品科学, 2002, 23 (7): 139-141.
[3]日本食品添加物协会. 食品添加物公定书[M]. 7版. 东京: 日本添加物协会, 1999: 1238-1241.
[4]VAZQUEZ B I, FENTE C, FRANCO C M, et al. Inhibitory effects of eugenol andthymol on Penicillium citrinum strains in culture media and cheese[J]. International Journal of Food Microbiology, 2001, 67(1/2): 157-163.
[5]ODHAV B, NAICKER V. Mycotoxins in South African traditionally brewedbeers[J]. Food Additives and Contaminants, 2002, 19(1): 55-61.
[6]SHU P Y, LIN C H. Simple and sensitive determination of citrinin in monascus by GC-selected ion monitoring mass spectrometry[J]. Analytical Sciences, 2002, 18(3): 283-287.
[7]CHEN Fusheng, HU Xiaoqing. Study on red fermented rice with high concentration of monacolin K and low concentratration of citrinin[J]. International Journal of Food Microbiology, 2005, 103: 331-337.
[8]陈旭峰, 周立平, 孙佰坤, 等. 红曲霉所产橘霉素及其检测与控制[J].酿酒, 2004, 31(4): 113-116.
[9]潘振球, 冯家力. 液相色谱-串联质谱法检测食品中的橘霉素[J]. 中国卫生检验杂志, 2008(1): 33-36.
[10]陈福生, 邢淑婕. 红曲产品中橘霉素含量的ELISA测定[J]. 食品科学, 2004, 25(8): 56-59.
[11]熊勇华, 谭文辉. 橙色红曲菌液体发酵产橘霉素特性的研究[J]. 食品科学, 2004, 25(8): 69-72.
[12]黄志兵, 李燕萍. HPLC法测定橙色红曲菌As3.4384及其诱变体发酵产物中的橘霉素[J]. 2006(12): 148-151.
[13]文镜, 徐东. 红曲中橘霉素的HPLC-苯基柱分离分析[J]. 中国酿造, 2010(6): 35-39.
[14]林亲录, 何煜波, 刘素纯, 等. 高效液相色谱(HPLC)法分析大米红曲中的橘霉素[J]. 食品科学, 2002, 23(8): 43-47.
[15]钱志伟, 杨丹丹. HPLC法测定酯化红曲霉发酵液中橘霉素含量[J].酿酒科技, 2010(3): 107-109.
[16]班昭, 王昌禄. 红曲霉发酵液中橘霉素快速检测方法的优化[J]. 氨基酸和生物资源, 2010(2): 70-73.
[17]王彩霞, 肖杰, 孙爱东, 等. 高效液相色谱法检测红曲米中的橘霉素[J]. 中国粮油学报, 2010(7): 125-128.
[18]陈蕴, 许赣荣, 虞慧玲. 红曲橘霉素高效液相色谱测定条件的优化[J]. 食品与发酵工业, 2004, 30(1): 118-122.
Determination of Citrinin in Agricultural Products by Immunoaffinity Column Clean-up Coupled with HPLC
XU Yan-li,BAO Lei,WU Zhen-xing,LU Ning,ZHAO Feng,LIANG Cheng-zhu
(Technical Center of Inspection and Quarantine, Shandong Entry-exit Inspection and Quarantine Bureau, Qingdao 266001, China)
A HPLC coupled with immunoaffinity column cleanup method for the determination of citrinin in agricultural products such as rice, corn and pepper was established. Samples were extracted with methanol aqueous solution and cleaned up on a column containing anti-citrinin specific antibody. The chromatographic separation was performed on a C18column (150 mm × 4.6 mm, 5μm) eluted by a mobile phase composed of acetonitrile and TFA solution at a ratio of 60:40 (V/V). A fluorescence detector with 331 nm excitation wavelength and 500 nm emission wavelength was used for the quantification of citrinin in an external standard mode. Peak area and citrinin concentration displayed an excellent linear relationship. The limit of detection of this method was 10μg/kg and limit of quantitation was 30μg/kg. The spike recovery rates for citrinin were between 61% and 96.6%, with relative standard deviations ranging from 3.72% to 6.40%. This method has the characteristics of ease of operation, accuracy, high recovery, excellent precision and good reproducibility and is suitable for the determination of citrinin in rice, corn and pepper.
citrinin;agricultural products;immunoaffinity column cleanup;high performance liquid chromatography (HPLC)
TS207.3
A
1002-6630(2011)04-0159-04
2010-03-10
国家质量技术监督检验检疫总局项目(2009IK167)
许艳丽(1981—),女,工程师,硕士,主要从事真菌毒素及其检测研究。E-mail:evillive1124@163.com

