响应面法对大豆胰蛋白酶抑制剂粗提工艺的优化
梁雪华,朱秀清,2,*,郑环宇,2,张智宇
响应面法对大豆胰蛋白酶抑制剂粗提工艺的优化
梁雪华1,朱秀清1,2,*,郑环宇1,2,张智宇1
(1.东北农业大学食品学院,黑龙江 哈尔滨 150030;2.国家大豆工程技术研究中心,黑龙江 哈尔滨 150030)
目的:对大豆胰蛋白酶抑制剂粗提工艺进行优化。方法:以提取液pH值、热变性温度和硫酸氨饱和度作为影响大豆胰蛋白酶抑制剂提取率的因素,通过单因素试验选取因素与水平,根据Box-Behnken中心组合试验设计原理,在单因素试验基础上采用三因素三水平响应面分析法,依据回归分析确定各工艺条件的主要影响因素,以大豆胰蛋白酶抑制剂提取率为响应值作响应面分析。结果:胰蛋白酶抑制剂提取的最佳工艺条件为提取液pH5.1、热变性温度72.8℃、硫酸氨饱和度54.5%,在此条件下,胰蛋白酶抑制剂的提取率达到86%。结论:采用响应面分析法可以对大豆胰蛋白酶抑制剂粗提工艺进行优化。
大豆胰蛋白酶抑制剂;粗提;Box-Behnken中心组合试验
胰蛋白酶抑制剂是大豆的主要抗营养因子,是一种含氨基酸残基72~197个范围的多肽或蛋白质[1]。目前从大豆中已分离出两种类型的蛋白酶抑制剂:一种为Kunitz型蛋白酶抑制剂(KSTI),相对分子质量为2万,分子内有两个二硫键;另一种为Bowman-Birk型胰蛋白酶抑制剂(BBI),由71个氨基酸组成的多肽,分子质量7975D,分子内有7个二硫键[2-3]。有研究发现,胰蛋白酶抑制剂有许多重要的功能,如胰蛋白酶抑制剂是一类天然的抗虫物质[4],在生物的生理体系中具有重要的调节作用[5],在肿瘤抑制方面也具有潜在的应用价值;另有研究表明大豆中微量胰蛋白酶抑制剂对于糖尿病治疗[6-7],调节胰岛素失调可能有一定效果[8]。胰蛋白酶抑制剂在大豆中含量较少,大约为2%,因此对胰蛋白酶抑制剂提取工艺优化具有重要意义。
响应面法(response surface methodology,RSM)采用多元二次回归方程拟合因素与响应值之间的函数关系,通过对回归方程的分析来寻求最优工艺参数,解决多变量问题,在食品工业中已得到了广泛应用[9]。本实验拟在单因素试验基础上,利用响应面分析法对大豆胰蛋白酶抑制剂的粗提工艺进行优化,为其工业化生产提供一定参考。
1 材料与方法
1.1 材料与仪器
低温脱脂豆粕 哈尔滨高科技有限公司;BAPNA、胰蛋白酶、胰蛋白酶抑制剂 美国Sigma公司;其他试剂均为分析纯。
电子天平 北京赛利多斯仪器系统有限公司;TU-1901型双光速紫外-可见分光光度计 北京普析通用仪器有限公司;高速离心机;PHS-3C型酸度计;HH-8恒温水浴锅。
1.2 方法
1.2.1 大豆胰蛋白酶抑制剂标准曲线的绘制
胰蛋白酶抑制剂反应试管:分别加入0.4、0.8、1.2、1.4、1.6、1.8mL 0.01g/100mL胰蛋白酶抑制剂,用蒸馏水补至2mL,加40mg/100mL BAPNA溶液5mL,40mg/100mL胰蛋白酶溶液2mL,于37℃水浴中反应10min后加入36%乙酸溶液1mL混匀,以终止反应,过滤,用1cm吸收皿,与空白作对比,于波长410nm处测定吸光度。
空白反应试管:分别加入0.4、0.8、1.2、1.4、1.6、1.8mL 0.01g/100mL胰蛋白酶抑制剂,用蒸馏水补至2mL,加40mg/100mL BAPNA溶液5mL,加入36%乙酸1mL混匀,加入40mg/100mL胰蛋白酶溶液2mL,于37℃水浴中反应10min,用1cm吸收皿,于波长410nm处测定吸光度。
1.2.2 大豆胰蛋白酶抑制剂的粗提及活性测定
1.2.2.1 大豆胰蛋白酶抑制剂提取工艺流程
低温豆粕经粉碎过100目筛后称取100g,加入400mL 100mmol/L硫酸抽提,用氢氧化钠调节至设计的pH值,抽提后放置过夜以除杂蛋白,室温下5500×g离心40min,取上清液备用;将沉淀按照上述条件再抽提一次,合并两次上清液。上清液按设计温度热变性处理10min,室温5500×g离心40min,留上清液。调上清液的pH6.0,边搅拌边加入固体硫酸氨至35%饱和度,4℃下放置过夜,室温5500×g离心30min,留上清液。调上清液的pH6.0,搅拌的同时加入固体硫酸铵至所设计的饱和度,4℃条件下放置120min,室温5500×g离心30min留沉淀。沉淀用少量去离子水溶解,对溶液进行超滤(滤膜选择分子质量5000D的膜)除去小分子,超滤后即得胰蛋白酶抑制剂粗提物[10-13]。
1.2.2.2 大豆胰蛋白酶抑制剂活性测定
采用改良的Eriksson法[14-15]。
1.2.2.3 大豆胰蛋白酶抑制剂提取率计算

根据大豆胰蛋白酶抑制剂活性的测定方法可以得到大豆胰蛋白酶抑制剂含量与吸光度之间的关系,再由所得到的标准曲线可以由吸光度计算出大豆胰蛋白酶抑制剂的含量。
1.2.3 影响提取工艺的单因素试验
预实验中发现提取液的pH值、热变性温度、硫酸铵饱和度3个因素对大豆胰蛋白酶抑制剂提取率的影响较大,且相互间存在交互作用。因此,采用上述工艺流程,pH值选择范围4~6.5、热变性温度50~100℃、硫酸铵饱和度45%~70%条件下进行试验,以确定各因素对大豆胰蛋白酶抑制剂提取率的影响。
1.2.4 响应面法优化提取工艺试验
以胰蛋白酶抑制剂提取液的pH值、热变性温度、硫酸氨饱和度3个因素作为参考对象,采用响应面法分析并设计试验,以获得最佳工艺参数。
2 结果与分析
2.1 胰蛋白酶抑制剂标准曲线绘制
标准曲线方程为y=-299.12x+3.0704,R2=0.999,拟合度好。
2.2 提取液pH值的确定
根据预试验,在热变性温度70℃、硫酸铵质量分数50%条件下考察提取液pH值对胰蛋白酶抑制剂提取率的影响,结果见图1。
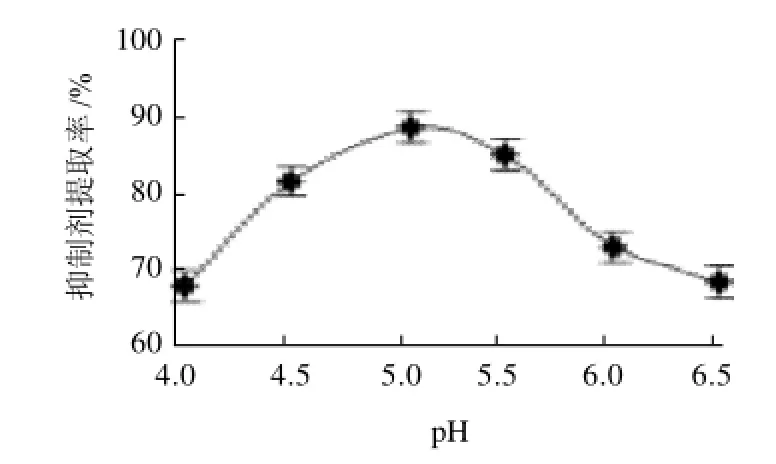
图1 提取液pH值对胰蛋白酶抑制剂提取率的影响Fig.1 Effect of extraction solvent pH on extraction efficiency of trypsin inhibitor
从图1可以看出,当提取液pH5.5时提取率有最大值,而当pH>5.5时提取率随pH值的增加而急剧下降。蛋白质分子中所含氨基酸种类数目、空间结构以及所含其他解离基因的不同,故不同蛋白质有不同的等电点(pI)。当蛋白质溶液处于等电点时,其溶解度、黏度、渗透压、膨胀及电导能力均为最低值。研究发现:pI并不是常数,其在一定程度上决定于介质中的离子组成。所以在下面的响应面试验设计中提取液pH值的水平选择4.5~5.5。
2.3 热变性温度的确定
根据预试验,在提取液pH5.5、硫酸铵质量分数50%条件下考察热变性温度对胰蛋白酶抑制剂提取率的影响,结果见图2。

图2 热变性温度对胰蛋白酶抑制剂提取率的影响Fig.2 Effect of thermal denaturation temperature on extraction efficiency of trypsin inhibitor
从图2可以看出,大豆胰蛋白酶抑制剂提取率在温度50~80℃范围内缓慢降低,而温度超过80℃后大豆胰蛋白酶抑制剂提取率急剧下降。90℃后则又缓慢降低。鉴于此过程主要为除杂蛋白而又不让抑制剂损失过多,所以在下面的响应面试验设计中温度选择60~80℃。
2.4 硫酸氨饱和度的确定
根据预试验,在提取液pH5.5、热变性温度70℃条件下考察硫酸铵饱和度对胰蛋白酶抑制剂提取率的影响,结果见图3。

图3 硫酸铵饱和度对胰蛋白酶抑制剂提取率的影响Fig.3 Effect of ammonium sulfate saturation on extraction efficiency of trypsin inhibitor
由图3可以看出,随着硫酸铵饱和度的不断增加,大豆胰蛋白酶抑制剂提取率先增大后减小,并在硫酸铵饱和度为55%时达到峰值。鉴于投入和产出的关系,在响应面试验设计中硫酸铵饱和度选择在50%~60%。
2.5 响应面设计对工艺参数的优化试验
2.5.1 大豆胰蛋白酶抑制剂粗提工艺的试验设计
根据Box-Behnken中心组合试验设计原理,综合单因素试验结果,选取提取液pH值、热变性温度、硫酸氨饱和度为对大豆胰蛋白酶抑制剂提取量影响较显著的3个因素,采用三因素三水平响应面分析方法,试验以随机次序进行,重复3次,因素与水平设计见表1,响应面分析方案及试验结果见表2。
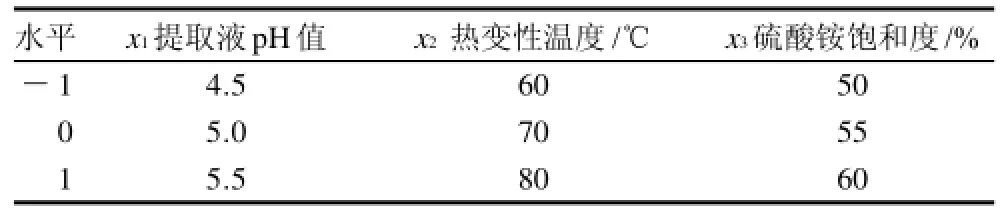
表1 大豆胰蛋白酶抑制剂提取工艺响应面试验因素水平编码表Table 1 Coded values and corresponding actual values of variables in response surface analysis

表2 响应面试验设计及结果Table 2 Scheme and experimental results for response surface analysis
对表2在不同条件下所测得的大豆胰蛋白酶抑制剂提取率,利用Design Expert 7.1统计软件进行回归拟合,得到大豆胰蛋白酶抑制剂提取率(Y)的回归方程:

2.5.2 模型方差分析
利用Design Expert 7.1统计软件进行二次多元回归拟合,得到回归方程模型的方差分析和回归方程系数估计值,见表3。
由表3可知,3个因素的P值相差较大,对提取结果的影响顺序:热变性温度>提取液pH值>硫酸铵饱和度。从方差分析可以看出模型P<0.01,表明该模型方程高度显著,不同处理间的差异高度显著。模型失拟项P=0.0758>0.05,模型失拟项不显著,模型选择合适。由此可见,各具体试验因素对响应值的影响不是简单的线性关系。相关系数R2=1394.98/1448.53= 0.963>0.8,说明提取率实际值与预测值之间具有较好的拟合度,因此该模型可用于预测响应值大豆胰蛋白酶抑制剂提取率的实际情况。

表3 回归方程的方差分析Table 3 Analysis of variance of the regression equation for extraction efficiency of trypsin inhibitor
2.5.3 大豆胰蛋白酶抑制剂粗提率响应面分析与最优工艺条件的确定
通过得率回归方程所作的降维分析见图4、响应面图见图5。由图4可知,随着各因素的增大,大豆胰蛋白酶抑制剂的提取率相应的表现为先增大后降低,并在零水平附近达到最大值。蛋白质的溶解性与溶液的pH值有直接的关系,当溶液的pH值达到等电点时蛋白质的溶解性随着溶液的pH值的增大而减小,当达到等电点时溶解度趋于最小,随着溶液pH值的继续增加蛋白质的溶解度再度回升。大豆胰蛋白酶抑制剂的热稳定性与其结构有关。KTI相对分子质量21000,由181个氨基酸和2个二硫键组成。BBTI相对分子质量约8000,由71个氨基酸和7个二硫键组成。KTI对热和酸的抗性都弱于BBTI,这都与他们结构上的差异有关。由此推断到90℃时KTI已被部分或完全钝化,而此时抑制剂还有活性说明还有一部分抑制剂存在,推测其剩余部分是BBTI。高浓度的盐离子在蛋白质溶液中可与蛋白质竞争水分子,从而破坏蛋白质表面的水化膜,降低其溶解度,使之从溶液中沉淀出来。各种蛋白质的溶解度不同,因而可利用不同离子浓度的盐溶液来沉淀不同的蛋白质。由此可见,适当的增大各因素值可以在一定程度上提高提取率。因此,在实际操作中应该对大豆胰蛋白酶抑制剂提取影响较大的因素慎重控制,以获得较高的提取率。
大豆胰蛋白酶抑制剂提取率的响应面趋势呈抛物线形,因此回归方程有极大值,结合方程与响应曲面可得到大豆胰蛋白酶抑制剂粗提工艺的最优参数为提取液pH5.1、热变性温度72.8℃、硫酸氨饱和度54.5%,在此条件下,大豆胰蛋白酶抑制剂的提取率达到86%。

图4 各因素对考察指标的降维分析图Fig.4 Dimensionality reduction analysis of various process conditions
根据最佳工艺条件,做3组验证实验,结果大豆胰蛋白酶抑制剂提取率平均值为86%,与预测值接近。
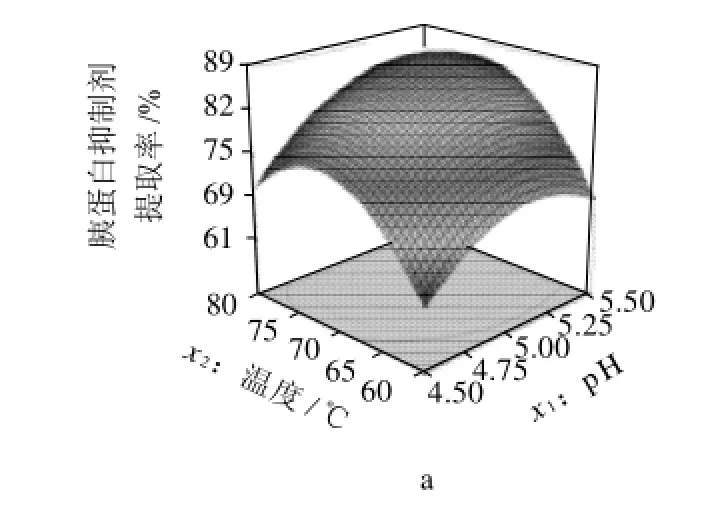

图5 各因素交互作用影响大豆胰蛋白酶抑制剂提取率的响应曲面图Fig.5 Response surface plots for the effects of pairwise interactions among various variables on extraction efficiency of trypsin inhibitor
3 结 论
通过单因素试验及三因素三水平响应面法试验,建立响应值与各因素之间的数学模型,依此模型可以预算理论提取率。用响应面分析法对大豆胰蛋白酶抑制剂粗提的工艺参数进行优化,得到的回归方程:

对大豆胰蛋白酶抑制剂提取率影响较大的3个因素的P值相差较大,对提取结果的影响顺序:热变性温度>提取液pH值>硫酸铵饱和度。根据回归模型,确定大豆胰蛋白酶抑制剂粗提的最佳工艺参数:提取液pH5.1、热变性温度72.8℃、硫酸氨饱和度54.5%,大豆胰蛋白酶抑制剂的提取率达到86%。
[1]WOLFRAM B, ROBORT H. Natural protein proteinase inhibitors and their interaction with proteinaes[J]. Journal of Biochem, 1992, 204(2): 433-451.
[2]金蓓, 田少君. 大豆胰蛋白酶抑制剂研究概况[J]. 粮食与油脂, 2005 (6): 3-6.
[3]陈星, 刘蕾. 固定化酶法分离纯化大豆胰蛋白酶抑制剂[J]. 食品科技, 2004(12): 12-15.
[4]朱新生, 朱玉贤. 抗虫基因工程研究进展[J]. 植物学报, 1997, 39(3): 282-288.
[5]QI Ruifeng, SONG Zhanwu, CHI Chengwu. Structure features and molecular evolution of Bowman-Birk protease inhibitors and their potential application[J]. Acta Biochimica et Biophysica Sinica, 2005, 37(5): 283-292.
[6]SHAPIRD J A M. Transplanting islets for diabetes[J]. the Scientist, 2006, 20(5): 42.
[7]LANZA A, TAVA A, CATALANO M, et a1. Effects of the Medicago scutellata trypsin inhibitor(MsTI) on cisplatin-induced cyto-toxicity in human breast and cervical cancer cells[J]. Anticancer Res, 2004, 24(1): 227-233.
[8]KENNEDY A R. The evidence for soybean products as cancer preventive agents[J]. The Journal of Nutrition, 1995, 125(3): 733-743.
[9]杨文雄, 高彦祥. 响应面法及其在食品工业中的应用[J]. 中国食品添加剂, 2005(2): 68-71.
[10]王增禄, 茹炳根, 张英起, 等. 胰蛋白酶抑制剂亲和层析柱的制备及猪胰脏中胰蛋白酶抑制剂的实验研究[J]. 药物生物技术, 1996, 3(4): 197-201.
[11]严晴燕, 曹凯鸣. 大豆(G.max)胰蛋白酶抑制剂SBTi-A2新类型TiX的纯化及其性质研究[J]. 复旦学报: 自然科学版, 1996, 35(2): 150-156.
[12]廖海. 油菜胰蛋自酶抑制剂的分离纯化与部分性质研究[D]. 成都: 四川大学, 2002.
[13]曾英, 桑玉英, 胡金勇, 等. 波叶青牛胆胰蛋白酶抑制剂的纯化及其性质研究[J]. 云南植物研究, 2002, 24(l): 103-108.
[14]陈志毅, 薛侃, 何天源. 血清中α1-AT抑制活力测定方法探讨[J]. 蚌埠医学院学报, 1988, 13(4): 259-262.
[15]ERIKSSON S. Studies inα1-antitrypsin deficiency[J]. Acta Med Scand, 1965, 432(Suppl1): 1-85.
Process Optimization for Trypsin Inhibitor Extraction from Defatted Soybean Meal by Response Surface Methodology
LIANG Xue-hua1,ZHU Xiu-qing1,2,*,ZHENG Huan-yu1,2,ZHANG Zhi-yu1
(1. College of Food Science, Northeast Agricultural University, Harbin 150030, China;2. National Research Center of Soybean Engineering and Technology, Harbin 150030, China)
Objective: The conditions for the extraction of trypsin inhibitor from low-temperature defatted soybean meal were optimized. Methods: pH, thermal denaturation temperature and ammonium sulfate saturation were identified to be main variables that influence extraction efficiency by the one-factor-at-a-time method. Based on the principles of Box-Behnken central composite design, response surface analysis was employed to explore the effects of pairwise interactions among the three variables at three levels on extraction efficiency. The optimum conditions for extracting soybean trypsin inhibitor from lowtemperature defatted soybean meal were found as follows: extraction solvent pH of 5.1, thermal denaturation at 72.8 ℃ and ammonium sulfate saturation of 54.5% for the precipitation of trypsin inhibitor. Under these conditions, the extraction efficiency of trypsin inhibitor was up to 86%. Consequently, response surface methodology is feasible for the optimization of the extraction process for trypsin inhibitor from defatted soybean meal, and the optimized process is reliable.
soybean trypsin inhibitor;extraction;Box-Behnken experimental design
TQ936.16
A
1002-6630(2011)04-0097-05
2010-04-15
国家“863”计划项目(2006AA10Z322)
梁雪华(1983—),男,硕士研究生,研究方向为大豆精深加工。E-mail:thelastbutnotleast@163.com
*通信作者:朱秀清(1968—),女,研究员,硕士,研究方向为大豆精深加工。E-mail:xqzhuwang@163.com

