猪戊型肝炎病毒双重RT-PCR检测诊断方法的建立及其应用
郝宝成,兰 喜,胡永浩,柳纪省,,梁剑平,
(1.中国农业科学院兰州畜牧与兽药研究所中国农业科学院新兽药工程重点开放实验室甘肃省新兽药工程重点实验室,甘肃兰州730050;2.中国农业科学院兰州兽医研究所,甘肃兰州730046;3.甘肃农业大学动物医学院,甘肃 兰州 730070)
猪戊型肝炎(HE)是近年来颇受人们关注的一种人畜共患传染病。人普遍易感。急性戊型肝炎病情较重,病死率为2.5%,明显高于甲型(0.1%)和乙型(0.9%)肝炎,孕期妇女死亡率可高达15%~20%[1],尤其是怀孕最后3个月的孕妇病死率更高。1986~1988年我国新疆南部地区曾发生HE水源性大流行,共计有119 280人发病,死亡707人,是迄今世界上最大、最严重的一次戊型肝炎流行[2]。
猪作为HEV的贮存宿主,在人类病毒性肝炎的流行病学中具有重要的地位,对于公共卫生、异种器官移植和食品安全等构成潜在的威胁[3]。因此,在加强对猪戊型肝炎的预防控制方面,快速准确的检测和注射疫苗将是最为有效的防控手段。目前,对于病毒性疫病的诊断一般采用病原分离鉴定和血清学方法 ,但这些方法存在操作繁杂、费时费力、敏感性较差等不足,特别是当动物感染多种病原时,难以应用常规方法进行早期快速检测。由于目前商业化的HEV抗体诊断试剂以Ⅰ型HEV抗原为主,在临床检测中可能存在不同基因型样品的漏检现象,所以有必要针对不同基因型建立有效﹑快速的检测诊断方法。
1 材料与方法
1.1 病毒 病料1~217号为猪粪便样品,218~255号为猪胆汁血清样品,采集自甘肃省不同地区猪养殖场。
1.2 主要试剂 病毒RNA小量制备试剂盒购自QIAGEN公司;T反应试剂盒 、TaKaRa TaqTM、100 bp DNA Marker 、λ-EcoT14、质粒抽提试剂盒 、DNA凝胶回收试剂盒均购自TaKaRa公司;限制性内切酶BamHⅠ、SphⅠ购自Promega公司;E.coli DH5α感受态细胞由本实验室保存。
1.3 引物设计 根据GenBank收录的 HEV ORF2基因序列,参照设计1对特异性引物,引物由TaKaRa公司合成。其序列为:E01:5′-TGGCGTTCG(A/T)GTTGAGA-3′;E02:5′-GGT(C/G)GTC(G/T)GCT(G)GAGGAGGAG-3′;E03:5′-CCGACQAAATCAAT TCTGTC-3′;E04:5′-T TG(A)TCCTGCTGA(T)GCG(A)T TCTC-3′
1.4 病毒RNA的提取 依次取病料样悬液1~255号,10 000 r/min离心3 min,取上清液,病毒RNA小量制备试剂盒抽提病毒RNA。上述步骤均在BPL3实验室进行。
1.5 cDNA的合成 在0.2 mL EP管中依次加入5 ×RT Buffer 4 μ L,RNase Free ddH2O 3.5 μ L,dNTP Mixture(各 10 mmol/L)1 μ L,RNase inhibitor 1 μ L,AMV Rverse Tran-scriptase 0.5 μ L(5 U/μ L),RNA 样品 10 μ L,反应总体积为 20 μ L。反转录条件:42℃60 min,70℃15 min。
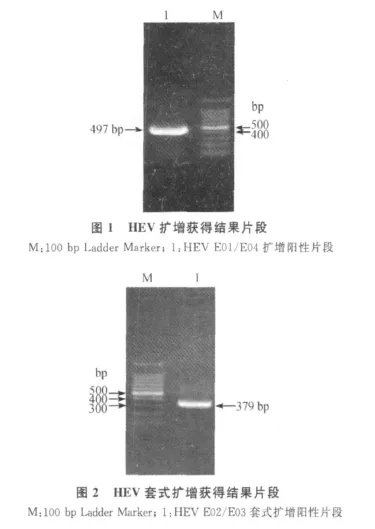
1.6 PCR扩增 反转录液3 μ L,10×PCR缓冲液2.5 μ L,25 mmol/L MgCl22 μ L,用 10 mmol/L dNTPs 1 μ L,2 个外引物各 0.5 μ L(20 pmol/μ L),Ex Taq DNA 聚合酶(5 U/μ L)0.25 μ L,ddH2O 调整终体积至50 μ L。取第一轮PCR 产物1 μ L,2个内引物各0.5 μ L(20 pmol/μ L),其余成分与第一轮PCR反应相同,进行第二轮PCR反应。按反应程序 :94℃、2 min;94 ℃、30 s,50℃、30 s,72℃、2 min 30 s,共35个循环;72℃延伸15 min,PCR产物用1%琼脂糖电泳观察(见图1、图2)。扩增后未获得产物的样品,在进行套扩以后仍没有获得目的条带大小的样品的同时,调整扩增条件再次确认。对于扩增所得条带与目的条带大小可疑的样品继续进行下一步克隆鉴定。
1.7 cDNA克隆与鉴定 PCR产物按小量胶回收试剂盒回收,与 pMD20-T载体连接(体系:pMD20-T 1μ L,Ligation solution I 5.0 μ L 、DNA样品4.0 μ L)轻轻混匀后,16℃连接过夜,连接产物按常规方法转化E.coli DH5α感受态细胞,涂布于含Amp、X-Gal及IPTG的鉴别培养基,挑取蓝斑作阴性对照提取质粒初选阳性菌落培养,用质粒PCR以及用BamHⅠ+SphⅠ进行酶切鉴定,酶切体系为:BamH Ⅰ1.0 μ L 、Sph Ⅰ1.0 μ L 、质粒 DNA 16 μ L 、10 ×K Buffer 2.0 μ L 、总体积 20.0 μ L,37 ℃水浴酶切5 h,以1%琼脂糖电泳分析酶切结果。鉴定的重组质粒依次命名为pMD-1~pMD-x。
1.8 序列测定和比较分析 将阳性重组质粒送上海英骏生物技术有限公司测序。将所测序列登陆GenBank,确定是否为猪戊型肝炎病毒阳性。
2 结果
对所采集的255份样品,经 RT-PCR检测,共有猪戊型肝炎病毒阳性12份,阳性率为4.71%。表明甘肃省养殖猪中存在猪戊型肝炎病毒的感染,见图1、图2及表1。
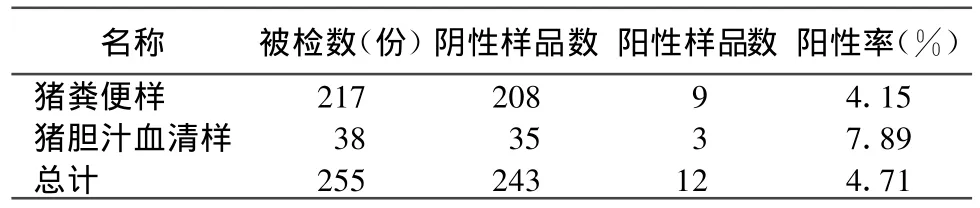
表1 255份疑似猪戊型肝炎病毒样品RT-PCR检测结果统计
在鉴定样品中,猪粪样21,39,54,73,79,80,126,136,189号样为阳性样品,猪胆汁血清样中219,226,227号样为阳性样品。
3 讨论
戊型肝炎主要通过粪便污染途径传播,近年来随着对戊型肝炎研究的深入,发现还通过母婴传播。Khuroo[4]等报道了新生儿由于母婴传播而感染的案例,感染率为78.9%。另外研究表明,HEV不仅感染人,而且可以感染猪、野猪、鸡、鸟[5]、鼠[6]、猫[7-8]及鹿等动物,人也可以通过生吃鹿肉而染病[9-10],提示人畜是HEV的共同宿主。
HEV基因有 3个开放阅读框(open reading frames,ORFs),ORF2为主要的结构基因编码区,长约2kb,其被认为是最保守的区域,其核苷酸序列也最保守。本文利用DNAMan软件对GenBank登录的戊型肝炎病毒4个主要基因型代表株的序列进行分析,选择其高度保守的ORF2区域设计合成套式引物,对在甘肃地区采集的255份猪粪便或猪胆汁血清样品,进行了检测诊断。试验共检验255份猪粪便或猪胆汁血清样品,检出阳性数为12份,阳性率为4.71%。其中猪粪便样﹑猪胆汁血清样阳性率分别为4.15%﹑7.89%,本次检测诊断结果表明,在甘肃省的养殖场猪群中存在猪戊型肝炎的感染。样品采集为随机采样,检出阳性样品后在同一猪群中按量采样,上表中所列的阳性率与报道的流行率7%~15%比较接近,可以作为一个HEV流行率研究的参考。
目前,国内外专家学者已对猪戊型肝炎的病原学、流行病学、实验室诊断、基因结构等方面研究取得了重大进展。但对猪戊型肝炎的发病机理尚需进一步的研究。对其发病机理的研究,是进一步开发诊断试剂盒和建立有效预防控制机制的基础。
[1]Purdy M A,Carson D,McCaustland K A,et al.Viral specificity of hepatitis E virus antigens identified by fluorescent antibody assay using recombinant HEV proteins[J].J Med Virol,1994,44:212-214.
[2]Zhuang H,Cao X Y,Liu C B,et al.Epidemiology of hepatitis E in China[J].Gastroenterologia Japanica,1991,26(Suppl.3):135-138.
[3]周锦萍,曾荣誉,孙泉云,等.猪戊型肝炎研究进展[J].动物医学进展,2006,27(8):52-55.
[4]Khuroo M S,Kamili S.Clinical course and duration of viremia in vertically transminttied hepatitis E virus(HEV)infection in babies born to HEV-infected mothers[J].J Viral Hepa,2009,16(7):519-523.
[5]Sun Z F,Larsen C T,Dunlop A,et al.Genetic identification of from healthy chicken flocks and characterization of the capsidg from chickens with hepatitis splenomegaly syndrome in different United States[J].J Gert Virol,2004,8(Pt3):693-700.
[6]Hirano M,Ding X,Li T C,et al.Evidence for widespread among wide rats in Japan[J].Hepatol Res,2003,27(1):1-5.
[7]Okamoto H,T akahashi M,Nishizawa T,et al.Presence of an Japanese pet cats[J].Infection,2004,32(1):57-58.
[8]Choi C,Ha S K,Chae C.Development of nested RT-PCR hepatitis E virus in formalin-fixed,paraffin-embedded tissues hybridization[J].J Virol Methods,2004,115(1):67-71.
[9]T ei S,Kitajiama N,Takahashi K,et al.Zoonotic transmission to human beings[J].The Lancet,2003,362(9381):371-373.
[10]郝宝成,兰喜,柳纪省,等.猪戊型肝炎病毒 swCH-GS189株ORF2基因的克隆及序列分析[J].生物技术通报,2009,5:122-126.

