猪瘟病毒感染仔猪接种猪瘟疫苗后抗原的跟踪检测
姚华伟,范学政,徐 璐,陈 锴,黄 伟,沙 莎,孟 萌,郑 然,王 琴
(1.西南大学动物科技学院,重庆荣昌402460;2.中国兽医药品监察所猪瘟参考实验室,北京海淀100081)
猪瘟(CSF)是由猪瘟病毒(CSFV)引起的一种猪的高度致死性、接触性传染病[1]。根据OIE制定的《陆生动物卫生法典》2009年版,CSF被列为必须报告的疫病之一,在我国被列为“一类动物疫病”。猪瘟病毒的常规检测方法存在耗时、敏感性低、特异性差等缺点,且不能区分猪瘟野毒株和疫苗株。本实验室建立了猪瘟病毒荧光定量PCR方法(CSFVFQ-PCR)用于检测所有猪瘟病毒,还建立了特异性检测猪瘟兔化弱毒疫苗的荧光定量PCR方法(HCLV-FQ-PCR),均具有快速、敏感、特异等优点;实验室优化的欧盟猪瘟参考实验室CSFV-RT-nPCR,也是国际上常用的检测CSFV的方法之一。本试验将上述3种方法应用于田间发病仔猪的检测,以探索发病仔猪免疫疫苗前后的带毒情况,并在田间病例中验证3种检测方法的适用性。
1 材料与方法
1.1 样品来源 河北省某地区发病仔猪47头,1月龄左右。首次送检样品经实验室检测,PRRSV、PRV、PPV、BVDV 和PCV-2病原及抗体均为阴性,有3头猪样本检测显示为猪瘟病原阳性,猪瘟抗体阴性,其后每隔7~10 d送检此批仔猪血样。
1.2 检测方法
1.2.1 CSFV-RT-nPCR检测方法 所用引物为欧盟猪瘟参考实验室推荐[1-2],经本实验室优化后使用。将RT-nPCR阳性产物进行测序,用于猪瘟分子流行病学[4-5]、遗传进化分析和猪瘟病原诊断。
1.2.2 CSFV-FQ-PCR检测方法 为本实验室建立,用于检测包括猪瘟疫苗株在内的所有猪瘟病毒。1.2.3 HCLV-FQ-PCR检测方法 为本实验室建立,用于特异性的检测猪瘟兔化弱毒疫苗。
1.2.4 检测方案 以首次送检日期为第1天。第1天和第13天的血样采用CSFV-RT-nPCR进行检测,其中第13天有5头死亡猪送检样品。第16天农户自行免疫猪瘟疫苗,免疫后定期送样,直至注射疫苗后81 d。所有送检样品分别采用CSFV-RT-nPCR、CSFV-FQ-PCR和 HCLV-FQ-PCR 3种检测方法进行跟踪检测猪瘟病毒,将CSFV-RT-nPCR阳性产物测序并进行流行病学分析。
2 结果与分析
2.1 猪瘟疫苗免疫前仔猪带毒情况 第1天及第13天送检样品采用CSFV-RT-nPCR方法检测,结果显示第1天有3份样品呈现猪瘟抗原阳性,第13天有32头猪呈现猪瘟抗原阳性,第1天至第13天期间有5头猪死亡,编号为26号、27号、29号、33号、36号,死亡猪检测结果为猪瘟病毒阳性。
2.2 流行病学分析结果 将第1天及第13天样品中CSFV-RT-nPCR检测阳性样本进行核苷酸序列分析,表明该批仔猪感染的CSFV属于2.1亚群,与2.1亚群序列同源性为91.5%,与疫苗株同源性为81.0%。
2.3 猪瘟疫苗接种后抗原的检测 采用CSFVRT-nPCR、CSFV-FQ-PCR和 HCLV-FQ-PCR三种方法分别对免疫后仔猪血样进行检测,检测结果见表 1。其中 17号、23号、28号、30号、31号、34号 、37 号 、38 号 、39 号 、45号 、46 号 、47 号共 12 头猪在免疫猪瘟疫苗后11 d期间陆续死亡,在表1中未列出,且12头死亡猪3种检测方法结果均为阳性。
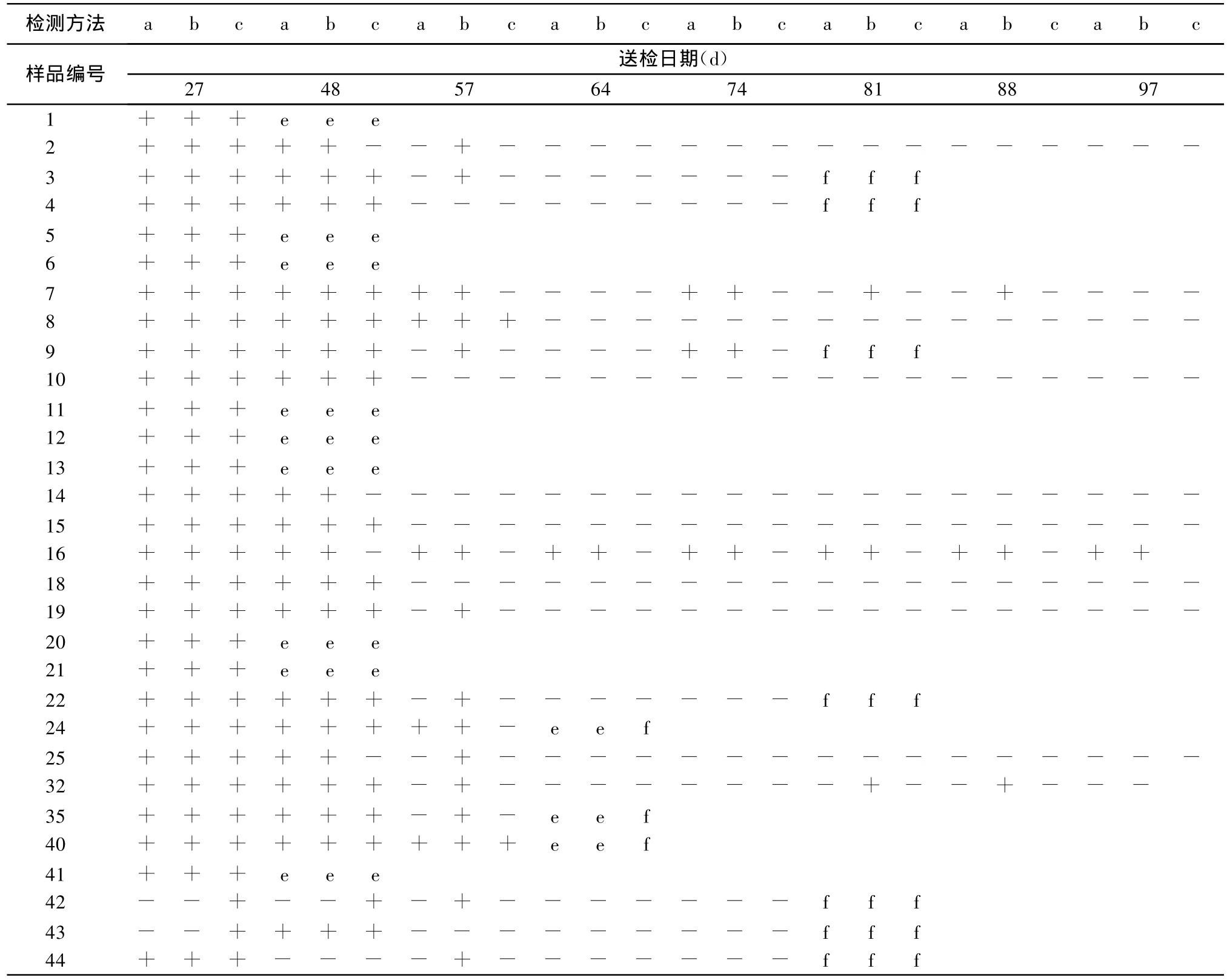
表1 仔猪免疫后带毒情况的检测结果
从表1可以看出,在免疫接种初期,采用3种检测方法均可在血液中检测到猪瘟病毒的存在。而随着免疫时间的延长,3种方法的检测结果开始出现差异。HCLV-FQ-PCR在免疫后48 d,所有检测结果均为阴性,由于HCLV-FQ-PCR只能特异性检测猪瘟病毒疫苗株,说明在免疫48 d后,已经检测不出血液中的疫苗毒。CSFV-RT-nPCR和CSFVFQ-PCR不能够鉴别猪瘟野毒和疫苗毒,因此,当感染动物体内尚有未被中和的野毒时,二者的检测结果仍可能为阳性。
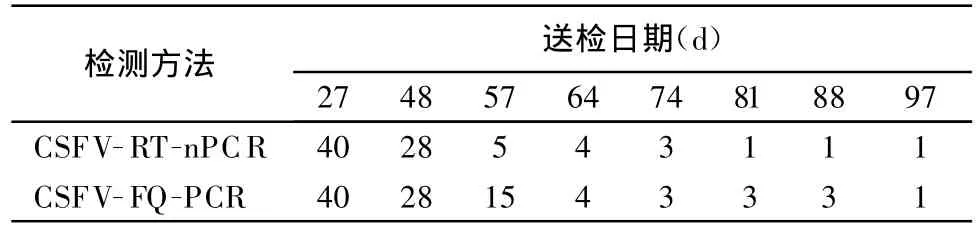
表2 仔猪免疫后CSFV-RT-nPCR与CSFV-FQ-PCR阳性检出数的比较
从表1及表2可以看出,随着免疫时间的延长,阳性样本的数量逐渐减少,CSFV-RT-nPCR检测为阳性的样本,CSFV-FQ-PCR的检测结果也为阳性;且随着免疫时间的延长,CSFV-FQ-PCR阳性样本的检出数高于CSFV-RT-nPCR,因此说明,CSFVFQ-PCR的敏感性高于CSFV-RT-nPCR。
另外,从表1中可以看出部分猪在免疫猪瘟疫苗后的不同时间内出现了死亡现象。死亡猪的检测结果发现,免疫猪瘟疫苗后48 d内死亡的猪送检样品均可以检测到猪瘟病毒,而免疫65 d后死亡的猪送检样品已经检测不到猪瘟病毒,通过向农户了解情况后得知,当地正在暴发蓝耳病疑似疫情,因此推测这些免疫猪瘟疫苗65 d后死亡的猪可能死于高致病性蓝耳病。
3 讨论
3.1 关于灵敏度 本试验采用的CSFV-RT-nPCR方法[3]为欧盟猪瘟参考实验室推荐的诊断方法,扩增区域为E2基因主要区域,具有较高的灵敏度,检测极限可达5.3×10-1pg[6],国内外一些实验室也用此方法进行猪瘟流行病学分析[4-5,7]。荧光定量PCR方法是一种灵敏的快速检测方法,与常规PCR相比,它具有特异性更强、污染几率小、自动化、高通量等优点。本实验室分别设计了检测猪瘟病毒疫苗毒及野毒的通用探针(CSFV-FQ-PCR)和专门检测猪瘟兔化弱毒疫苗的鉴别探针(HCLV-FQ-PCR),CSFV-FQ-PCR的灵敏度达到5.3×10-2pg(浓度为103.84TCID50mL-1猪瘟病毒石门株感染猪血液中的病毒提取总 RNA浓度),而HCLV-FQ-PCR的灵敏度可高达到8.18×10-5pg(浓度为体外转录的标准品RNA浓度)。
3.2 关于猪瘟兔化弱毒疫苗的检测 猪瘟兔化弱毒疫苗是世界公认的效果最好的猪瘟疫苗,包括中国在内的很多国家都采用该株疫苗预防猪瘟[8]。因此,对猪瘟疫苗毒和野毒的鉴别诊断就显得尤为重要。本实验室建立的特异性的HCLV-FQ-PCR为解决这一难题提供了有效的方法。
3.3 关于免疫后的疫苗毒在体内的存续时间 利用HCLV-FQ-PCR,对田间感染猪瘟病毒后紧急接种猪瘟疫苗的仔猪送检样品进行特异性检测时发现,免疫后仔猪血液中的疫苗毒存活时间可达48 d,因此提示我们,在采用分子生物学检测方法进行猪瘟诊断时,应对免疫猪瘟疫苗48 d前后的样本进行综合分析,以免猪瘟疫苗株对检测结果造成影响。3.4 关于猪瘟病毒的持续感染 通过检测结果可以看出,有11头猪最终存活下来,但是仍然有3头猪在88 d检测时呈现CSFV阳性,在97 d检测时仍有1头猪呈现CSFV阳性,这说明,猪瘟病毒的持续感染现象是存在的。虽然感染猪并未死亡,但是可以持续性带毒、散毒。如果这种持续感染猪不予以清除,必然成为猪瘟的持续传染源。因此,对于规模化猪场来说,定期进行猪群检测,坚决淘汰病原阳性猪才是切断猪瘟传染源的关键。
[1]Paton D J,McGoldrick A,Greiser-Wilke I,et al.Genetic typing of classical swine fever virus[J].Veterinary Microbiology,2000,73(2-3):137-157.
[2]Lowings P,Ibata G,Needham J,et al.Classical swine fever virus diversity and evolution[J].Journal of General Virology,1996,77(Pt 6):1311-1321.
[3]Deng M C,Huang C C,Huang T S,et al.Phylogenetic analysis of classical swine fever virus isolated from T aiwan[J].Veterinary Microbiology,2005,106(3-4):187-193.
[4]Chen N,Hu H,Zhang Z,et al.Genetic diversity of the envelope glycoprotein E2 of classical swine fever virus:Recent isolates branched away from historical and vaccine strains[J].Veterinary Microbiology,2008,127(3-4):286-299.
[5]刘俊,王琴,范学政,等.猪瘟猪瘟病毒野毒株 TaqMan-MGB荧光定量PCR鉴别方法的建立与应用[J].中国农业科学,2009,42(12):4366-4371.
[6]T u C,Lu Z,Li H,et al.Phylogenetic comparison of classical swine fever virus in China[J].Virus Research,2001,81(1-2):29-37.
[7]仇华吉,童光志,沈荣显.猪瘟兔化弱毒疫苗-半个世纪的回顾[J].中国农业科学,2005,38(8):1675-1685.

