猪瘟病毒E2基因密码子优化后在昆虫细胞中的表达
范学政,徐 璐,王 琴,赵启祖,宁宜宝,陈 锴
(中国兽医药品监察所猪瘟参考实验室,北京海淀100081)
猪瘟(CSF)是由猪瘟病毒(CSFV)引起的猪的一种高度接触性传染病,给养猪业造成了巨大的经济损失。CSFV E2糖蛋白,既是研究新型疫苗的主要对象,也是建立CSFV血清学检测方法的首选抗原[1-2]。目前E2基因已在多个表达系统中进行表达,并且利用表达产物作为CSFV ELISA诊断抗原和亚单位疫苗进行了探索[3-4]。
有文献报道,密码子的使用频率会严重影响基因的表达量,如果对密码子进行优化,则可能改善表达效果[5-6]。经软件分析,CSFV E2基因在昆虫细胞中使用频率≤20%的密码子高达85处,是否影响表达效果尚不清楚。本试验将猪瘟病毒E2基因进行改造,构建重组杆状病毒,获得分泌型抗原,为抗体检测试剂盒的开发奠定物质基础。
1 材料与方法
1.1 材料 pFastBac1质粒、DH10Bac菌、sf9细胞、SNAP MidiPrep Kit为Invitrogen公司产品;HisTrapTMHP Nie+纯化柱为 GE Healthcare产品;酶标E2单抗WH303:从英国VLA引进单抗后标记HRP;不同猪病猪血清样本由本实验室收集(经IDEXX CSFV Ab C-ELISA试剂盒检测验证);Rabbit-anti-pig HRPO为Sigma公司产品;其他为常规试剂。
1.2 方法
1.2.1 密码子分析及序列改造 利用http://gcua.schoedl.de/服务器的密码子分析软件,分析CSFV石门株E2基因(SE2)在昆虫细胞中的使用频率,结果发现,SE2基因中有17种密码子共计85处在昆虫细胞中使用频率低于≤20%(见表1)。利用点突变技术,将SE2基因中低频率密码子使用密集区域的64个密码子进行同义突变,改造后基因命名为MUTSE2,将改造后的序列克隆至pGEM-T-easy中进行测序验证,正确的克隆命名为pBSE2M。
1.2.2 重组转移载体构建及杆粒制备 为了获得分泌型E2蛋白,并便于纯化,在E2基因N端加上蜂素信号肽(MELs),C端加上接头及6HIS序列,顺序为:启动子-MELs-MUTSE2-接头-6HIS。经测序鉴定,正确的重组转移载体命名为 pFast-BacSE2M。将其转化 DH10Bac,用 SNAP MidiPrepKit提取重组杆粒,经PCR鉴定,正确的杆粒命名为bSE2M。

表1 E2基因在昆虫细胞中使用频率≤20%的密码子
1.2.3 转染及病毒鉴定 用鉴定好的重组杆粒bSE2M转染sf 9细胞,操作过程按说明书进行。获得的病毒用PCR方法鉴定,正确的重组病毒命名为BAC/SE2M。
1.2.4 表达产物分析鉴定 将鉴定好的病毒用sf 9细胞传代培养,取培养上清用ELISA方法进行分析。操作过程为,取病毒培养液8 000 r/min离心5min,取上清,用 NaHCO3包被液稀释 50×,每孔包被 100 μ L,4℃过夜;弃包被液,加 PBSM(PBS,加5%脱脂奶粉)37℃封闭 40 min;吸干,用 PBST(PBS,加 0.5%Tween-20)洗 3次,将 WH303*HRPO用 PBSTM(PBST,加 5%脱脂奶粉)稀释1 000×,每孔加入100 μ L,37℃温育40 min;吸干,用PBST 洗3次,每孔加入TMB工作液100 μ L,避光作用10 min,加入50 μ L终止液(2 mol/L H2SO4),测吸光值(450 nm)。
1.2.5 E2表达蛋白纯化与定量 用鉴定好的毒种接种sf9细胞扩大培养,接种后72 h收集培养液,8 000 r/min离心5 min,将上清装入透析袋,用聚乙二醇8 000包埋浓缩。浓缩液用 HisTrapTMHP Nie+纯化柱纯化,纯化蛋白用SDS-PAGE电泳分析,用 WH303*HRPO 进行 Western-blot鉴定,用Bradford法测定蛋白浓度。
1.2.6 间接ELISA方法的初步建立 用纯化的E2蛋白作为包被蛋白,检测猪血清中的CSFV抗体。将纯化的E2蛋白、猪瘟阳性和阴性血清、Rabbit-anti-pig H RPO等进行棋盘滴定,优化反应条件。根据确定的反应条件,对13份HCLV免疫猪阳性血清、1份PRRSV阳性血清(PRRSVS)、1份PPV阳性血清(PPVS)、1份 PRV阳性血清(PRVS)、1份PCV阳性血清(PCVS)和20份非免疫猪血清用间接ELISA检测。
2 结果与分析
2.1 改造序列的测序验证 对CSFV E2基因经改造后获得的MUTSE2与设计序列一致(表2),与天然E2基因核苷酸相似性为91%,氨基酸相似性为100%。
表2 CSFV E2基因密码子改造前后变化
2.2 重组转移载体及重组杆粒的构建 将Mels、MUTSE2、接头和 6His标签克隆入pFastBac1,经筛选鉴定获得了重组转移载体pFastBacSE2M,转化DH10Bac后进行筛选,获得的重组杆粒PCR扩增条带为3 400 bp(图略),证明获得了正确杆粒bSE2M。
2.3 转染、病毒鉴定及表达分析 将重组杆粒bSE2M转染sf 9细胞,提取重组病毒DNA经PCR鉴定后,扩增出了3 400 bp目的条带,证明转染成功。对培养上清用WH303*HRPO检测,结果出现特异的ELISA反应(表3)。表明E2蛋白获得了分泌性表达。
2.4 E2表达蛋白纯化与定量 对E2表达蛋白经浓缩、Nie+纯化柱纯化和SDS-Page电泳表明,纯化产物分子量为40~55 kD,与理论值相符,证明获得了纯的E2蛋白。Western-blot鉴定表明表达产物与WH303有良好的特异性反应(图1)。用Bradford法测定表明E2蛋白浓度为0.21 mg/mL。

表3 细胞培养上清表达产物检测
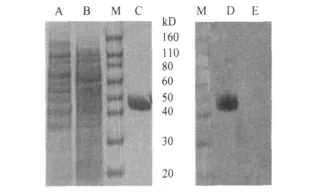
图1 重组E2蛋白纯化后 SDS-Page和 Western-blot鉴定
2.5 间接ELISA方法的初步建立 通过棋盘滴定试验,最终确定包被E2抗原的最适包被浓度为25 ng/孔,猪瘟待检血清的最佳稀释倍数为100×,Rabbit-anti-pig HRPO的最佳稀释浓度为30 000×。采用优化浓度对 30份猪血清进行检测,并与IDEXX CSFV Ab检测试剂盒比较,两种方法的符合率为 100%。该 ELISA方法不与 PRRSVS、PPVS、PRVS、PCVS存在交叉反应。通过ELISA反应OD值分布可以看出,阴阳性血清OD值的区分清楚,没有明显的非特异性反应(见图2)。

图2 间接ELISA检测阴阳性血清OD值分布
3 讨论
昆虫杆状病毒表达系统(baculovirus expression system,BEVS)是一种高效的真核表达系统,能有效进行蛋白质的翻译后加工,表达产物的生物学活性与天然蛋白十分接近,特别适合于蛋白结构和功能的研究,已成功表达了多种功能蛋白。
密码子的使用频率会严重影响基因的表达量,通常,如果一个基因包含宿主细胞罕用的密码子越多,表达就越困难[5]。如果稀有密码子成串出现或出现在读码框的5′端,则会导致表达水平急剧下降。提高表达常用的策略就是改变目的基因的密码子,使之更接近于宿主细胞的密码子使用方式。如人诺如病毒衣壳蛋白等的密码子进行优化后在昆虫细胞中成功表达。在蛋白质研究中,密码子优化已越来越受到人们的重视,目前已有计算机软件辅助设计[7],由人工设计的基因序列也成功用于功能研究[8]。CSFV E2基因在昆虫细胞中使用频率≤20%的密码子高达85处,且有部分区域稀有密码子成串排列,这些都有可能降低其在昆虫细胞中的表达能力。因此,本研究将低频率密码子密集区改造后,成功表达了E2蛋白,试验表明,用此蛋白建立的间接ELISA方法特异性好,与IDEXX CSFV Ab C-ELISA试剂盒有很高的符合性。
E2蛋白的羧基端由约40个氨基酸残基组成的跨膜区,疏水性极强,对表达有一定的影响。因此,本试验去掉了C段的跨膜区,同时在末端加上一段柔性短肽和6HIS纯化标签,利用Nie+柱层析纯化了重组E2蛋白,结果显示,纯化的E2蛋白具有良好的反应活性。
本试验对CSFV E2基因进行改造,用昆虫杆状病毒表达系统获得了分泌型E2蛋白,是一种有益的探索。用此蛋白建立的ELISA方法特异性好,显示了良好的应用前景。
[1]Min Lin,Trottier E,Mallory M.Enzyme-Linked Immunosorbent Assay Based on a Chimeric Antigen Bearing Antigenic Regions of Structural Proteins Erns and E2 for Serodiagnosis of Classical Swine Fever Virus Infection[J].Clin Diagn Lab Immunol,2005,12(7):877-881.
[2]van Rijn P A.A common neutralizing epitope on envelope glycoprotein E2 of different pestiviruses:Implications for improvement of vaccines and diagnostics for classical swine fever(CSF)?[J].Vet Microbiol,2007,125(1-2):150-156.
[3]范学政,王琴,陈振海,等.猪瘟兔化弱毒株E2基因的原核表达及间接ELISA的初步建立[J].中国病毒学,2005,20(3):253-256.
[4]Hulst M M,Westra D F,Wensvoort G,et al.Gly coproteis E1 of hog cholera virus expressed in insect cells protects swine from hog cholera[J].J Virol,1993,67:5435-5442.
[5]Gustafsson C,Govindarajan S,Minshull J.Codon bias and heterologous protein expression[J].T RENDS in Biotechnology,2004,22(7):346-353.
[6]郭丽,周红莉,屈建国,等.人诺如病毒衣壳蛋白的密码子优化及在昆虫细胞中的表达[J].中国病毒学,2006,21(2):121-125.
[7]Gang Wu,Yuanpu Zheng,Qureshi I,et al.SGDB:a database of synthetic genes re-designed for optimizing protein overex pression[J].Nucleic Acids Res,2007(35):D76-D79.
[8]Fuhrmann M,Hausherr A,Ferbitz L,et al.M onitoring dynamic ex pression of nuclear genes in Chlamydomonas reinhardtii by using a synthetic luciferase reporter gene[J].Plant Mol Biol,2004(55):869-881.

