植物乳杆菌野生质粒分析及其提取方法的优化
萨初拉,苏少锋,吴青海,其布日,高 娃,王蕴华,刘红葵,呼 和
(内蒙古农牧业科学院生物技术研究中心,内蒙古 呼和浩特 010031)
乳酸菌是已知的益生菌之一,目前被广泛应用于发酵和食品工业及饲料中。随着研究的深入,利用乳酸菌食品级表达系统表达功能性外源基因已成为研究热点[1-3]。不同于真核生物表达系统,细菌中存在大量的野生型质粒,能够表达和遗传如代谢、抗性相关的基因,因此,挖掘高拷贝、稳定复制的野生型质粒元件和无质粒受体菌是构建细菌表达系统的关键[4]。由于乳酸菌为革兰氏阳性菌,且部分野生型质粒拷贝数低,因此使用传统碱裂解法或普通质粒提取试剂盒提取效果并不理想[4-5]。目前,乳酸菌质粒提取方法已有多个报道,但操作均过于复杂、周期长、毒性大、质粒产量低且多数只适合对数期乳酸球菌[6-9],因此,该试验对比研究已报道的两种常规方法和优化后的方法,最终得到可应用于平台期植物乳杆菌的快速、高效的质粒提取方法。利用该方法进一步分析野生型植物乳杆菌质粒,得到2个高拷贝质粒和1个无质粒受体菌,为进一步开发和利用植物乳杆菌构建食品级表达系统奠定基础。
1 材料与方法
1.1 试验试剂及材料
1.1.1 菌株:菌株QZ21、QZ56和H18由笔者实验室分离自玉米秸秆青贮,并通过革兰氏染色方法、APICH50试纸条、16S rDNA鉴定分类为植物乳杆菌属。
1.1.2 试剂:DNA分子量Marker购自宝生物工程(大连)有限公司;溶菌酶,酚∶氯仿∶异戊醇(25∶24∶1)溶液购自生工生物工程(上海)股份有限公司;质粒小提试剂盒购自天根生化科技(北京)有限公司;其他试剂为国产或进口分析纯。
1.1.3 培养基:MRS培养基购自环凯微生物科技公司。
1.2 试验方法
1.2.1 质粒提取方法:分别取100 μL QZ21、QZ56和H18植物乳杆菌菌液至10 mL MRS液体培养基,32℃,100 r/min培养过夜至平台期。不同方法各取2 mL同一培养物进行质粒提取对比分析。
1.2.1.1 质粒提取方法Ⅰ:将Klaenhammer等发表的方法进行细微改动。取2 mL过夜培养植物乳杆菌,12 000 r/min离心1 min收集菌体;加入solutionⅠ(25%sucrose,30 mg/mL 溶菌酶)重悬,并置于 37 ℃,孵育 15 min;随后加入 400 μL SolutionⅡ(3%SDS,0.2 mol/L NaOH),立即混匀,室温孵育7 min 后; 加入 300 μL 乙酸钠 (3 mol/L,pH 值4.8),立即混匀,12 000 r/min,离心 15 min;将上清液转入新的1.5 mL离心管,加入650 μL异丙醇, 混匀,12 000 r/min,4℃离心,15 min; 弃上清液,320 μL ddH2O 重悬沉淀,加入 200 μl 7.5 mol/L乙酸铵和0.5 mg/ml溴化乙锭溶液,混匀,再加入350 μL酚—氯仿溶液,混匀,12 000 r/min离心5 min;将得到的上清用乙醇沉淀,30 μL 1×TE溶解沉淀。
1.2.1.2 质粒提取方法Ⅱ:根据万谦等[4]发表的方法。取2 mL过夜培养植物乳杆菌12 000 r/min离心1 min收集菌体;加入250 μL L-P1溶液 (20 mg/mL溶菌酶溶解于P1溶液中)重悬沉淀,37℃处理 30 min;12 000 r/min离心1 min,将上清液完全去除;其余步骤按试剂盒说明书进行操作。最终产物溶于 30 μL 1×EB。
1.2.1.3 质粒提取方法Ⅲ:取2 mL过夜培养植物乳杆菌12 000 r/min离心1 min收集菌体;加入400 μL丙酮混匀;12 000 r/min离心1 min收集菌体。后续同方法Ⅱ。
1.2.2 质粒电泳:各取10 μL上述质粒,加入2 μL 6×上样缓冲液,混匀。使用含有核酸染料的1%琼脂糖凝胶,以3~4 V/cm进行电泳检测,紫外成像仪进行拍照记录。
1.2.3 定量分析:各取2.5 μL上述质粒,使用ddH2O稀释200倍。使用贝克曼DU640紫外分光光度计对260、280 nm处的吸光值进行分析,得到其核酸浓度。
2 结果与分析
2.1 质粒提取结果
该研究对比2种常规乳酸菌质粒提取方法,通过提取青贮分离植物乳杆菌野生型质粒后进行电泳分析,由图1可知,方法Ⅰ和Ⅱ均能够检测到QZ21和QZ56在2 000 bp上下有2条野生型质粒条带,且2种方法得到的条带并无明显差异。然而H18菌株除了染色体条带以外并未检测到明显的质粒条带。为进一步提高质粒提取效率,该研究在前期试验的基础上以简便、毒性低的方法Ⅱ为基础,利用丙酮进行前期处理平台期植物乳杆菌形成方法Ⅲ,并与方法Ⅰ和Ⅱ进行了对比分析。如图1所示,方法Ⅲ得到的QZ21和QZ56条带相对于方法Ⅰ和Ⅱ更加清晰,说明丙酮前期处理能够提高植物乳杆菌质粒提取效率。但同样方法Ⅲ提取H18质粒后并未检测到明显的质粒条带,推测H18可能为无质粒植物乳杆菌。
2.2 质粒浓度结果

图1 质粒琼脂糖凝胶电泳分析结果
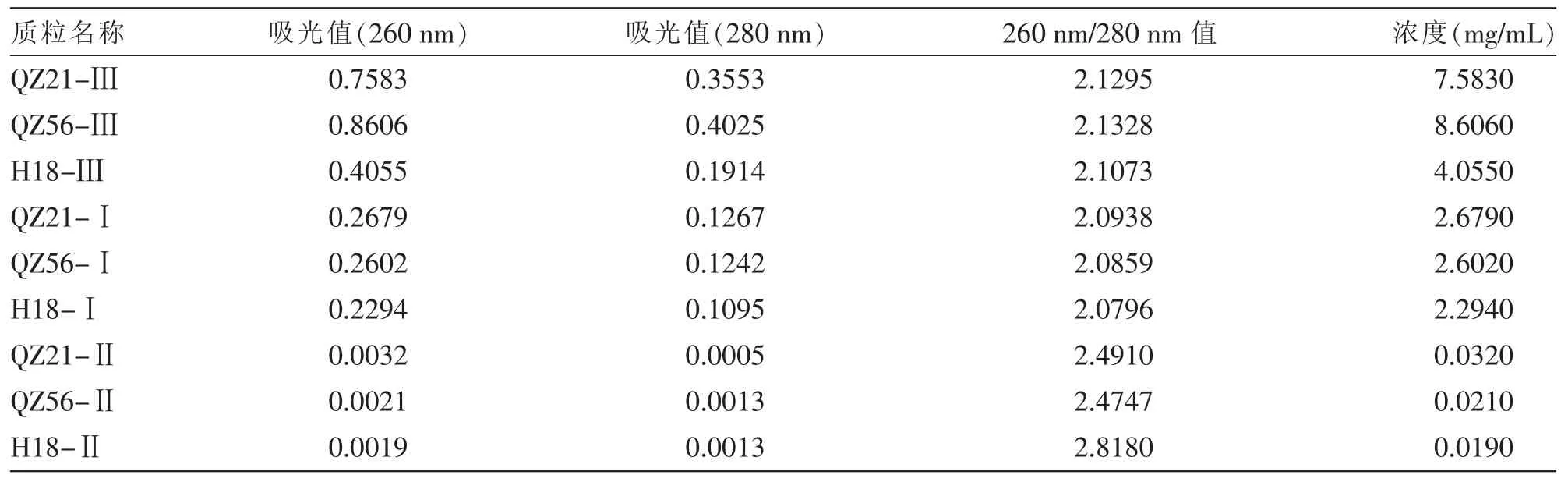
表1 紫外分光光度计分析质粒浓度结果
为进一步量化质粒提取结果,该试验采用紫外分光光度计测量相同体积质粒提取物中的DNA含量。测得结果如表1所示,方法Ⅰ所得到的质粒提取物中总的DNA含量明显高于方法Ⅱ,但从电泳结果可知方法Ⅰ所得质粒提取物中基因组DNA的污染比例明显高于方法Ⅱ,说明方法Ⅰ所得质粒提取物中纯质粒的含量较少。同样改良后的方法Ⅲ的质粒提取物中基因组DNA的比例也较高,可能由于丙酮前期处理后增加了细菌的裂解率,从而也提高了质粒的提取率。由于常规质粒提取过程中无法完全排除细菌基因组的污染,尤其是在革兰氏阳性细菌质粒提取过程中,所以只能在保证质粒提取量的前提下,尽量减少基因组的污染。
3 讨论
质粒提取效率受到细菌浓度、生长时期、提取方法、质粒浓度和物种等多个因素的影响[10]。目前已有多个有效乳菌质粒提取方法的报道[4-9]。其中多数均以乳酸菌为研究对象[4-5,7-8],而植物乳杆菌质粒提取有效方法报道较少,且多数研究使用对数生长期的乳酸菌[4-8],然而获得对数生长期的细菌时需要不断监测,且需要大量的培养物来达到所需的质粒提取量。平台期培养物通常可以从过细菌液培养物得到,并且菌液浓度也会最大,因此如果能利用平台期植物乳杆菌进行有效质粒提取,则能够节省人力的同时,保障得到高浓度质粒。植物乳杆菌野生型质粒的拷贝数较低,且平台期细胞膜较厚,因此常规方法很难有效裂解平台期植物乳杆菌细胞壁,需要对现有方法进行改进,从而获得可广泛应用于平台期植物乳杆菌的快速、高效质粒提取方法。
由上述电泳及紫外定量结果可知,所得到的质粒浓度依照使用方法不同而不同。其中方法Ⅲ得到的DNA浓度最大,其次方法Ⅰ,而方法Ⅱ得到的DNA浓度最低。方法Ⅲ具有高效率的首要原因可能是在质粒提取过程中使用了强通透剂——丙酮。这一过程大大增加了植物乳杆菌细胞壁通透性,从而为溶菌酶进一步裂解细胞壁提供了良好的基础[9]。利用方法Ⅰ检测植物乳杆菌质粒通常是可行的,但由于方法Ⅰ操作过程过于复杂,并且存在EB污染风险,因此并不利于常规操作。方法Ⅱ应用于乳酸球菌质粒提取时具有很高的效率,但应用于植物乳杆菌质粒提取过程中时却不尽人意。由此可知,并非所有乳酸球菌质粒提取方法均适用于其他乳酸菌的质粒提取,因此,需要依照不同的物种,对质粒提取方法进行优化及改进。方法Ⅰ得到的DNA总浓度虽然比方法Ⅱ得到的大,但依照电泳结果可知方法Ⅰ得到的质粒提取物中基因组DNA污染较大,而方法Ⅱ使用了过柱纯化方法,因此有效降低了基因组DNA的污染比例。
该研究为建立快速有效的植物乳杆菌质粒提取方法,在方法Ⅱ的基础上增加了丙酮处理过程,从而提高了植物乳杆菌质粒获得率,建立了适合于平台期植物乳杆菌快速、高效质粒提取方法。利用该方法进一步分析野生型植物乳杆菌QZ21、QZ56和H18的质粒,得到2个高拷贝质粒和1个无质粒植物乳杆菌。其中高拷贝质粒可以改造为表达载体,而无质粒植物乳杆菌可以作为方便的受体菌株。
由于乳酸菌的益生作用和食品领域应用潜力,目前已被越来越多的研究团队所关注。如何开发利用乳酸菌作为转基因技术、制药、食品加工及饲料等领域的生物媒介是关键。其中乳酸菌工程菌的制备及相应载体的构建是基础,然而在此过程中,乳酸菌质粒提取是重要的技术手段。乳酸球菌质粒提取方法虽然已被广泛报道,但植物乳酸杆菌质粒的快速、高效提取方法仍需进一步优化。该试验中,通过对比分析不同试验方法的基础上,进一步优化,得到了快速有效的植物乳杆菌质粒提取方法,最终利用该方法获得了构建植物乳杆菌表达系统所需高拷贝质粒和受体菌株,为构建植物乳杆菌表达系统奠定基础。

