禽呼肠病毒套式RT-PCR检测方法的建立*
毕研丽,王金良,,郭广君,,杨 慧,吕素芳,宋 峰,苗立中,,沈志强*,
(1.山东省滨州畜牧兽医研究院,山东滨州 256600;2.山东绿都生物科技有限公司,山东滨州 256600)
禽呼肠病毒套式RT-PCR检测方法的建立*
毕研丽2,王金良1,2,郭广君1,2,杨 慧2,吕素芳1,宋 峰2,苗立中1,2,沈志强*1,2
(1.山东省滨州畜牧兽医研究院,山东滨州 256600;2.山东绿都生物科技有限公司,山东滨州 256600)
根据GenBank中登录的禽呼肠病毒(ARV)基因组序列,设计合成了2对引物,外部引物的扩增片段大小为478 bp,内部引物的扩增片段大小为247 bp,建立了适合ARV快速检测的套式RT-PCR方法(RT-nested-PCR)。采用该方法对REV毒株进行了检测,均能扩增到247 bp的条带,而禽流感病毒(H9亚型)、新城疫病毒、传染性腔上囊病病毒、减蛋综合征病毒、禽白血病病毒、禽网状内皮组织增生病病毒、马立克病病毒和鸭瘟病毒的扩增结果均为阴性。该方法第1次扩增的敏感性是100 pg,第2次扩增的敏感性是1 fg,第2次比第1次扩增的敏感性高105倍。该检测方法表明,所建立的逆转录套式RT-PCR方法比普通RT-PCR方法敏感性高,具有重复性好、特异性强、敏感性高等优点,可用于禽呼肠病毒的临床诊断、病料检测和分子流行病学调查等。
禽呼肠孤病毒;逆转录套式RT-PCR;检测
*通讯作者
禽呼肠病毒(Avian reovirus,ARV)是呼肠病毒科正呼肠病毒属的成员,为无囊膜、双股的RNA病毒。该病毒可感染鸡、火鸡、鸭、鹅及其他野鸟等多种禽类[1],主要引起关节炎、腱鞘炎,在临床上与鸡慢性呼吸道病、胃肠道吸收障碍、心肝病损、蓝冠病、肉鸡矮小综合征有一定联系,可引起中枢神经症状和免疫抑制[2-3]。此外,ARV与其他免疫抑制性疾病的混合感染在鸡群中普遍存在,导致鸡生长缓慢,饲料报酬率低和影响免疫效果,给养禽业造成巨大的经济损失[4-5]。ARV的检测方法主要有ELISA、RT-PCR和核酸探针技术等[6-9]。ELISA方法多用于ARV抗体的检测,较敏感,但所需时间长;常规RT-PCR技术敏感性不高;核酸探针技术敏感,但操作较繁琐,存在费时、代价高、敏感性和特异性不够理想的缺点。ARV是一种双股RNA病毒,病毒颗粒中的基因组有10个不同的独立节段组成[1,10-11]。其中对S1节段研究的比较详细,而对其他节段的研究尚不深入。为了提高 ARV检测的准确性和效率,本研究拟建立一种特异性强、敏感性高、快速、简便、准确的分子生物学检测方法,为ARV的早期诊断和流行病学调查提供一种有效的检测方法。
1 材料与方法
1.1 材料
TaqDNA聚合酶、M-MLV反转录酶、RNasin、dNTPs、pMD18-T克隆载体及其他限制性内切酶、DNA Marker DL 2 000等购自宝生物工程(大连)有限公司;Trizol、质粒DNA提取试剂盒与胶回收试剂盒均购自上海生工生物工程技术服务有限公司。其他化学试剂如氯仿、异丙醇、乙醇等,均为国产分析纯产品。禽呼肠病毒(ARV)、H9亚型禽流感病毒(AIV H9)、新城疫病毒(NDV)、传染性腔上囊病病毒(IBDV)、减蛋综合征病毒(EDSV)、禽白血病病毒(ALV)、禽网状内皮组织增生病病毒(REV)、马立克氏病病毒(MDV)、鸭瘟病毒(DPV)均由山东省滨州预防兽医学与动物生物技术重点实验室分离并保存。
1.2 方法
1.2.1 病毒基因组RNA的提取 取疑似感染禽呼肠病毒发病病禽的组织研磨,反复冻融3次,经13 000 r/min离心10 min,取上清作为待检样品。取离心后的含病毒的上清液250 μL,加入 Trizol试剂750 μL,按T rizol试剂使用说明提取健康鸡胚及各病毒RNA。
1.2.2 引物的设计与合成 根据GenBank中登录的ARV参考毒株S1基因序列,利用Primer 5.0软件设计合成了2对特异性引物,其中引物Pl、P2的扩增长度478 bp,引物P3、P4的扩增长度为247bp。外侧引物序列为:P1:5-ATGCTGCGTATGCCTCCCG-3,P2:5-AATCAGCCGCACGTGGACC-3;内侧引物序列为:P3:5-GGTAACGTCCATTGTCAGG-3,P4:5-AAACGTCGTATGGCGGA-3。引物由上海生工生物工程技术服务有限公司合成,用DEPC处理水溶解并配成20 pmol/mL溶液,置-20℃冰冻保存。
1.2.3 RT-PCR方法的建立
1.2.3.1 反转录合成cDNA 反转录反应按20 μL体系操作,反转录条件为42℃作用60 min后,95℃5 min灭活反应。
1.2.3.2 RT-PCR反应条件的优化 最适退火温度的确定 :分别以 48、50、52 、53、54、55 ℃的退火温度进行梯度RT-PCR反应,对扩增产物进行琼脂糖凝胶电泳观察,确定最佳退火温度。
最适模板浓度的确定:分别以 1、2、4、6、8、10 μL反转录cDNA 为模板,保持其他试剂浓度及反应条件不变,对扩增产物进行琼脂糖凝胶电泳观察,确定最佳模板浓度。
最适引物浓度的确定:在50 μL RT-PCR反应体系中分别加入上下游引物(20 μ mol/μL)0.2、0.3 、0.5、0.7 、1.0 、1.2 μL,对扩增产物进行琼脂糖凝胶电泳观察,确定最佳引物浓度。
1.2.3.3 RT-PCR扩增反应 第1轮RT-PCR扩增反应:按50 μL体系进行,根据上述试验确定的最适模板浓度、最适引物浓度和最适退火温度,确定最佳PCR反应条件:0.5 μLTaqDNA 聚合酶(5 U/μL),5 μL 10 ×buffer,4 μL dNTP(2.5 mmol/L),上下游引物 P1,P2(20 μ mol/L)各0.5 μL,cDNA 模板5 μL,双蒸水补足至50 μL。扩增条件为 95℃5 min;94℃30 s,55℃45 s,72℃1 min,30个循环;最后72℃延伸10 min。第2轮RT-PCR扩增反应:按 50 μL体系进行,模板为第 1 轮的 RT-PCR 产物1 μL,5 μL 10 ×buffer,4 μL dNTP(2.5 mmol/L),上下游引物 P3,P4(20 μ mol/L)各 0.5 μL,0.5 μLTaqDNA 聚合酶(5 U/μL),双蒸水补足至50 μL。扩增条件为 95 ℃ 5 min;94℃30 s,53℃45 s,72℃1 min,30个循环,最后72℃延伸10 min。
1.2.4 RT-PCR的特异性试验 分别在二级生物安全实验室的生物安全柜内提取实验室保存H9亚型禽流感病毒、新城疫病毒、传染性腔上囊病病毒、减蛋综合征病毒、禽白血病病毒、禽网状内皮组织增生病病毒、马立克病病毒、鸭瘟病毒的总RNA或DNA,用已建立的套式 RT-PCR方法扩增,每次扩增反应同时设双蒸水阴性对照和ARV毒株为模板的阳性对照,扩增反应结束后进行凝胶电泳检测。
1.2.5 RT-PCR的敏感性测定 将ARV阳性病料中提取病毒及宿主细胞总RNA,用紫外分光光度计测定其含量,并依次做10倍梯度稀释,每个稀释度取l μL为模板,用引物Pl和P2进行 RT-PCR扩增,反应结束后进行凝胶电泳检测。以第1次 RTPCR产物为模板,用引物P3和P4进行第2次扩增,反应结束后进行凝胶电泳检测。
1.2.6 RT-PCR的重复性试验 用建立的套式RT-PCR检测方法分别对ARV感染的7份阳性样品以及5份阴性样品重复检测3次,以验证本方法的重复性和稳定性。
1.2.7 临床样品的检测 对山东,江苏,内蒙,河南等省的17份送检疑似病料进行套式RT-PCR检测。
2 结果
2.1 扩增产物的检测
第1轮扩增产物的预期大小为478 bp;第2轮扩增产物的预期大小为247 bp。其扩增产物的电泳结果(图1)。
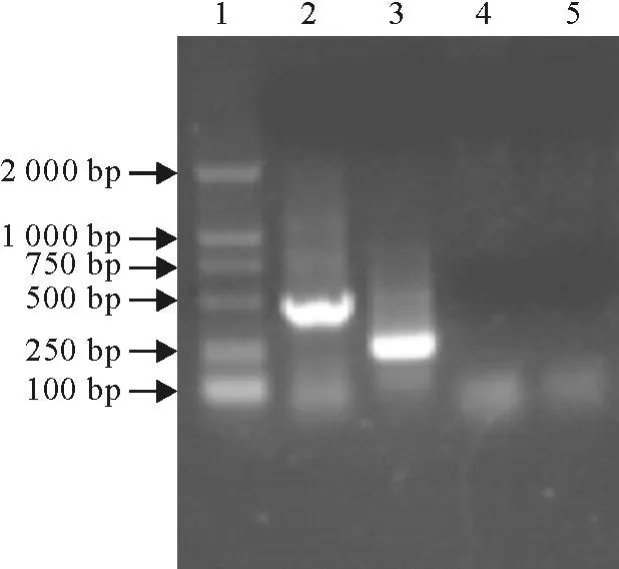
图1 两对引物的RT-PCR扩增结果Fig.1 The products amplified with the two primers
2.2 套式RT-PCR的特异性试验
利用设计的第1轮引物对禽呼肠病毒、H9亚型禽流感病毒、新城疫病毒、传染性腔上囊病病毒、减蛋综合征病毒、禽白血病病毒、禽网状内皮组织增生病病毒、马立克病病毒、鸭瘟病毒以相同的条件进行RT-PCR扩增,琼脂糖凝胶电泳结果见图2。取上述RT-PCR产物各1 μL为模板,利用第2轮引物进行套式RT-PCR检测,琼脂糖凝胶电泳结果见图3。只有ARV出现扩增产物,H9亚型禽流感病毒、新城疫病毒、传染性腔上囊病病毒、减蛋综合征病毒、禽白血病病毒、禽网状内皮组织增生病病毒、马立克病病毒、鸭瘟病毒均未扩增出片段。

图2 第1轮扩增的特异性试验Fig.2 The first round amplification specificity test
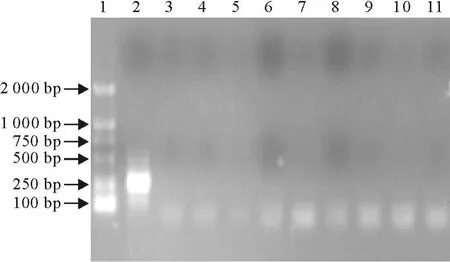
图3 第2轮扩增的特异性试验Fig.3 The second round amplification specificity test
2.3 套式RT-PCR敏感性试验
用紫外分光光度计测定的模板RNA浓度为10 μg/mL。将提取的 RNA依次做10倍梯度稀释,每个稀释度取1μL,作为模板。用第1轮引物进行RT-PCR扩增,结果显示第1轮RT-PCR扩增的敏感性为100 pg(见图4),以第1轮RT-PCR产物为模板,用第2轮RT-PCR引物进行第2次扩增,结果显示,第2轮RT-PCR扩增的敏感性为1 fg(图5)。表明第2次扩增的敏感性比第一次高105倍。
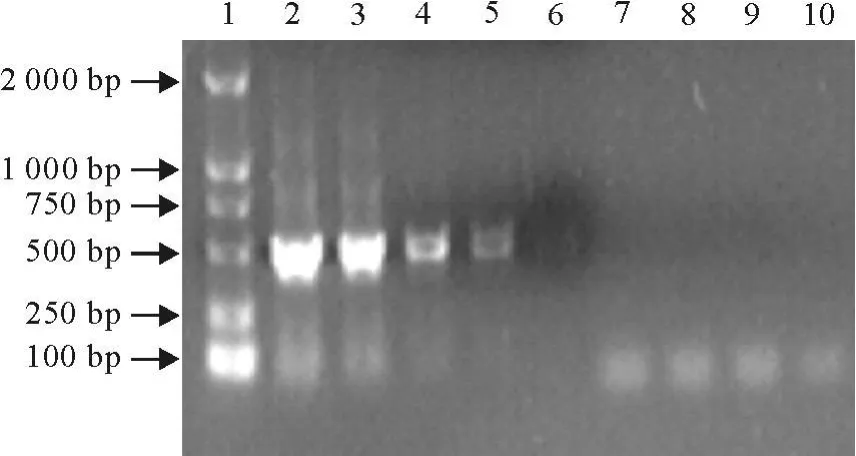
图4 第一轮扩增的敏感性试验Fig.4 The first round amplification sensitivity test
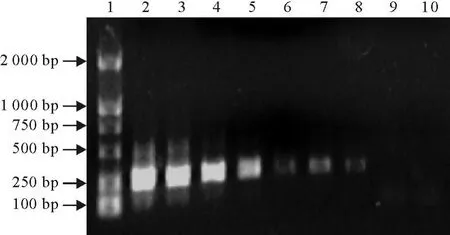
图5 第2轮扩增的敏感性试验Fig.5 T he second round amplification sensitivity test
2.4 套式RT-PCR重复性试验
经过3次重复操作,结果一致,表明本研究建立的套式RT-PCR方法是稳定可靠的。
2.5 临床样品的检测
对17份在不同地区采集的疑似病料,用建立的套式RT-PCR方法进行了检测,利用第 1轮 RTPCR检测出阳性样品5份,而利用套式RT-PCR检测出9份阳性样品。对阳性样品的RT-PCR产物全部测序,进行序列分析,结果为禽呼肠病毒。
3 讨论
当前,一些鸡场发病率高、病因复杂、很多病例表现为非典型性或混合性感染,甚至呈隐性感染,给生产造成严重经济损失的原因中,免疫抑制病病毒的感染是重要因素之一[12-14]。在这些情况下,病禽组织中病毒含量较低,用一次RT-PCR难以得到满意的结果。套式RT-PCR是PCR的一种改良模式,是指利用两套PCR引物进行两轮PCR扩增反应,以达到从微量的模板中获得高浓度和高纯度的目的片段。由于它具有比常规PCR更高的敏感性和特异性的优点,已被用于多种畜禽 RNA病毒的检测[15]。由于套式PCR反应有两次 RT-PCR扩增,从而降低了扩增多个靶位点的可能性,增加了检测的敏感性;又有2对RT-PCR引物与检测模板的配对,增加了检测的可靠性。在套式RT-PCR方法中,首次反应产物的转移也有助于稀释那些最初可能存在于样品中的抑制物,因此,套式RT-PCR方法通过反转录产物的PCR和套式PCR的二次扩增,大大提高了检测的灵敏度,避免了样品检测过程中的假阴性问题。
本研究建立的套式RT-PCR对ARV能够扩增出247 bp的特异性片段,而H9亚型禽流感病毒、新城疫病毒、传染性腔上囊病病毒、减蛋综合征病毒、禽白血病病毒、禽网状内皮组织增生病病毒、马立克氏病病毒、鸭瘟病毒的扩增结果均为阴性,表明该方法具有良好的特异性。本研究建立的套式 RT-PCR方法对ARV的检测敏感性和特异性有了很大提高,第1次扩增的敏感性为100 pg,第2次扩增的敏感性达到1 fg,敏感性提高了105倍,具有良好的应用前景。
本研究用建立的套式RT-PCR方法对来自山东,江苏,内蒙,河南等省的17份送检的疑似病料进行检测,利用第1轮RT-PCR检测出阳性样品5份,而利用套式RT-PCR检测出9份阳性样品。该检测方法的初步应用显示出了很好的敏感性与特异性,表明该方法可用于ARV的临床诊断、病料检测及分子流行病学调查。
[1]殷 震,刘景华,动物病毒学[M].2版:北京:科学出版社,1997:11.
[2]Calnek B W.禽病学[M].高 福,苏敬良,译.10版.北京:中国农业大学出版社,1999:902-908.
[3]Benavente J,Martinez-Costas J.Avian reovirus:Structure and biology[J].Virus Research,2007,123(2):105-119.
[4]崔治中,孟珊珊,姜世金,等.我国白羽肉用型鸡群中CAV、REV和REOV感染状况的血清学调查[J].畜牧兽医学报,2006,37(2):152-157.
[5]LING Y L,HUANG J S,HUW L L.A monoclonal antibody based competitive enzyme-linked immunosorbent assay for detecting antibody production against avian recovirus proteinδ A[J].J Virol M ethods,2006,136(1/2):71-77.
[6]Liu Hung J,Liam C Kuo,Yu C Hu,et al.Development of an ELISA for detection of antibodies to avian reovirus in chickens[J].J Virol M eth,2002,102:129-138.
[7]谢芝勋,秦 宇,谢丽基,等.应用禽呼肠孤病毒δ 3融合为抗原的ELISA检测方法的建立[J].畜牧与兽医,2007,39(11):3-7
[8]Van De Zande S,Kuhn E M.Central nervous system signs in chickens caused by a new avian:A pathogenesis study[J].Vet Microbiol,2007,120(1):42-49.
[9]熊文婕,谢芝勋,唐 熠,等.SYBR Green I实时荧光定量RTPCR检测禽呼肠孤病毒δ C和δ NS基因方法的建立[J].广西农业科学,2010,41(4):366-370.
[10]谢芝勋,邓显文,刘加波,等.禽呼肠孤病毒广西分离株δ 3基因的克隆和表达[J].中国预防兽医学报,2005,27(3):167-170.
[11]Hsien Sheng Yin,Happy K Shien,Long Huw lee.Characterization of the double-stranded RNA genome segment S3 of avian reovirus[J].J Virolo M ethods,1997,67:93-101.
[12]童桂香,谢芝勋,黄 琦,等.禽呼肠孤病毒实时荧光定量RTPCR检测方法的建立[J].中国兽医科学,2007,37(9):767-771.
[13]王全溪,吴宝成,李国平,等.番鸭呼肠孤病毒感染对体液免疫功能的影响[J].中国农业科学,2010,43(2):424-429.
[14]Liu Hung J,Long H Lee,Hsiao W Hsu,et al.M olecular evolution of avian reovirus:evidence for genetic diversity and reassortmemt of the S-class genome segment and multiple cocirculating lineages[J].Virology,2003,314:336-349.
[15]谢芝勋,刘加波,庞耀珊,等.应用半套式聚合酶链反应检测禽呼肠孤病毒S1基因的研究[J].中国兽医杂志,2001,37(3):6-8.
Establishment of a Nested RT-PCR Assay for Detection of Avian Reovirus
BI Yan-li2Wang Jin-liang1,2GUO Guang-jun1,2,YANG Hui2,L¨USu-fang1,SONG Feng2,MIAO Li-zhong1,2,SHEN Zhi-qiang1,2
(1.Shandong Binzhou Animal Science&Veterinary Medicine Insitute,Binzhou,Shandong,256600;
2.Shandong Lvdu Bio-industry Company,LTD,Binzhou,Shandong,256600)
According to the sequence of RNA polymerase gene of avian reovirus(ARV)strain published in GenBank,two pairs of primers were designed and synthesized.The outer primers amplified a fragment of 478bp in length,and the inner primers amplification fragment size was 247 bp in length,A nested RT-PCR assay for rapid detection of ARV was established.A specific 247 bp fragment was amplified from RNA templates of ARV strain,but no bands were amplified with templates extracted respectively from avian influenza virus(AIV)subtype H9,Newcastle disease virus(NDV),infectious bursal disease virus(IBDV),egg drop syndrome virus(EDSV),subgroup J ALV(ALV-J),Reticuloendotheliosis(REV),Marek'S disease virus(MDV),duck plague virus(DPV).Sensitivity of the 1st and 2nd amplifications by the nested RTPCR assay was 100 pg and 1 fg,respectively.The sensitivitv of the 2 nd amplifications was increased by 105times.The results showed that the nested RT-PCR was specific,sensitive,rapid,and accurate,and could be used as a routine assay for the detection of ARV.This method had good reproducibility,specificity and sensitivity,and might detect low content ARV accurately and rapidly.This method could be used as a method for the diagnosis and detection of clinical cases,and for molecular epidemiological investigation of ARV.
Avian reovirus;RT-nested-PCR;detection
S852.659.5;Q789
A
1007-5038(2011)08-0021-04
2010-12-27
毕研丽(1981-),女,山东莱芜人,研究实习员,硕士,主要从事基因工程疫苗与畜禽疾病诊断学研究。

