奶山羊实验性乳房炎的病理组织学观察及促炎性细胞因子的检测
韩炎森,牟 珊,陈德坤*
(1.西北农林科技大学生命科学学院,陕西杨陵 712100;2.西北农林科技大学动物医学院,陕西杨陵 712100)
奶山羊实验性乳房炎的病理组织学观察及促炎性细胞因子的检测
韩炎森1,牟 珊2,陈德坤2*
(1.西北农林科技大学生命科学学院,陕西杨陵 712100;2.西北农林科技大学动物医学院,陕西杨陵 712100)
选健康泌乳期关中奶山羊8只,分成金黄色葡萄球菌感染组和大肠埃希菌感染组,每只羊分别经右乳头灌注病原性大肠埃希菌(3×103cfu)和金黄色葡萄球菌(3×102cfu),对照乳区灌注等量无菌PBS。于灌注细菌前后不同时间采集血样和乳样,测定血清和乳样中的促炎性细胞因子水平,并于72 h后取山羊乳腺组织制备病理切片观察组织变化。结果显示,金黄色葡萄球菌感染组奶山羊乳样中IL-1β、IL-6、IL-8、IL-12、IL-17和TNF-α水平不断升高,血样中相同细胞因子水平均表现先上升后下降特点;大肠埃希菌感染奶山羊乳样中细胞因子表现为先上升后下降趋势,血样中变化趋势不明显。组织病理切片观察显示乳腺被金黄色葡萄球菌感染后腺泡腔内可见脱落的腺泡细胞、淋巴细胞、中性粒细胞及巨噬细胞;间质水肿,结缔组织间隙可见大量淋巴细胞、中性粒细胞及巨噬细胞浸润。
乳房炎;组织病理学;细胞因子
*通讯作者
乳房炎是泌乳动物主要疾病之一[1-2],在奶牛和奶山羊养殖中最为常见。近年来随着奶山羊养殖业的迅速发展,乳房炎问题也日显突出。乳房炎的发生不仅导致动物泌乳量降低,乳汁质量下降,严重的还会导致动物死亡,不仅给养殖业造成经济损失,还使得乳制品品质下降,有害微生物含量超标等,危害消费者身体健康。
乳腺在乳房炎发生时具有一系列防御机制保护,由粒细胞和细胞因子所介导的非特异性免疫反应在这个过程的早期起着大部分的保护作用。虽然绵羊、奶牛、猪和小鼠实验性乳房炎[3-7]及其免疫保护因子的变化规律和机理[7-9]都有过报道,但由于免疫机制的复杂性,乳房炎一直都难以得到有效预防。本研究利用人工诱发山羊实验性乳腺炎,研究乳房发病过程中的病理变化及血液和乳汁中细胞因子的变化规律。为阐明乳腺的防御体系并通过人工干预提高乳腺的健康水平提供理论依据。
1 材料与方法
1.1 材料
1.1.1 试验用动物 8只健康泌乳期关中奶山羊,购自关中地区养殖户,处于第2个~3个泌乳期,体重35 kg左右。持续检测1周,乳样菌检阴性,动物无乳房炎表现。
1.1.2 病原菌 西北农林科技大学动物医学院免疫学实验室从患乳房炎奶山羊乳汁中分离鉴定所得2种病原菌,大肠埃希菌(E.coli)O117血清型和金黄色葡萄球菌(S.aureus)。
1.2 方法
1.2.1 奶山羊乳房炎模型建立 调整大肠埃希菌浓度为3×103cfu/mL,葡萄球菌浓度为3×102cfu/mL。奶山羊分为大肠埃希菌感染组和金黄色葡萄球菌感染组,每组4只。采用乳头管灌注法于奶山羊右乳区灌注 1 mL菌液,左乳区灌注等量无菌PBS。
1.2.2 样品采集及处理 分别于灌注前(0h)和灌注后4、8、24、48、72 h采集静脉血和左右乳区乳汁。乳汁3 000r/min离心30 min,弃去上层乳脂和沉淀物。静脉血1 500 r/min离心10 min,收血清。脱脂乳和血清分装后-20℃保存待检。感染葡萄球菌的奶山羊于72 h后处死,取乳腺组织,40 g/L多聚甲醛固定,石蜡包埋,切片,HE染色,进行病理组织学观察。
1.2.3 细胞因子检测 用购自美国R&D公司的细胞因子ELISA试剂盒按说明书所述:加样,加酶,显色,终止,分别检测血清和脱脂乳中细胞因子IL-1β,IL-6,IL-8,IL-12,IL-17和 TNF-α的浓度。
2 结果
2.1 乳房灌注病原菌后山羊的临床变化
金黄色葡萄球菌感染组山羊在灌注细菌后2 h开始出现精神委靡,4 h后饮食欲下降,右乳区比左乳区明显发热,乳汁LMT检测已呈强阳性。24 h后山羊更加委靡,个别羊全身颤抖甚至无法站立并出现拉稀,饮食欲几近废绝,右乳区明显肿大发热变硬,乳汁发黄、pH升高,产奶量严重下降。48 h后山羊躺卧,饮食欲废绝,右乳区肿大变硬发凉,乳汁已成血乳。大肠埃希菌感染组山羊在灌注细菌后4 h开始精神不振,右乳区稍有发热,乳汁LMT也是强阳性。但24 h后精神状况出现好转,少量饮食,右乳区仍较左乳区发热,产奶量下降,乳汁pH亦有升高;体温在感染后升高明显,感染后72 h时仍未恢复正常。
2.2 促炎性细胞因子 IL-1β、IL-6 、IL-8、IL-12 、IL-17和TNF-α的变化
金黄色葡萄球菌感染组山羊乳样中IL-1β、IL-6、IL-8、IL-12、IL-17 和 TNF-α水平呈持续上升趋势,血清中细胞因子水平则表现为先上升,并在感染后4h达到峰值,然后下降的趋势。大肠埃希菌感染山羊乳样中的细胞因子浓度则呈先上升后下降趋势,并且在灌注后24h水平最高,血清中 IL-1β,IL-6和IL-17表现为先上升后下降趋势,分别在感染后4、24、8 h细胞因子水平最高,IL-8和 TNF-α浓度始终低于感染前,IL-12变化规律不明显。除IL-6外,血清中其他检测细胞因子水平始终高于乳样(图1~图6)。
图1~图6乳样中细胞因子水平的变化趋势明显:金黄色葡萄球菌感染山羊细胞因子呈持续上升特点,大肠埃希菌感染山羊则呈先上升后下降特点;血清中细胞因子水平变化规律不明显。除IL-6外,血清中细胞因子水平始终高于乳样中。

图1 感染后72 h内 IL-1β浓度变化Fig.1 Concentration of IL-1βin 72 hours after infection
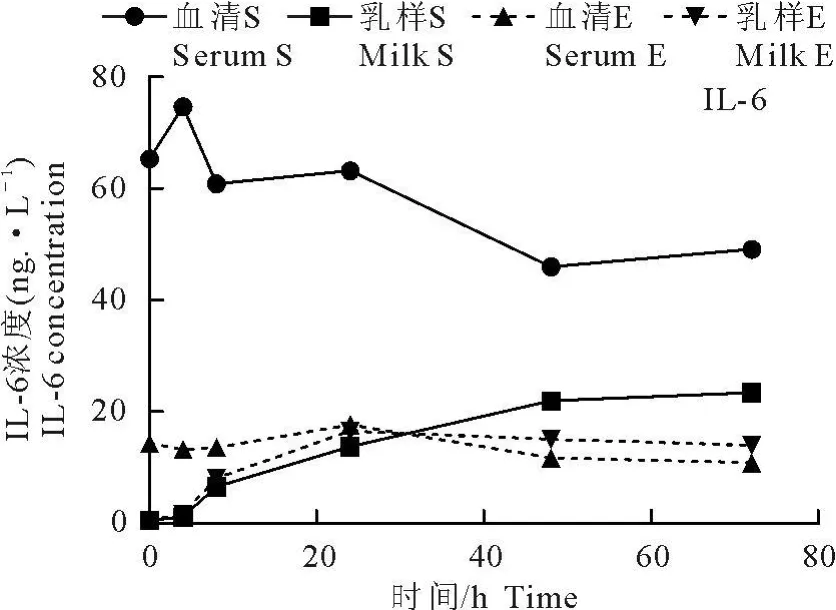
图2 感染后 72 h内IL-6浓度变化Fig.2 Concentration of IL-6 in 72 hours after infection

图3 感染后72 h内IL-8浓度变化Fig.3 Concentration of IL-8 in 72 hours after infection

图4 感染后72 h内IL-12浓度变化Fig.4 Concentration of IL-12 in 72 hours after infection
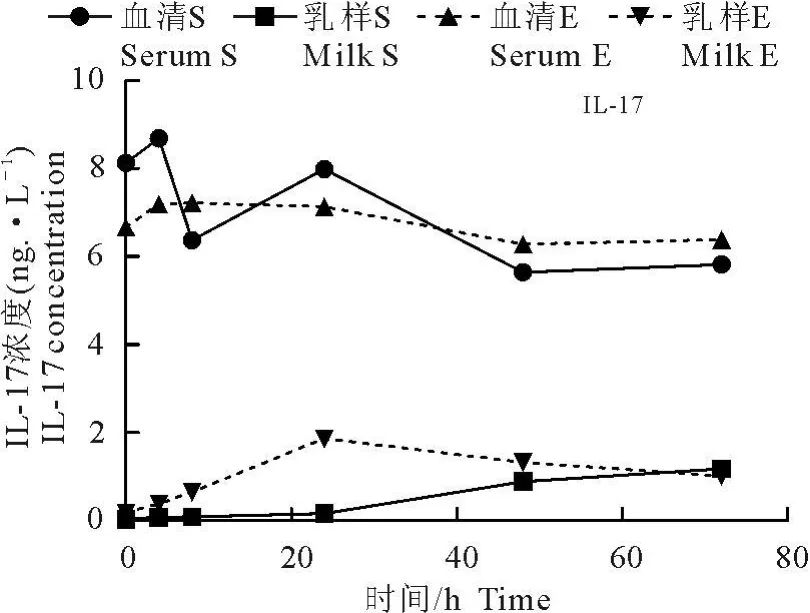
图5 72 h内IL-17浓度变化Fig.5 Concentration of IL-17 in 72 hours after infection

图6 感染后72 h内 TNF-α浓度变化Fig.6 Concentration of TNF-α in 72 hours after infection
2.3 乳腺组织病理学观察
乳腺组织石蜡切片形态学观察显示,正常健康奶山羊乳腺腺泡腔紧密排列,腺泡内无其他细胞出现(图7)。感染葡萄球菌的奶山羊乳腺腺小叶的腺泡腔中可见腺泡细胞、淋巴细胞、中性粒细胞及巨噬细胞浸润;间质水肿,结缔组织间隙可见大量淋巴细胞、中性粒细胞浸润(图8)。
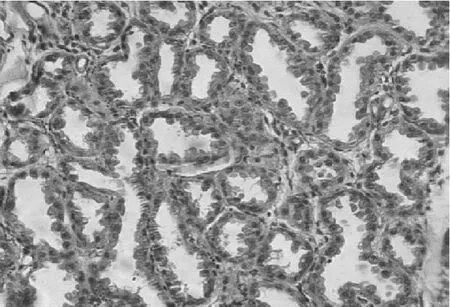
图7 健康泌乳期奶山羊乳腺组织切片(10×40)腺泡紧密排列,腺泡内无其他细胞浸润Fig.7 Mammary histology pathological section of healthy lactation dairy goat(10×40).Acinus were closely arranged,and there were no other cells in acinus
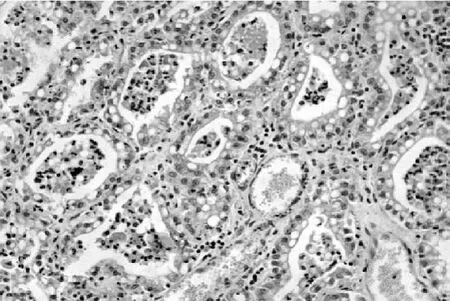
图8 实验性乳腺炎奶山羊乳腺组织切片(10×40)腺泡腔内炎性细胞浸润,间质水肿Fig.8 Mammary histology pathological section of experimental mastitis dairy goat(10×40).Inflammato ry cells infiltrating in acinar lumina,interstitial edema
3 讨 论
临床型乳房炎动物,通常都会表现出肉眼可见的临床症状,表现为动物精神委靡,表现为食欲不振,体温升高,乳房病变,乳汁变色,增稠或者呈水样、乳中有凝块等。有些动物伴随着颤栗或长卧不起等。实验性乳房炎病理模型描述中,患乳房炎乳腺腺泡腔内充满炎性细胞、变性脱落上皮细胞和空泡性渗出物(脂肪),间质水肿、间质组织增生,上皮萎缩。本试验中奶山羊临床症状及乳腺组织形态学观察显示实验性乳房炎模型成功建立,这也进一步为我们鉴别乳房炎提供了可参考的临床资料。
IL-1可诱导肝细胞合成急性期蛋白和一些补体组分促进中性粒细胞释放炎性介质和炎症蛋白直接参与炎性反应;IL-6促进Ig的分泌,促进单核细胞及中性粒细胞产生过氧化物,加速肝细胞APP合成从而介导机体抗炎症的自身稳定反应;IL-8又称中性粒细胞激活蛋白,能够趋化中性粒细胞向炎症部位迁移,并激活中性粒细胞,促使其释放溶酶体酶及超氧化物实现对病原体的杀伤作用;IL-12可以促进NK细胞的杀伤水平和黏附分子的表达,同时还可以上调肿瘤坏死因子(TNF);IL-17具有强大的招募中性粒细胞的作用,调节并促进多种炎性介质的产生,通过不同机制发挥致炎作用,主要介导防御胞外病原微生物感染,参与炎症反应和自身免疫,与免疫调节、免疫病理和宿主免疫关系密切;TNF-α位于促炎症细胞因子相互连接形成的网络顶点,作为诱导细胞反应中的最初物质,在细胞和亚细胞水平上激发一系列级联反应[10],可以诱导IL-1、IL-6等细胞因子的瀑布样释放。TNF-α一方面能增强嗜中性粒细胞的杀菌活性,另一方面还可以加速嗜中性粒细胞通过内皮细胞壁的渗出[11-12]。乳房炎病原菌释放的毒素可以募集白细胞和乳腺上皮细胞分泌细胞因子,这些细胞因子在乳房炎发生过程中是重要的促炎性因子。促炎因子一旦产生,不但可以自身激活,还能促进其他促炎因子的产生,引起连锁和放大效应,即“瀑布”效应。本实验中两个不同组乳样细胞因子浓度呈不同规律变化,我们也得到了部分与以前报道相似的结论[6,13],奶山羊感染病原菌后乳样中各种促炎性细胞因子水平都有明显升高。结合奶山羊临床症状表现可以知道伴随着各种细胞因子浓度的升高,金黄色葡萄球菌在乳腺中繁殖迅速并且释放大量毒素,炎症反应和乳腺组织损伤呈进行性加重。而大肠埃希菌对奶山羊乳房炎的致病力是有限的,其感染通常引起急性乳房炎但易于治愈。本研究为阐明乳腺的免疫机制及防御体系并通过人工干预提高乳腺的健康水平提供了理论依据。
[1]Virdis S,Scarano C,Cossu F,et al.Antibiotic Resistance in Staphylococcus aureus and Coagulase Negative Staphylococci Isolated from Goats with Subclinical Mastitis[J].Veterinary Medicine International,2010,2010:517-560.
[2]Zhu Y M,Miao J F,Zhang Y S,et al.CpG-ODN enhances mammary gland defense during mastitis induced by Escherichia coli infection in goats[J].Veterinary Immunology and Immunopathology,2007,120:168-176.
[3]Swanson KM,Stelwagen K,Dobson J,et al.Transcriptome profiling of Streptococcus uberis-induced mastitis reveals fundamental differences between immune gene expression in the mammary gland and in a primary cell culture model[J].Journal of Dairy Science,2009,92:117-129.
[4]Rinaldi M,Li RW,Bannerman DD,et al.A sentinel function for teat tissues in dairy cows:dominant innate immune response elements define early response to E.coli mastitis[J].Functional&Integrative Genomics,2010,10:21-38.
[5]Notebaert S,Demon D,Vanden Berghe T,et al.Inflammatory mediators in Escherichia coli-induced mastitis in mice[D].Beijing:Comparative Immunology Microbiology And Infectious Diseases,2008,31:551-565.
[6]Zhu Y.Early inflammatory response in periparturient sows to experimentally induced Escherichia coli mastitis[J].Doctoral thesis.Swedish University of Agricultural Sciences,2007.
[7]Persson-Waller K,Colditz I G,Seow H F.Accumulation of leucocytes and cytokines in the lactating ovine udder during mastitis due to Staphylococcus aureus and Escherichia coli[J].Res Vet Sci,1997,62(1):63-66.
[8]Zhu Y,Fossum C,Berg M,et al.Morphometric analysis of proinflammatory cytokines in mammary glands of sows suggests an association between clinical mastitis and local production of IL-1beta,IL-6 and T NF-alpha[J].Vet Res,2007,38:871-882.
[9]Osman K M,Hassan H M,Ibrahim I M,et al.T he impact of staphylococcal mastitis on the level of milk IL-6,lysozyme and nitric oxide[J].Comparative Immunology,Microbiology and Infectious Diseases,2010,33:85-93.
[10]Yang Y L,Li J P,Li K Z,et al.Tumor necrosis factor alpha antibody prevents brain damage of rats with acute necrotizing pancreatitis[J].World Journal of Gastroenterology,2004,10(19):2898-2900.
[11]Huang C,Desanctis G T,O Brien PJ,et al.Evaluation of the substrate specificity of human mast cell try ptase beta I and demonstration of its importance in bacterial infections of the lung[J].J Biol Chem,2001,276(28):26276-26284.
[12]Lin T J,Maher LH,Gomi K,et al.Selective early production of CCL20,or macrophage inflammatory protein 3alpha,by human mast cells inresponses to Pseudomonas aeruginosa[J].Infect Immun,2003,71(1):365-373.
[13]Blum J,Dosogne H,Hoeben D,et al.Tumor necrosis factor-α and nitrite/nitrate responses during acute mastitis induced by Escherichia coli infection and endotoxin in dairy cows[J].Domestic Animal Endocrinology,2000,19:223-235.
The Histopathological Observation and Detection of Inflammatory Cytokines of Experimental Mastitis in Dairy Goat
HAN Yan-sen1,MOU Shan2,CHEN De-kun2
(1.College of Li fe Science,Northwest A&F University,Yang ling,Shaanxi,712100,China;2.College of veterinary medicine,Northwest A&F University,Yang ling,Shaanxi,712100,China)
Choosed 8 healthy Guanzhong dairy goats which were in the lactation period and divided intoE.coli)group and S.aureus group.The teat on the right side of mammary glands ofE.coli)group and S.aureus group was inoculated respectively with pathogenicity E.coli(3 103CFU)and S.aureus(3 102CFU),and the contrary one with phosphate buffer solution(PBS).The blood and milk samples were collected at different times and the inflammatory cytokines levels in sera and milk was detected before and after the infection,then,collected the mammary tissue at 72 h post-infection and made histology pathological section.The results showed that the cytokines IL-1β,IL-6,IL-8,IL-12,IL-17 and TNF-αof S.aureus group in milk were rising,the cytokines levels of Saureus group in sera rose first and then declined;the cytokines levels ofE.coli)group in milk rose first and then declined,the trends on cytokines levels in sera were not obvious.Histology pathological section observation showed there were deciduous acinar cells,lymphocytes,polymorphonuclear(PMN)and macrophages in acinar lumina whose mammary gland was infected by S.aureus;there were interstitial edema,and a lot of lymphocytes,polymorphonuclear(PMN)and macrophages in connective tissue clearance.
mastitis;histopathology;cytokine
S852.31;S858.27
A
1007-5038(2011)08-0053-04
2011-04-27
公益性行业(农业)科研专项(201103038)
韩炎森 (1985-),男,山西长子人,硕士研究生,主要从事生物信息学分子设计及免疫学研究。

