甲型H1N1流感病毒双抗体夹心ELISA检测方法的初步建立
王云龙,周春峰,孙新城,李玉林,陈冬焕,李恒思,昌静峰,王国强,董彩文,,刘旺根,
(1.河南工业大学,河南郑州 450001;2.郑州职业技术学院,河南郑州 450121;3.河南省生物工程技术研究中心,河南郑州 450001;4.郑州大学 河南郑州 450001)
甲型H1N1流感病毒双抗体夹心ELISA检测方法的初步建立
王云龙1,2*,周春峰1,孙新城4,李玉林3,陈冬焕3,李恒思3,昌静峰3,王国强3,董彩文3,4,刘旺根3,4
(1.河南工业大学,河南郑州 450001;2.郑州职业技术学院,河南郑州 450121;3.河南省生物工程技术研究中心,河南郑州 450001;4.郑州大学 河南郑州 450001)
建立甲型H1N1流感病毒双抗体夹心ELISA检测方法,通过优化IPTG浓度和诱导时间确定HA融合蛋白的最佳表达条件,并进行Western bloc和血凝试验鉴定。用纯化蛋白制备单克隆抗体,建立检测甲型H1N1流感病毒的双抗体夹心ELISA检测方法,对其交叉反应、符合率进行验证。结果表明,HA蛋白在BL21(DE3)中得到表达,主要以包涵体的形式存在,分子质量为64 ku,最佳诱导条件为IPTG终浓度0.2 mmol/L,诱导时间4 h。Western blot鉴定其与H1N1病毒有相同的抗原性,血凝试验表明无血凝活性。制备HA单抗并初步建立双抗体夹心ELISA检测方法,检测100份阳性PCR样本,符合率为96%。建立的夹心ELISA方法可用于H1N1亚型流感病毒的初步诊断。
血凝素;甲型H1N1流感病毒;原核表达;双抗体夹心ELISA
*通讯作者
2009年新型三源重组甲型人流感病毒(H1N1)在世界范围内广泛传播[1-2〛,给世界造成了严惩经济负担。流感病毒属于正黏病毒科,病毒基因组含8个负链单股RNA,其中血凝素(HA)糖蛋白由片段4编码,是病毒最重要的表面抗原,具有亚型特异性,可以诱导特异性中和抗体的产生,对流感病毒及其亚型的诊断具有重要的价值。
甲型H1N1流感病毒的检测方法包括病毒分离鉴定、PCR、基因芯片技术等[3-4]。病毒分离鉴定需较长时间和严格的无菌操作,PCR技术需要昂贵的设备和受过特殊专业培训的人员。本研究通过表达H1N1亚型流感病毒的HA基因,制备抗HA单克隆抗体,初步建立检测H1N1亚型流感病毒的夹心ELISA方法。
1 材料与方法
1.1 材料
1.1.1 菌种和质粒 含有H1N1亚型HA蛋白基因原核表达质粒(pET-30 Xa/LIC-HA),由河南省生物工程技术研究中心构建并保存,E.coliBL21(DE3)由本实验室保存。
1.1.2 病毒和血清 甲型流感病毒H1、H5、H9亚型及肠道病毒71型(enterovirus 71,EV71)、麻疹病毒(morbillivirus,MV)灭活物由河南省生物工程中心提供,标准阳性样品(流感病毒裂解疫苗201004A001)购自华兰生物制品有限公司;标准阴性样品、鼠抗H1N1流感病毒阳性血清由本实验室保存。
1.1.3 试剂 酶标兔抗HA多抗由河南省生物工程技术研究中心制备;甲型H1N1流感病毒 RNA检测试剂盒购自北京金豪制药公司;蛋白Marker(SM0441)购自晶美公司;His Bind Purification Kit购自 Novagen公司;山羊抗鼠 IgG-HRP,RPMI-1640、HT、HAT、DAB、IPTG 购自 Sigma 公司;PEG2000购自Merck公司;其他化学试剂均为国产分析纯。
1.1.4 实验动物 Balb/c纯系小鼠购自中国医学科学研究院动物研究所。
1.2 方法
1.2.1 最佳诱导条件的确定 挑单个BL21(DE3)菌落接种于3.5 mL LB培养基(含50 μg/mL卡那霉素)中37℃振荡培养,OD600nm至0.6~0.8时分别加 IPTG 终浓度至 0.05、0.1 、0.2、0.3、0.4、0.5、0.6、0.7 mmol/L,于 37℃下诱导表达 5 h,取不同时间段(诱导表达 0 、2、3 、4、5、6、7、8 h)的菌液各 1 mL煮沸裂解,离心后加水和上样缓冲液进行SDSPAGE电泳。
1.2.2 表达产物的纯化 最佳条件下大样诱导并对产物进行SDS-PAGE电泳,进行可溶性分析。按照His Bind Purification Kit说明书纯化,用盐酸胍透析复性[5]。
1.2.3 表达产物的鉴定 按照Sambrook方法进行Western blot[6]。一抗用鼠抗H1N1流感病毒血清(1∶500),二抗用酶标兔抗鼠 IgG抗体(1∶1 000)鉴定活性。并用纯化蛋白进行微量法红细胞凝集试验[7]。
1.2.4 单抗制备 将HA抗原与弗氏完全佐剂按1∶1混合,充分乳化,皮下多点免疫6周龄~8周龄雌性Balb/c小鼠,75 μg/只,2周后改用弗氏不完全佐剂,免疫 3~4次。取抗血清效价较高(1∶25 600)小鼠于融合前3 d尾静脉免疫。无菌摘除小鼠脾脏,在200目不锈钢网上研磨制得脾细胞悬液并计数。融合时将脾细胞与SP2/0细胞按8∶1的数量比混合,在0.8 mL PEG2000的作用下进行融合,在 60 s内滴完,边加边搅拌,静置 90 s。最后由慢到快向前述融合细胞中滴加30 mL RPMI-1640培养液终止融合反应,1 400 r/min离心7 min,收集细胞用适量HAT培养液制成细胞悬液,100 μL/孔加入铺有饲养细胞的96孔细胞培养板中。HAT、HT筛选后采用间接ELISA筛选阳性孔[8-9]。经3次克隆化后,扩大培养并收集细胞注射小鼠,制备腹水,采用辛酸-硫酸铵沉淀法纯化抗体[10-11]。
1.2.5 检测方法的建立
1.2.5.1 包被单抗及酶标多抗最佳工作浓度的确定 将标准阴、阳性样品均作1∶100倍稀释,采用方阵滴定法[12-13]确定最佳单抗包被浓度和酶标多抗稀释度。采用常规夹心ELISA方法,用包被液将纯化单抗加入96孔板,100 μL/孔,4 ℃过夜;洗涤后加封闭液 150 μL/孔 37 ℃孵育 2 h;洗涤 3次加入100 μL/孔样品,37℃孵育30 min;洗涤后加酶标多抗100 μL/孔37 ℃孵育30 min;洗涤后加 TMB底物反应体系 100 μL/孔,37 ℃孵育 20 min;加入2 mol/L H2SO4终止反应,双波长(测定波长为450 nm,参考波长为630 nm)测OD值。
1.2.5.2 阴阳性判定标准的确定 取12份甲型H1N1流感病毒RNA检测试剂盒测定的阴性咽拭子样本,双波长测定OD值,每份样品设立两个重孔。计算出 12份样品的平均 OD值和标准方差(SD)。根据统计学原则,样本的OD值>阴性样本OD均值(X)+3×SD时,判为阳性,OD值<阴性样本OD均值(X)+2×SD时为阴性,两者之间为可疑,需重复检测一次,OD值>OD均值(X)+3×SD者判为阳性,其他均判为阴性[14-15]。
1.2.5.3 特异性试验 用建立的双抗体夹心ELISA方法对H5、H9亚型及EV71病毒、麻疹病毒灭物进行特异性交叉反应,同时设H1亚型阳性、阴性对照。
1.2.5.4 符合率试验 取100份甲型H1N1流感病毒RNA检测试剂盒测定的阳性咽拭子样本,用建立的双抗体夹心法双波长测定OD值,对比符合率。
2 结果
2.1 目的蛋白的诱导表达和鉴定
SDS-PAGE显示IPTG的最佳诱导浓度为0.2 mmol/L,最佳诱导时间为4 h,表达产物大小约为64 ku,与设计相符。此条件下目的蛋白表达量最大,主要以包涵体的形式存在(图1)。用His Bind Purification Kit进行表达产物纯化(图2),用盐酸胍透析复性。纯化后蛋白经Western blot鉴定,目的条带明显清晰(图3),同时将复性蛋白倍比稀释做红细胞凝集试验,各稀释度孔均未能凝集红细胞,说明目的蛋白无血凝活性。
2.2 单克隆抗体鉴定结果
获得1株杂交瘤细胞,注射小鼠制备腹水,测定效价达到1∶100 000。采用辛酸-硫酸铵沉淀法纯化抗体。结果显示纯化抗体浓度达到95%以上(图4)。
2.3 检测方法的建立
2.3.1 包被单抗及酶标多抗最佳工作浓度的确定
通过方阵滴定确定单抗最佳包被量为100 ng/孔,酶标多抗最佳稀释度为1∶400(表1),此条件下OD阳性值为0.983,阴性值为0.038,且P/N值较大。
2.3.2 阴阳性判定标准的确定 对12份阴性样本测定OD都在0.03~0.09之间,均一性较好,OD平均值为0.05,SD值为0.02。OD值>阴性样品OD的平均值+3×SD=0.11判为阳性,OD值<阴性样品OD的平均值+2×SD=0.09判为阴性,两者之间为可疑样品,对可疑样品重复检测一次,将OD值大于0.11者判为阳性,其他均判为阴性(表2)。

图1 HA基因表达产物的可溶性分析Fig.1 Solubility analy sis of the expressed product
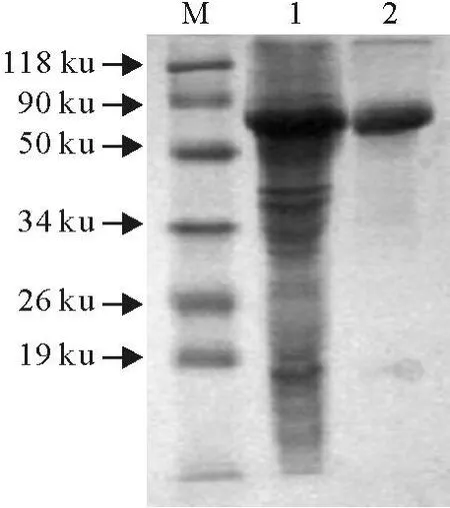
图2 融合蛋白的纯化Fig.2 The purification of the fusion protein

图3 HA基因表达产物Western-blot分析Fig.3 Western-blot analysis of recombinant protein HA
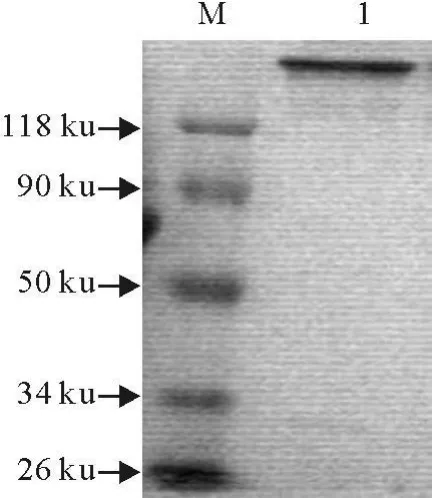
图4 腹水中单克隆抗体纯化Fig.4 Purified McAb from ascites fluid
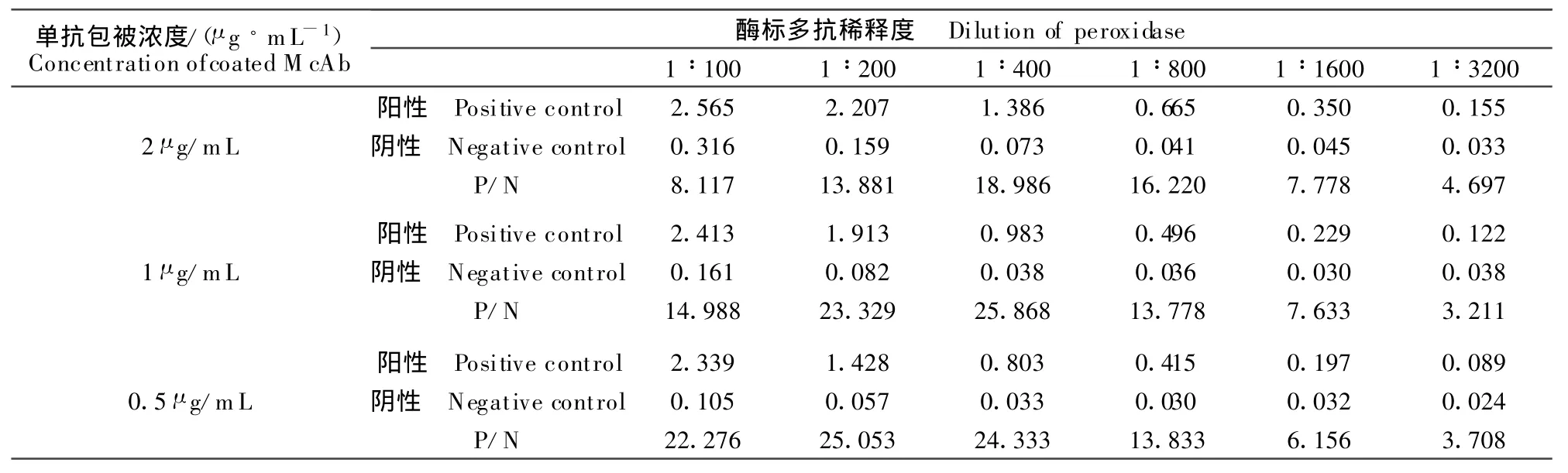
表1 最适单抗包被浓度和酶标多抗工作浓度的确定Table 1 Determination for optimal concentration of coated McAb and peroxidase
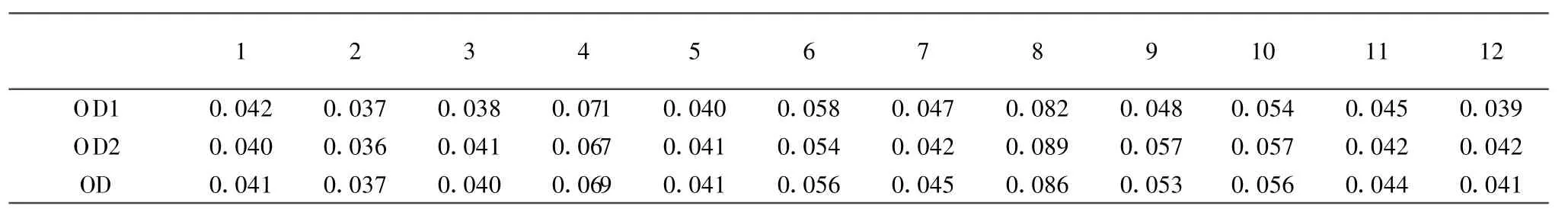
表2 阴阳性结果的判定Table 2 Determination for positive and negative criterion
2.3.3 交叉反应试验 用建立的夹心ELISA方法检测 H5、H9亚型及 EV71病毒、麻疹病毒,结果均呈阴性,阳性对照OD值为1.017,说明该方法对H1N1亚型流感病毒具有较高特异性(表3)。

表3 交叉反应试验Table 3 Results of cross-reaction
2.3.4 符合率试验 用建立的夹心ELISA方法检测100份阳性PCR样品,符合率96%,说明该方法与PCR检测结果有较高一致性。
3 讨论
本研究采用大肠埃希菌BL21(DE3)对HA进行表达,融合蛋白主要以包涵体的形式存在,Western-blot反应呈阳性,表明表达的融合蛋白具有与H1N1相同的线性表位。血凝试验表明原核表达的HA蛋白不具有血凝活性,说明其与天然构象存在差异。可能因其为原核系统表达,蛋白缺少糖基化等修饰作用,其经变性复性后,蛋白质二级结构可能有所改变,使其缺乏血凝等生物学活性。有文献报道真核表达的HA蛋白具有血凝活性[15],但至今尚未见原核表达的HA蛋白具有血凝活性的报道。
获得针对检测原的特异性抗体是建立特异性检测体系的关键,本试验在制得酶标多抗的基础上,制备特异性的单抗,细胞融合是单抗制备的关键步骤,需要一定经验才能顺利完成。试验表明建立的夹心ELISA方法具有较好特异性和灵敏度,而且操作简单,不需要特殊设备,即可实现对流感病毒型特异性的快速检测,在临床中非常具有实用价值。另外,通过体系优化,参考国家标准品建立标准曲线后,对流感病毒可实现定量检测,同时该体系可对流感疫苗主要成分HA蛋白实现定量检测,满足流感疫苗效力的控制要求,这将对流感预防和控制起到重要作用。
综上所述,该方法的建立为流感亚型标准化诊断试剂的开发奠定了基础,也可为流感检测和控制提供参考,因此具有十分重要的公共卫生学意义。
[1]Fatimah S,Jain S,Finelli L,et al.Emergence of a novel swineo rigin influenza A(H1N1)virus in humans[J].N Engl J Med,2009,360(25):2605-2615.
[2]张 钫,郭骁才,程薇波,等.基于基因组序列特征的甲型H1N1流感病毒来源分析[J].生物医学工程学杂志,2010,27(4):868-874.
[3]Hui Donga,Zhang Yanjun,Hui Xiong,et al.Detection of human novel influenza A(H1N1)viruses using multi-fluorescent realtime RT-PCR[J].Virus Research,2010,147(1):85-90.
[4]孙珊珊,沈国顺,田明尧,等.甲型HIN1与季节性HIN1流感病毒检测基因芯片的制备与初步应用[J].中国兽医学报,2010,30(5):634-638.
[5]熊 盛,任向荣,严兴,等.重组人源抗HBsAg单链抗体的纯化及亲和常数测定[J].中国病理生理杂志,2002,18(9):1069-1073.
[6]Joseph Sambrook,David W Russell.分子克隆实验指南[M].3版.黄培堂,等,译.北京:科学出版社,2002:1713-1726.
[7]于大海,崔砚林.中国进出境动物检疫规范[M].北京:中国农业出版社,1997:91-92.
[8]Wu R,Hu S,Xiao Y,et al.Development of indirect enzyme linked immunosorbent assay with nucleoprotein as antigen for detection and quantification of antibodies against avian influenza virus[J].Veterinary Research Communications,2007,31:631-641.
[9]吴素丽,孙惠玲,钱永华.猪瘟病毒E0蛋白的高效表达及其间接ELISA检测方法的建立[J].动物医学进展,2009,30(8):13-18.
[10]Michella M M,Parkinson A.A simple,non-chromatographic procedure to purify immunoglobulins from serum and ascites fluid[J].Journal of Immunological M ethods,1987,96(2):271-278.
[11]刘晓波,蔡美英,王 霞,等.一种简单实用纯化腹水McAb方法-辛酸/硫酸铵法[J].华西医大学报,1999,30(4):455-456.
[12]李永亮,卢曾军,杨苏珍,等.口蹄疫病毒非结构蛋白定量检测ELISA方法的建立[J].中国生物工程杂志,2009,29(11):70-73.
[13]He Qigai,Du Qingyun,Lau Suelyn,et al.Characterization of monoclonal antibody against SARS coronavirus nucleocapsid antigen and development of an antigen capture ELISA[J].Journal of Virological Methods,2005,129:46-53.
[14]王光华,独军政,丛国正,等.猪口蹄疫病毒VP1结构蛋白抗体间接ELISA方法的建立[J].生物工程学报,2007,23(5):961-966.
[15]万春和,刘 明,刘春国,等.H3亚型猪流感病毒血凝素基因在昆虫细胞中的表达及其间接ELISA检测方法的建立[J].中国兽医科学,2010,40(3):252-25.
Development of Double-antibody Sandwich ELISA for Detecting Influenza Virus(H1N1)
WANG Yun-long1,2,ZHOU Chun-feng1,SUN Xin-cheng4,LI Yu-lin3,CHEN Dong-huan3,LI Heng-si3,CHANG Jing-feng3,W ANG Guo-qiang3,DONG Cai-wen3,4,LIU Wang-gen3,4
(1.Henan University of Technology,Zhengzhou,Henan,450001,China;
2.Zhengzhou Technical College,Zhengzhou,Henan,450121,China;
3.Henan Biotechnology Research Center,Zhengzhou,Henan,450001,China;4.Zhengzhou University,Zhengzhou,Henan,450001,China)
To establish the Sandwich ELISA for H1N1 subtype Influenza Vilus.The best expression condition was determined by optimizing IPTG concentration and induction time.The protein was identified by Western blot and hemagglutination test.To prepare monoclonal antibody against purified recombinant protein of HA and establish the Sandwich ELISA for H1N1 subtype Influenza Vilus.Cross-reaction and coincidence rate of the method were tested.HA protein was successfully expressed with proper inducing conditions of 0.2 mmol/L IPTG and 4 hours induction inE.coliBL21(DE3).The fusion protein was mainly in the form of inclusion body,about 64 ku,Western-blot analysis proved that the recombinant protein had good reactive ability.Monoclonal antibody against recombinant protein was prepared and the Sandwich ELISA was established preliminarily,the results from detection of 100 samples by ELISA were 96%in agreement with that of RCR test.It suggested that the Sandwich ELISA could be useful for primary diagnoses of H1N1 subtype Influenza Vilus.
HA;H1N1 subtype influenza virus;prokaryotic expression;double-antibody sandwich ELISA
S5852.659.5
A
1007-5038(2011)08-0037-04
2010-12-15
郑州市重大科技专项(093SGBS22027);2010河南省工程技术中心专项经费(102102313105)
王云龙(1962-),男,河南洛阳人,教授,主要从事生物制药研究。

