猪细小病毒、伪狂犬病病毒和猪圆环病毒2型多重PCR检测方法的建立及应用
孙 黎,郭抗抗,王 静,刘 伟,曹伟伟,吕其壮,张彦明
(西北农林科技大学动医学院,陕西杨陵 712100)
猪细小病毒、伪狂犬病病毒和猪圆环病毒2型多重PCR检测方法的建立及应用
孙 黎,郭抗抗,王 静,刘 伟,曹伟伟,吕其壮,张彦明*
(西北农林科技大学动医学院,陕西杨陵 712100)
根据猪细小病毒(PPV)、伪狂犬病病毒(PRV)和猪圆环病毒2型(PCV-2)的基因序列,分别选取各自的保守区段设计引物,通过反应条件的优化,建立了检测PPV、PRV和PCV-2的多重PCR方法。用建立的方法对采自陕西省部分猪场的286份病料及血样进行检测,从对临床健康猪全血样品中PPV、PRV和PCV-2的检测结果看,PCV-2在正常猪群中有一定比例的存在,同时在个别猪场也存在PRV和PCV-2双重感染的现象;从临床患病猪病料中检测发现,PRV和PCV-2混合感染较严重,并有PPV+PRV+PCV-2三重感染发生;多重PCR检测结果与单项PCR检测结果的符合率达99%以上,说明建立的多重PCR检测方法可用于临床样品的检测,为疾病诊断提供参考。
猪细小病毒;伪狂犬病病毒;猪圆环病毒2型;多重PCR
*通讯作者
随着养猪业规模化、现代化程度的提高,人们在获得由此带来养殖数量迅速扩大,养殖效益快速提高的同时,也面临着集约化养殖而带来的动物疫病防控复杂化的问题,由于饲养密度的不断增加,使得病原体混合感染、继发感染的几率增加,为猪病防控带来很多问题。猪细小病毒(Porcine parvovirus,PPV)、伪狂犬病病毒(Pseudorabies virus,PRV)、猪圆环病毒2型(Porcine circovirus type 2,PCV-2)是当前影响养猪业发展的3种重要的病原[1]。由于PPV、PRV、PCV-2单独感染或混合感染均能引起猪发病,造成母猪的繁殖障碍/感染猪的免疫抑制,为其他病原的继发感染提供了便利,甚至会造成猪群中疫病的流行,使养殖生产蒙受损失,并有可能引发公共卫生问题[2]。PPV和PRV是造成猪繁殖/呼吸障碍的重要经济相关性病毒,并在生产中经常以混合感染的方式出现[3]。PCV-2除了引起猪繁殖和呼吸障碍之外,还可以造成猪圆环病毒相关疾病的发生,如感染仔猪先天性震颤、断奶仔猪多系统衰竭综合征和猪皮炎与肾炎综合征等[4]。
聚合酶链反应(polymerase chain reaction,PCR)具有快速、敏感、特异等优点,在病原的特异性检测方面具有明显的优势,在动物疫病诊断和病原检测上也得到广泛地应用,为疫病防控做出了重要贡献[5-8]。由于当前猪群中多种病原混合感染病例的增多,单一病原PCR检测方法也表现出自身的不足,在对多种病原菌进行检测时需要对一种病料进行多次PCR检测,使得检测时间延长,耗费人力,成本也高。多重PCR技术是在普通PCR技术基础上发展起来的一种快速检测技术,不仅保持了普通PCR技术敏感性高和特异性强的优点,而且还具有普通PCR技术所不具有的特点[9],一次PCR反应就可同时检测多种病原,具有简便、快捷、灵敏等优点,能满足生产上同时对多种疾病进行快速诊断的要求[10-13]。本研究前期对陕西省部分猪群中病毒性病原的调查检测,发现常有PPV、PRV和PCV-2的单纯或混合感染。为此我们拟建立 PPV、PRV和PCV-2检测的多重PCR方法,并对收集的病料进行检测,以期为生产中这3种病原的快速检测提供可用方法,也为养殖企业对这3种疫病的防控提供基础资料和参考。
1 材料与方法
1.1 材料
1.1.1 毒株、菌株和细胞 猪细小病毒(PPV)分离株、伪狂犬病病毒(PRV)分离株、猪圆环病毒2型(PCV-2)分离株,均由西北农林科技大学动物医学院重大动物疫病防治与畜禽产品安全实验室保存,并经PK-15细胞传代扩繁;大肠埃希菌DH5a株由本实验室保存。
1.1.2 病料及样品 2010年7月~2011年3月,共收集猪全血和组织样品286份,其中从无临床症状猪群中采集全血样品226份,患病猪病料60份。具体采样点为,从陕西杨凌某猪场采集正常肥育猪全血120份,兴平某猪场全血32份,大荔县某猪场全血样品33份,户县某猪场全血样品41份;宝鸡凤县某猪场患病猪全血(或)组织28份,眉县某猪场患病猪全血样品 32份。所有样品经分装后,于-40℃保存。
1.1.3 主要试剂 PCR Mix(含TaqTM DNA聚合酶,RNase Inhibitor,dNTPs,ddH2O)、DNA marker(DL 100,DL 2 000)、DNA凝胶回收试剂盒和高纯度质粒小量提取试剂盒均购自威格拉斯生物技术(北京)有限公司;基因组DNA提取试剂盒购自爱思进生物技术(杭州)有限公司;pMD19-T连接载体购自宝生物工程(大连)有限公司;琼脂糖购自GENE公司;其余试剂,如蛋白胨、酵母提取物、琼脂粉等均为国产分析纯。
1.2 方法
1.2.1 引物设计 根据GenBank上收录的国内外的PPV、PRV和PCV-2分离株的全基因序列,利用Lasergene 7.0和Oligo6.5软件对各病毒的不同分离株进行全基因序列分析,选择各自保守区段设计检测引物(表1)。引物由北京六合华大基因服务有限公司合成,使用浓度为10 μ mol/L。

表1 病毒检测引物序列Table 1 Primer sequence for virus detection
1.2.2 病毒DNA 的提取 取100 μL PK-15细胞病毒培养物(样品DNA提取时用100 μL抗凝血或100 mg组织病料),按照Axygen DNA提取试剂盒说明书提取病毒总DNA,以200 μL elution buffer溶解 DNA(1μL DNA=0.5 μL 血样或 0.5 mg 组织)。将提取的DNA分装后,置-20℃保存。
1.2.3 PPV、PRV和PCV-2 PCR检测方法的建立
1.2.3.1 根据引物设计软件的建议条件,初步建立分别检测PPV、PRV和PCV-2的PCR条件 在20 μL体系中分别加入 ,2 ×PCR Mix 10 μL,上 、下游引物各 1 μL(10μ mol/L),模板 DNA1 μL,补灭菌水至 20 μL。反应条件为,95℃5 min;94℃50 s,55℃~62℃退火30 s,72℃30 s,35个循环;72℃10 min。
1.2.3.2 单项PCR反应条件的优化 对PCR反应退火温度、引物浓度进行优化,确定最佳PCR反应条件。退火温度在54℃~62℃梯度进行优化,分别设为 54℃、56℃、58.0℃、60℃和62℃;引物梯度分别用终浓度 0.3、0.4、0.5、0.6 μ mol/L 四个梯度进行优化。其他条件同1.2.3.1,确定引物的最佳终浓度。
1.2.3.3 PCR产物的鉴定 将PCR产物用DNA凝胶回收试剂盒纯化回收后,与pMD19-T载体连接,转化大肠埃希菌DH5a后,筛选阳性克隆扩大培养,提取阳性质粒,送北京六合华大基因服务有限公司测序分析。
1.2.3.4 PCR反应的敏感性和特异性 PCR的敏感性试验按照DNA模板的梯度稀释进行,具体操作参照文献进行[14]检测进行。特异性试验对PCR产物进行测序鉴定外,将3种引物进行交叉反应和对其他猪源病原进行检测,观察引物有无交叉扩增和非特异性扩增,反应体系和条件同前。
1.2.4 多重 PCR反应条件的确定 在单一PCR的基础上,建立PPV、PRV和PCV-2检测的多重PCR。重点摸索PCR反应退火温度和引物终浓度,PCR 体系为 25 μL,其中 PCR Mix 12.5 μL,退火温度(56 ℃~62 ℃)、引物终浓度为0.2 μ mol/L~0.6 μ mol/L,经PCR条件优化后,确定反应最佳条件。
1.2.5 对临床样品的多重PCR检测 从陕西省不同地区养猪场收集的样品或病料(286份)用建立的多重PCR方法进行检测,同时分别用单重PCR分别对样品中的PPV、PRV和PCV-2进行检测,统计分析。
2 结果
2.1 PPV、PRV和PCV-2单重PCR的建立
2.1.1 最佳PCR退火温度的确定 经过对PCR反应最佳退火温度的筛选,确定最佳的PCR退火温度在PPV为58℃(图1),目的片段大小为295 bp;PRV为60℃(图2),目的片段大小为213 bp;PCV-2为60℃(图3),目的片段大小为403 bp。
2.1.2 最佳引物浓度的确定 经对最适合引物终浓度的筛选,确定PPV、PRV和PCV-2引物的最适终浓度均为为0.5 μ mol/L。
2.1.3 PCR产物的鉴定 分别对 PPV、PRV、PCV-2的扩增产物进行胶回收,克隆到 pMD19-T载体上,送北京六合华大基因服务有限公司测序分析显示,扩增片段与各自病毒参考株的同源性均在99%以上,可以确定PCR扩增片段的特异性良好。2.1.4 PCR反应的敏感性 对病毒DNA进行定量换算后,进行10倍梯度稀释,观察PCR反应的敏感性。结果显示,PPV的最低检测量为7.0 pg/μL DNA(图4);PRV的最低检测量为 2.7 pg/μL DNA(图5);PCV-2的最低检测量为5.9 pg/μL DNA(图6)
2.1.5 PCR反应的特异性试验和重复性试验 特异性试验表明,只有含PPV、PRV、PCV2核酸样品和引物的反应体系中能扩增出相对应的目的条带,而不与实验室保存的其他猪源病原微生物(猪圆环病毒1型、猪瘟病毒、猪繁殖障碍与呼吸综合征病毒、猪传染性胃肠炎病毒)发生反应,表明建立的PCR反应具有良好的特异性;利用建立起的单个病毒PCR检测方法,对阳性对照病毒DNA在不同时间重复检测4次,检验结果一致,说明方法的重复性较好。
2.2 多重PCR检测方法的建立
2.2.1 两重 PCR反应条件的优化 首先建立双重PCR检测方法,通过对病毒引物量的摸索,确定在20μL体系中,PPV引物体积为 0.5 μL(终浓度0.25 μ mol/L),PRV 的引物体积为 0.6 μL(终浓度0.3 μ mol/L)时,扩增效果较好(图 7);PRV+PCV-2的 PCR 引物量为 PRV 0.5 μL(终浓度0.25 μ mol/L),PCV-2 0.4 μL(终浓度 0.20 μ mol/L)(图8)。
2.2.2 多重PCR的建立 在双重PCR的基础上,建立多重PCR(三重 PCR)。多重PCR在 52、54、56、58、60℃的退火温度条件下进行 PCR扩增,结果表明,在退火温度为60℃时扩增效果最好(图9)。
多重PCR反应引物浓度的确定在退火温度为60℃下,PPV、PRV和PCV-2引物浓度分别为0.5 μL(终浓度 0.25 μ mol/L)、0.6 μL(终浓度 0.30 μ mol/L)和 0.4 μL(终浓度 0.20 μ mol/L)时,多重PCR反应检测结果最好。
多重PCR反应的敏感性和特异性多重PCR的敏感性参照文献进行[14]。将目的片段克隆到pMD19-T载体上,质粒经提取后用双蒸水分别进行10倍的倍比稀释,取每个稀释度的质粒为模板进行多重PCR反应,检测其敏感性。结果表明,PRV、PCV-2在多重 PCR反应中的敏感性到达 pg级,PRV在多重PCR反应中的最低检测量也达到了10 pg级(图10)。
以PCV-1、猪瘟病毒、猪繁殖障碍与呼吸综合征病毒、猪传染性胃肠炎病毒、PPV、PRV、PCV-2的DNA或cDNA为模板分别进行多重PCR检测,结果表明只有PPV、PRV和PCV-2多重PCR及特异PCR均扩增出特异性条带。
2.3 样品检测
对2010年7月~2011年3月从陕西省部分猪场收集的286份猪全血和组织样品用建立的多重PCR方法进行检测(部分PCR电泳图见图11)。从临床健康猪全血样品中PPV、PRV和PCV-2的检测结果来看,从陕西杨凌某猪场采集的120份正常肥育猪全血中共检出17份PCV-2阳性样品,占14.2%,无PPV和PRV的检出;从兴平猪场样品中检出PCV-2 5份,占 15.6%,也无 PPV和PRV的检出;从大荔县样品中检出PPV 1份(3.0%),PRV 3份(7.3%),PCV-2 7份(17.1%),其中 PRV+PCV-2双重感染样品3份(9.1%);从户县样品中检出PRV 5份(12.2%),PCV-2 4份(9.8%),其中PRV+PCV-2双重感染样品3份(7.1%)。检测结果说明PCV-2在临床健康猪群中有一定比例的存在,同时在个别猪场也存在PRV和PCV-2双重感染的现象,这些猪都是危险的传染源,应引起足够的重视。
从送检的临床患病猪病料的检测发现,凤县的28份样品中无PPV检出,PRV检出25份(89.3%),PCV-2检出28份(100%),PRV+PCV-2共检出25份(89.3%),说明本次猪患病是由PRV和PCV-2混合感染引起;眉县送检样品中均有PPV、PRV和PCV-2的检出,其中PPV检出6份(18.6%),PRV 31份(96.9%),PCV-2 30份(93.4%),并呈现双重和三重感染的现象,3份样品为三重感染(9.4%)。由于本次样品收集于养殖小区,存在圈舍间病原的差异,所以检测结果也呈现多样性,但也可以看出养殖小区存在 PPV、PRV和PCV-2的感染,要及早采取措施予以净化。
同时我们用单项PCR对样品进行了检测,符合率达99%以上,有3份病猪淋巴组织样品出现大量杂带,难以通过多重PCR判定,提示需要对建立的方法进一步完善。

图1 最佳PPV PCR退火温度Fig.1 Optimal annealing temperature in PPV PCR
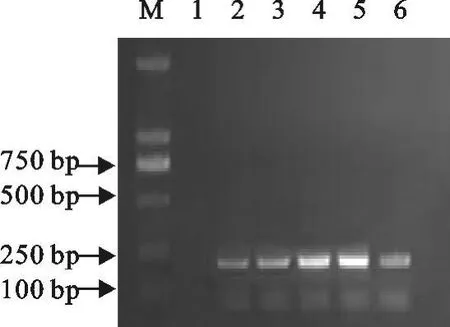
图2 最佳PRV PCR退火温度Fig.2 Optimal annealing temperature in PRV PCR

图3 最佳PCV-2 PCR退火温度Fig.3 Optimal annealing temperature in PCV-2 PCR
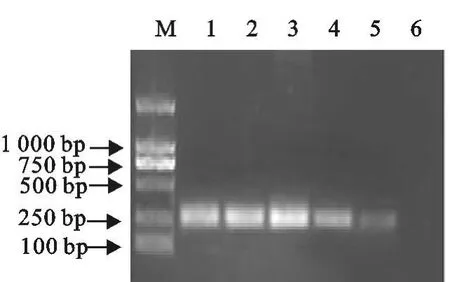
图4 PPV反应敏感性Fig.4 Sensitivity of PRV PCR

图5 PPV反应敏感性Fig.5 Sensitivity of PRV PCR

图6 PCV-2反应敏感性Fig.6 Sensitivity of PCV-2 PCR

图7 PPV+PRV双重PCRFig.7 Duplex PCR for PPV+PRV detection

图8 PRV+PCV-2双重PCRFig.8 Duplex PCR for PRV+PCV-2 detection
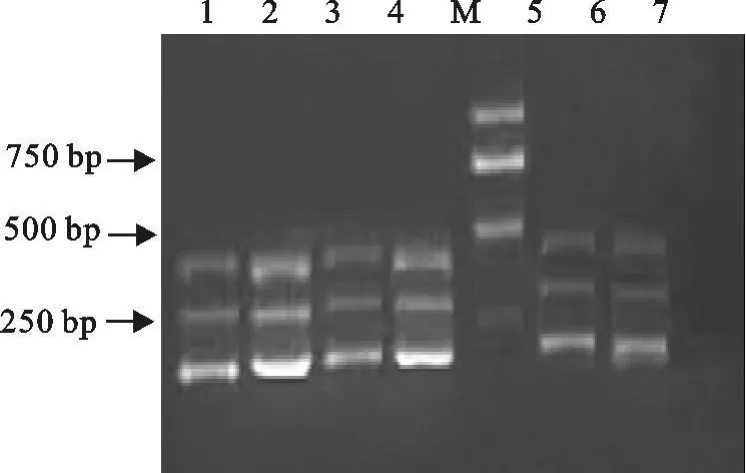
图9 多重PCR最佳退火温度Fig.9 Optimal annealing temperature for multiplex PCR

图10 多重PCR的敏感性试验Fig.10 Sensitivity of multiple PCR
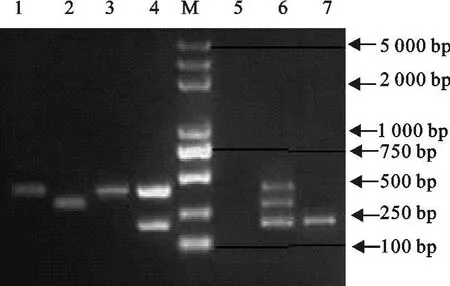
图11 多重PCR检测的部分阳性样品Fig.11 The positive samples by multiple PCR
3 讨论
繁殖和呼吸系统疾病会引起养猪业的巨大损失,发病机理复杂[15],PPV、PRV和PCV-2三种病毒诱发的疾病有相同的诱因,在典型的密集型饲养猪的环境下,同时感染两种或两种以上病毒病原的情况也很普遍,会导致更多严重临床综合症状和机能障碍,所以难以明确的诊断多重感染,尤其对于PPV、PRV、PCV-2更是如此,因为它们有一些共同的临床症状[16-17]。本实验所建立的多重PCR,能够快速、准确的鉴定诊断及区分PPV、PRV、PCV-2三种病毒在临床中的单个或多种疾病的混合感染。当在同一个反应体系中存在两对或两对以上的引物时,PCR的敏感性会降低[12]。我们建立的多重PCR方法特异性和敏感性较好,对PCR产物测序表明获得了相应病毒的目的片段,序列完全正确。建立的PPV、PRV和PCV2的多重PCR检测方法,对临床上进行这三种疾病的鉴别诊断和混合感染的检测都具有实用价值。但也必须看到,多重PCR的检测敏感性相当或十倍低于传统PCR[18],所以在后续研究中还需对方法的敏感性进行提高。
单项PCR是多重PCR的基础,其退火温度,体系中各因素量的范围和比例都与多重PCR所确定的优化条件密切相关。只有当三个单项PCR退火温度一致时,才能进行下面的步骤。所以,在第一步设计引物的时候,就要将扩增3个目的条带的引物所决定的Tm限制在不超过2℃差额的范围中,这样才可以在同一体系中进行且尽量是扩增的最优状态,也才能避免非特异性反应的发生。本试验设计的3对引物的GC含量和变性温度Tm值相近这就保证了在相同的退火温度下目的片段都能得到有效扩增 ,在大量的单项PCR温度梯度试验验证后,证实3对引物所决定的最佳Tm的实际值为58℃~60℃,第二步进行两重PCR各个目的基因的引物体积范围和比例的确定,本试验的引物物质量浓度是10 μ mol/L,以体积为调整的单位。确定了PPV和PRV两重PCR最优状态中的引物体积分别是 0.5 μL和0.6 μL,PRV和PCV-2的两重 PCR最佳引物体积分别是0.5 μL和 0.4 μL。即当 PPV 与PRV 的引物比例为1:1.2,PRV与PCV-2的比例为1:0.8时且引物体积的范围大概为 0.4 μL~0.6 μL时,两重PCR可以达到最佳效果。此结果对有头绪的进行后面的多重PCR也奠定了一个坚实的基础。由于三重PCR的体系中加入了更多的引物,其退火温度有微妙的变化,所以需要重新确定。反复进行温度梯度多重PCR试验后,确定其最佳退火温度为60℃,后面的工作即是当体系在60℃时,确定各自引物的体积。建立多重PCR最后一步重要的步骤是调整体系中各自引物的量。在两重PCR所确定的体积范围和比例的基础上,经过大量的摸索试验后,当PPV、PRV和PCV-2的引物体积分别是0.4 、0.6 、0.5 μL,3对引物比例为1∶1.2∶0.96的时候,可以扩增出病毒,且扩增的效果最优。本试验所扩增的目的条带大小分别为295、213、403 bp,可以很清晰的在电泳图中区别开来,且特异性很好,PRV扩增中比单项PCR的敏感性下降了10倍,其原因可能与多对引物更容易形成二聚体而干扰了异性扩增有关,但是也达到了pg级,显示出有很好的临床应用的能力。从对临床样品的检测中发现,建立的方法可以用于临床上对PPV、PRV和PCV-2检测及混合感染的诊断,从本次结果看,PCV-2仍是猪群中感染率较高的病原,对猪群健康的危害较大,应引起足够的重视。
[1]杨鹿金,平益忠.猪繁殖障碍性疾病的诊治[J].中国畜禽种业,2010(3):106-107.
[2]刘玉勃,于浩,宫照峰等.猪繁殖障碍性疾病的鉴别诊断[J].畜牧市场,2008(11):16-17.
[3]赖国华,熊志芬,李自萍.猪附红细胞体、细小病毒和伪狂犬混合感染调查[J].云南畜牧兽医,2008(2):12.
[4]陈洁,金尔光,郭一,等.猪圆环病毒感染相关疾病及防控措施[J].现代农业科技,2010(21):363-364.
[5]Lakshmi V,Sudha T,Rakhi D,et al.Application of polymerase chain reaction to detect HIV-1 DNA in pools of dried blood spots[J].Indian Journal Of Microbiology,2011,51(2):147-152.
[6]Uhrlass S,Kruger C,Herrmann J,et al.Molecular biological direct detection of dermatophytes by polymerase chain reaction in the dermatocological routine dagnosis-a prospective study over 32 months[J].Journal Der Deutschen Dermatologischen Gesellschaft,2011,4(9):226-226.
[7]Aarthi P,Harini R,Sowmiya M,,et al.Identification of bacteria in culture negative and polymerase chain reaction(PCR)positive intraocularspecimen from patients with infectious endopthalmitis[J].Journal of Microbiological Methods.2011,4,85(1):47-52.
[8]Ciofi C,Tzika A C,Natali C,et al.Development of a multiplex PCR assay for fine-scale population genetic analy sis of the Komodo monitor Varanus komodoensis based on 18 polymorphic microsatellite loci[J].Molecular Ecology Resources,2011,5,11(3):550-556.
[9]Cao Da-Long,Ye Ding-Wei,Zhang Hai-Liang,et al.Multiplex Model of Combining Gene-Based,Protein-Based,and M etabolite-Based With Positive and Negative Markers in Urine for the Early Diagnosis of Prostate Cancer[J].Prostate.2011,5,71(7):700-710.
[10]Guichoux E,Lagache L,Wagner S,et al.Two highly validated multiplexes(12-plex and 8-plex)for species delimitation and parentage analysis in oaks(Quercus spp.)[J].Molecular Ecology Resources,2010,5,11(3):578-585.
[11]Hada H,Sekine K T.A diagnostic multiplex polymerase chain reaction method to identify Japanese internal apple-feeding Lepidopteran pests:Grapholita molesta,G rapholita dimo rpha(Lepidoptera:Tortricidae),and Carposina sasakii(Lepidoptera:Carposinidae)[J].T ropical Biomedicine,2011,28(1):171-174.
[12]Jeyasekaran G,Raj K T,Shakila R J,et al.Multiplex polymerase chain reaction-based assay for the specific detection of toxin-producing Vibrio cholerae in fish and fishery products[J].Applied Microbiology and Biotechnology,2011,5,90(3):1111-1118.
[13]Chienjin Huang,Jui-Jung Hung,Ching-Ying Wu,et al.Multiplex PCR for rapid detection of pseudo rabies virus,porcineparvovirus and porcine circoviruses[J].J Vet Microbiol,2004,101(3):209-214.
[14]张桂红.目前猪常见病发病特点与鉴别诊断要点[J].中国动物保健,2008,6(11):43-44.
[15]Kim J,Chae C.Concurrent presence of porcine circovirus type 2 and porcine parvovirus in retrospective cases of exudative epidermitis in pigs[J].Vet J,2008,167(1):104-106.
[16]Chen C M,Cui S J.Detection of po rcine parvovirus by loopmediated isothermal amplification[J].Journal of Virological Methods,2009,155(2):122-125.
[17]Ljiljana M,Ruzica A,Sonja R,et al.Production and characterization of monoclonal antibodies specific for pseudorabies virus[J].ACT A Veterinaria-Beograd,2008,57(5):441-451.
[18]Jacques B,Stefanie J,Thomas H,et al.A simple and rapid single-step multiplex RT-PCR to detect norovirus,astrovirus and adenovirus in clinical stool samples[J].Journal of Virological Methods,2004,118:49-59.
Establishment and Application of a Multiplex PCR for Detecting Porcine Parvovirus,Pseudorabies Virus and Porcine circovirus type2
SUN Li,GUO Kang-kang,WANG Jing,LIU Wei,CAO Wei-wei,L¨U Qi-zhuang,ZHANG Yan-ming
(College of Veterinary Medicine,Northwest A&F University,Y angling,Shaanxi,712100,China)
A multiplex polymerase chain reaction(PCR)-based assay was developed and evaluated for its ability to simultaneously detect multiple viral infections of swine.Specific primers for detecting porcine parvovirus(PPV),pseudorabies virus(PRV)and porcine circovirus type 2(PCV-2)were designed according to the full sequences of each virus strain obtained from GenBank.A multiplex PCR was established to detect PPV,PRV and PCV-2 by optimizing the PCR programs.286 blood and tissues samples collected in clinical healthy pig population and disease pigs of pig farms in Shaanxi were detected using developed multiplex PCR for screening PPV,PRV and PCV-2.The results indicated that the PCV-2 was an important pathogen in clinical healthy pig population,the PRV and PPV also could be found in individual pig farms,so it was important issue for getting rid of the infected pigs from normal pig population.It was serous of PRV+PCV-2 combined infection in diseased pigs,PPV+PRV+PCV-2 combined infection also were detected in diseased pigs.The detected results of multiplex PCR were more than 99%consistent with special single PCR.This developed novel multiplex PCRwill be a tool for detecting PPV,PRV and PCV-2 in clinical samples and disease diagnosis.
Porcine parvovirus;Porcine pseudorabies virus;Porcine circovirus type2;multiplex PCR
Q789;S858.28
A
1007-5038(2011)08-0025-07
2011-04-15
陕西省重大科技攻关项目(2006kz07-G2)
孙 黎(1986-),女,陕西户县人,硕士研究生,主要从事分子病原学与免疫学研究。

