抗氯霉素单克隆抗体的制备及其化学发光酶免疫法的建立*
张启模,杨 姝,马 玲,马玉媛,郭 逸,章金刚*,吴健敏1,*
(1.广西大学动物科学技术学院,广西南宁 530005;2.军事医学科学院野战输血研究所,国家生物医学分析中心病毒安全检测实验室,北京 100850;3广西兽医研究所,广西南宁 530001)
抗氯霉素单克隆抗体的制备及其化学发光酶免疫法的建立*
张启模1,2,3,杨 姝2,马 玲3,马玉媛2,郭 逸2,章金刚2*,吴健敏1,3*
(1.广西大学动物科学技术学院,广西南宁 530005;2.军事医学科学院野战输血研究所,国家生物医学分析中心病毒安全检测实验室,北京 100850;3广西兽医研究所,广西南宁 530001)
以人工合成的氯霉素-牛血清白蛋白(CAP-HS-BSA)免疫Balb/c小鼠,应用杂交瘤技术获得了一株分泌抗氯霉素单克隆抗体(CAP-McAb)的杂交瘤细胞5D7,并对其进行效价、亲和力和特异性测定。结果显示,其分泌的抗体亚类为IgG1,间接ELISA检测细胞培养上清效价为1∶512,诱生的腹水经纯化后效价为1∶2×105,亲和常数为3.6×108L/mol;应用上述单抗建立的检测氯霉素的化学发光酶免疫分析法(ci-CLIA),其检测范围为 0.001 μg/L ~ 10 μg/L,检出限达 0.0025 μg/L,IC50为39.6 μg/L,且与 L-苯丙氨酸、L-酪氨酸、青霉素、四环素、庆大霉素等的交叉反应率均小于0.01%,可满足我国对水产品中氯霉素残留检测的要求。
氯霉素;单克隆抗体;化学发光免疫分析
*通讯作者
氯霉素(Chloramphenicol,CAP)作为一种高效广谱的抗菌药,曾广泛地应用于国内外养殖业中。但是,随着对氯霉素临床应用的深入研究[1],发现长期微量摄入氯霉素,不仅使沙门氏菌、大肠埃希菌等产生耐药性,还会引起机体正常菌群失调,易患再生障碍性贫血和骨髓抑制等相关疾病,严重危害着人类的健康[2-3]。
近年来,世界上许多国家限制甚至禁止氯霉素用于食用动物中,并规定了畜产品中氯霉素的最高残留[4]。美国、欧盟、日本等国家都规定禁止氯霉素用于食用动物,而且在出口产品中不得检出氯霉素。我国农业部在2002年发布的第235号公告明文规定氯霉素及其盐、酯(包括琥珀氯霉素)禁止用于所有食用动物。
鉴于氯霉素的严重毒副作用及由其引发的国际贸易争端,氯霉素残留快速检测方法的研究受到越来越多的关注。目前,氯霉素残留的检测方法主要有微生物法、理化方法和免疫分析方法。微生物法[5-6]虽方法简单、价格低廉,但灵敏度较低、特异性较差;而理化方法[7-9]虽在灵敏度和特异性方面有所提高,但都存在仪器昂贵、样品前处理复杂、分析速度慢、难进行大量样品的测定等缺点,限制了它们的应用[10]。而免疫分析法[11-13]具有灵敏度高、设备要求低、操作简便等优点,适用于氯霉素残留检测中大量样品的筛选。在所有的免疫检测技术中,化学发光免疫分析(CLIA)[14-15]以其无辐射、灵敏度高、特异性好、标记物有效期长并可实现全自动化检测等优点,越来越多地用于临床样品的高通量筛选,为食品中残留药物分析检测和科学研究提供了一种痕量或超痕量的非放射免疫分析技术,在注重灵敏度的方法中有逐步取代放射免疫和普通ELISA的趋势,是免疫分析的重要发展方向[16-17]。
目前国内虽有相关检测氯霉素方法的报道[18],但多采用多克隆抗体用于检测,其在灵敏度和特异性等方面很难达到人们对兽药残留检测越来越高的要求。本研究制备了灵敏度高、特异性强的单克隆抗体并建立了检测氯霉素的化学发光酶免疫分析方法。
1 材料与方法
1.1 材料
Sp2/0骨髓瘤细胞由国家生物医学分析中心病毒安全检测实验室保存;6周龄~8周龄的雌性Balb/c小鼠由军事医学科学院实验动物中心提供;免疫球蛋白亚类检测试剂盒(间接ELISA)购于美国Southern Biotech公司;氯霉素-牛血清白蛋白(CAP-HS-BSA),氯霉素-卵清蛋白(CAP-HSOVA)购于珠海英平科技有限公司;BCA蛋白检测试剂盒购自Thermo Scientific公司;CAP标准品购自德国Dr.Ehrenstorfer;HRP-羊抗鼠IgG购自美国Santa Cruz公司;发光底物液购自湖州英创生物科技有限公司;KTA蛋白纯化仪与rProtein A SepharoseTMFast Flow介质购自GE公司;Centro LB960微孔板式发光仪购自 Berthold公司;Opti-PlateTM化学发光板购自PerkinElmer公司;其他试剂均购自军事医学科学院器材处。
1.2 方法
1.2.1 氯霉素单克隆抗体的制备及纯化 选择6周龄~8周龄的雌性Balb/c小鼠,以CAP-HS-BSA作为免疫抗原免疫小鼠,按常规方法进行细胞融合与阳性株筛选[19]。对所筛选出的阳性细胞株采用有限稀释法连续克隆3次,经检测后进行扩大培养、鉴定、冻存和建株。细胞株经扩大培养后采用体外诱生法制备腹水,用硫酸铵盐析的方法初步纯化氯霉素单克隆抗体(CAP-McAb)。依照rProteinA介质说明书,将粗纯后的蛋白用含3 mol/L NaCl的20 mmol/L PBS缓冲液透析,用 ÄKTA purifier亲和层析纯化抗体,SDS-PAGE分析纯化McAb的纯度及分子质量,并用BCA蛋白检测试剂盒测定蛋白浓度。
1.2.2 McAb免疫学特性鉴定
1.2.2.1杂交瘤细胞培养上清及亲和层析纯化后的腹水抗体效价的测定 采用间接ELISA方法[19],测定杂交瘤细胞培养上清及纯化后的腹水中CAPMcAb的效价。
1.2.2.2 McAb的亚类鉴定 采用美国Southern Biotech公司的免疫球蛋白亚类检测试剂盒对纯化后的抗体进行亚类鉴定,具体操作参照试剂盒说明。1.2.2.3 McAb亲和性测定 采用非竞争酶免疫分析法[20]测定亲和常数(Ka)。用浓度为0.6、0.3、0.15 、0.075 μg/mL 的 CAP-HS-OVA 包被,加入倍比稀释的 CAP-McAb,再加入 1∶5 000稀释的HRP标记山羊抗小鼠IgG,TMB底物显色液显色后测定OD值。以CAP-McAb浓度[Ab]为横坐标,以OD值为纵坐标,绘制4条S形曲线。计算不同抗原稀释度下的[Ab]-OD曲线上1/2ODmax时对应的抗体浓度。按照公式:Ka=(n-1)/2(n[Ab']-[Ab]t),计算Ka平均值值。
1.2.3 CAP-McAb化学发光酶免疫法的建立
1.2.3.1 抗原最佳包被浓度及CAP-McAb最佳工作效价的确定 采用方阵滴定试验确定抗原抗体的最适工作浓度[21]。具体步骤如下:用4、2、1 μg/mL的CAP-HS-OVA按100 μL/孔进行包被,4℃孵育过夜;次日洗涤后用1%BSA的PBST进行封闭后洗涤;再将CAP-McAb(2 mg/mL)梯度稀释(按照1∶500、1∶1 000、1∶2 000、1∶4 000进行稀释),按100 μL/孔加入酶标板进行方阵滴定试验,室温孵育45 min;洗涤加入1∶2 000稀释的H RP-羊抗鼠IgG各 100 μL/孔,室温孵育45 min;洗涤后 ,加入 TMB底物显色液后读数;选择OD值在1.0所对应的抗原和抗体稀释度作为最适工作浓度。
1.2.3.2 HRP-羊抗鼠IgG最佳工作浓度的确定按上述确定的最佳抗原工作浓度进行包被后,以最佳抗体工作浓度加入CAP-McAb,然后加入 1∶1 000、1∶2 000、1∶4 000和1∶8 000稀释的 HRP-羊抗鼠IgG,根据曲线相关系数和IC50选择HRP-羊抗鼠IgG的最佳工作浓度。
1.2.3.3 半抑制常数IC50的测定 采用间接竞争化学发光酶免疫法[21]:以1.2.3.1测定值作为反应的最适抗原包被浓度和抗体工作效价。以 CAPHS-OVA包被发光检测板,依次加入梯度稀释的CAP 系列标准溶液(0 、0.001、0.01、0.1、1 、10 ng/mL,每个浓度3次重复)和最适工作效价的CAPMcAb各 50μL/孔,室温孵育 45 min;PBST 洗涤3次,加入1.2.3.2确定工作浓度的HRP-羊抗鼠IgG 50μL/孔,室温孵育45 min;洗涤后,加入发光液A/B各50 μL/孔,稳定2 min后于发光仪中读数,检测时间为1s。记录各测定值,绘制曲线计算半抑制常数。
1.2.4 特异性测定 以得到的反应体系测定CAP结构类似物和一些常见的抗生素(L-苯丙氨酸、L-酪氨酸、青霉素、四环素、庆大霉素)的半抑制浓度,以氯霉素半抑制浓度与其他药物半抑制浓度之比作为交叉反应率,计算它们之间的交叉反应性。
2 结果
2.1 细胞融合与杂交瘤细胞的筛选结果
间接ELISA测定免疫后的5只小鼠血清抗体效价均达到4×103,其中5号小鼠的血清效价最高,作细胞融合用。融合后10 d观察融合效果,接种的6块细胞培养板中,融合率为14.3%。间接ELISA方法筛选后获得了1株分泌抗CAP的强阳性(OD值>2.5)杂交瘤细胞株,经3次克隆后,细胞生长状态良好,克隆阳性率达100%。连续培养6个月以上,细胞生长良好,冻存后复苏,仍能保持稳定的抗体分泌能力,命名为5D7。
2.2 CAP-McAb的亚类鉴定及效价测定结果
按照美国Southern Biotech公司的免疫球蛋白亚类检测试剂盒方法测定5D7亚类为IgG1,κ链。用间接ELISA方法测定培养上清效价达到1∶512,亲和层析纯化后的腹水效价达到1∶2×105。
2.3 CAP-McAb的纯化与鉴定结果
使用 ÄKTA purifier进行监测,将硫酸铵粗纯后的5D7腹水通过装有rProtein A介质的XK层析柱。参照rProteinA介质说明,进行亲和层析纯化抗体。共收集到21 mL蛋白液,经BCA蛋白检测试剂盒测定McAb浓度为0.736 mg/mL。将获得的纯化抗体进行SDS-PAGE电泳。纯化后经变性方法处理的抗体在SDS-PAGE中存在2条带,分别为重链和轻链,各为50 kDa和25 kDa(图 1a);经非变性方法处理的抗体在SDS-PAGE中存在1条带,分子量在150 kDa左右(图1b)。电泳图中无明显杂蛋白,表明蛋白纯度达到了电泳纯的要求。
2.4 CAP-McAb亲和性测定结果
采用非竞争酶免疫分析测定亲和常数(图2)。计算不同抗原浓度下的[Ab]-OD曲线上1/2ODmax时对应的抗体浓度。按照公式计算得出 CAPMcAb的亲和常数Ka为3.6×108L/mol。
2.5 最佳抗原包被浓度及CAP-McAb工作效价的确定
通过方阵滴定试验筛选出最佳抗原包被浓度为2 μg/mL,CAP-McAb工作效价为1∶2 000(表1)。

图1 rProtein A介质纯化后CAP-M cAb的SDS-PAGE图Fig.1 SDS-PAGE analysis of CAP-M cAb purified on rProtein A sepharose Fast Flow
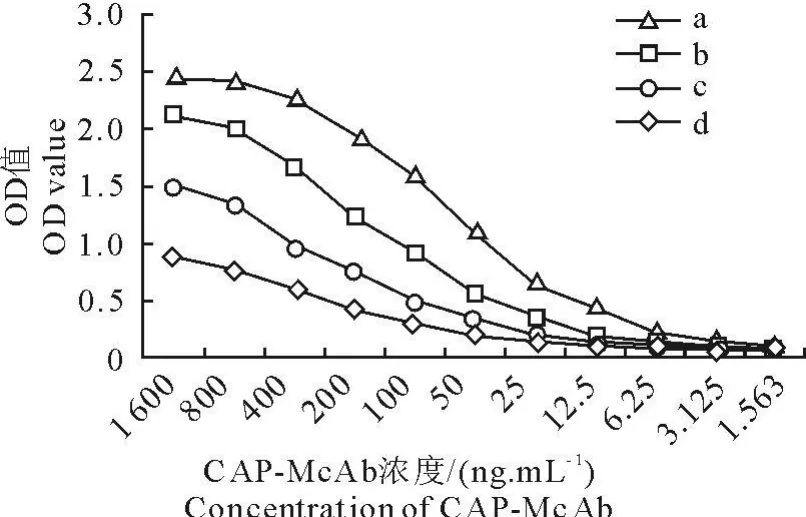
图2 CAP-McAb的亲和曲线图Fig.2 EIA curve for CAP M cAb
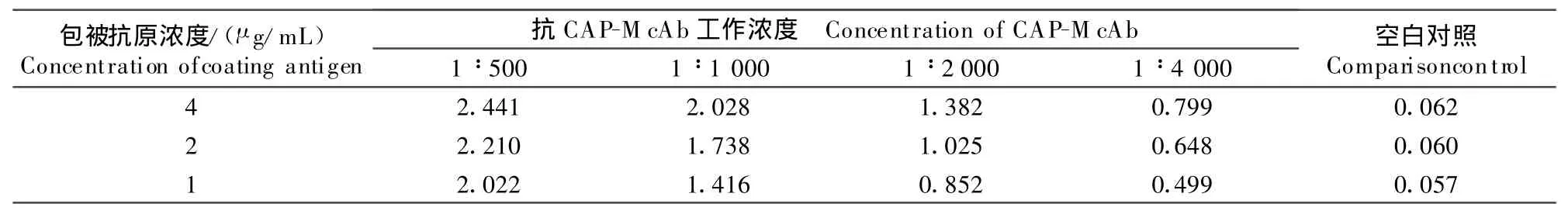
表1 包被抗原和抗体最适工作浓度方阵试验结果Table 1 Results of optimal working concentration on coating antigen and antibody
2.6 HRP-羊抗鼠IgG最佳工作浓度的确定
按确定的最佳抗原抗体工作浓度测定HRP-羊抗鼠IgG工作浓度,得到二抗稀释倍数与相对发光强度的曲线图(图3)。从图中可以看出:采用1∶1 000稀释二抗时,相对发光强度(Relative Light U-nit,RLU)过高,减小了不同浓度CAP标准品之间数值的差异,容易造成试验误差;当1∶8 000稀释二抗时,RLU下降迅速;而1∶2 000和1∶4 000稀释时,数值均匀,考虑到材料成本问题,确定HRP-羊抗鼠IgG最佳工作稀释度为1∶4 000。
2.7 CAP-McAb化学发光酶免疫法与标准曲线的建立
以氯霉素标准品浓度的对数值为横坐标,以各标准品发光值与0标准品发光值的比值即(ACAP/A0)%为纵坐标,绘制竞争曲线(图4)。得到的曲线回归方程为y=-9.5268x+65.22,在0.001~10 μg/L之间有良好的线性关系,R=0.9945,由曲线方程算出氯霉素单抗5D7的IC50为 39.6μg/L,检测线性范围为 0.001~10 μg/L,检出限(90%RLU/RLU0对应的浓度)为 0.002 5 μg/L[14]。
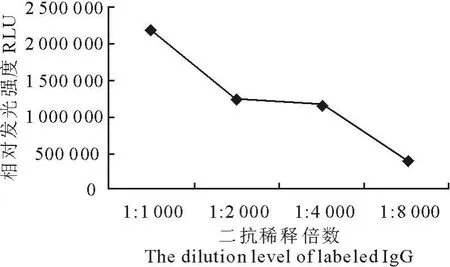
图3 HRP-羊抗鼠IgG最佳工作浓度测定结果Fig.3 Results of optimal working concentration for HRP conjugated Goat Anti-M ouse IgG
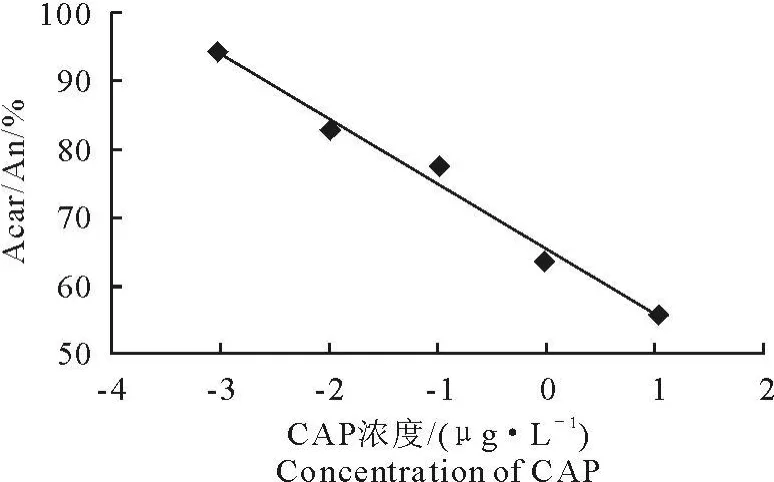
图4 CAP-McAb的竞争曲线图Fig.4 Standard inhibition curve of CAP-McAb
2.7 CAP-McAb化学发光酶免疫法检测特异性的鉴定
配制 L-苯丙氨酸、L-酪氨酸、青霉素、四环素、庆大霉素等的标准样品,在相同条件下分别测定其标准曲线IC50值及交叉反应率。结果发现,抗CAPMcAb与 L-苯丙氨酸、L-酪氨酸、青霉素、四环素、庆大霉素的交叉反应率均小于0.01%,说明该抗体与CAP结构类似物及常见抗生素无交叉反应,以抗CAP-McAb建立的化学发光酶免疫法特异性较好。
3 讨论
氯霉素作为小分子物质(MW=332),属于半抗原,无免疫原性,必须采用载体蛋白偶联的方法得到人工抗原来获得免疫原性。目前,有很多文献报道了利用化学方法得到载体蛋白与小分子物质的偶联物,其中以混合酸酐法得到的蛋白偶联物具有较好的免疫原性,得到广泛地应用[22]。我们获得了由此方法得到的蛋白偶联物CAP-HS-BSA和CAP-HSOVA,并以CAP-HS-BSA作为免疫抗原,以CAPHS-OVA作为检测抗原,用来筛选在细胞融合后只分泌抗CAP的杂交瘤细胞。
细胞融合后在单集落细胞筛选的过程中,本研究采用了间接ELISA方法选择OD值高的集落作为评价分泌高亲和力抗体的标准。ELISA检测时OD值的高低,主要由抗体本身的亲和性决定[23]。最终我们得到的5D7-McAb的亲和常数为3.6×108L/moL,符合James W G[24]的结论,亲和常数在107~1012时,说明抗体具有较高的亲和力。
此外,为了避免因小鼠腹水中一些成分的存在而造成的非特异性结合,我们在饱和硫酸铵方法粗纯腹水的基础上,进行了rProteinA介质的亲和层析,纯化后得到的单克隆抗体达到电泳纯,为后期单抗各项指标的评价及检测方法的建立奠定了基础。
本试验利用所制备的CAP-McAb建立了化学发光酶免疫法,并通过优化试验条件,使相关系数达到0.994 5,可用于实际检测。本方法检测范围为0.001 μg/L ~10 μg/L,检出限为 0.002 5 μg/L,与文献报道的检测范围和检测限相近[25]。该方法特异性较好,与CAP结构类似物和一些常见的抗生素均无交叉反应,可进一步用于检测水产品中氯霉素残留,满足世界上大多数国家对水产品中CAP残留检测的要求。
[1]Feder H M Jr,Osier C,M aderazo E G.Chloramphenicol:A review of its use in clinical practice[J].Rev Infect Dis,1981,3(3):479-491.
[2]高 林.氯霉素的不良反应及其残留检测方法研究进展[J].动物医学进展,2010,31(4):90-95.
[3]吕玄文,党 志,杨 琛.淡水养殖鱼体中氯霉素的安全性研究[J].环境科学研究,2008,21(4):185-189.
[4]吴永宁,邵 兵,沈建忠.兽药残留检测与监控技术[M].北京:化学工业出版社,2007:37-85.
[5]Okerman L,Hoof J V,Debeuckllaere W.Evaluation of the Europen four-plate Test as a tool of screening antibiotic residues in meat samples fromretail outlets[J].Aoac Int,1998,81(1):51-56.
[6]伍金娥,范盛先,王玉莲.动物组织中抗菌药物残留的微生物学快速筛选法研究[J].华中农业大学学报,2006,25(6):645-649.
[7]Chen Huaixia,Hui Chena,Jun Yinga.Dispersive liquid-liquid microextraction followed by high-performance liquid chromatography as an efficient and sensitive technique for simultaneous determination of chloramphenicol and thiamphenicol in honey[J].Analy tica Chimica Acta,2009,632(1):80-85.
[8]Cronly M,Behan P,Foley B.Rapid multi-class multi-residue method for the confirmation of chloramphenicol and eleven nitroimidazoles in milk and honey by liquid chromatog raphy-tandem mass spectrometry(LC-MS)[J].Food Addit Contam,2010,27(9):1233-1246.
[9]Rodziewicz L,Zawadzkaa I.Rapid determination of chloramphenicol residues in milk powder by liquid chromatography-elektrospray ionization tandem mass spectrometry[J].T alanta,2008,75(3):846-850.
[10]Tajik H,Malekinejad H,Razavi-Rouhani S M.Chloramphenicol residues in chicken liver,kidney and muscle:A comparison among the antibacterial residues monitoring methods of Four Plate Test,ELISA and HP LC[J].Food Chem Tocicol,2010,48(7):2464-2468.
[11]Scortichini G,Annunziata L,Haouet M N.ELISA qualitative Screening of chloramphenicol in muscle,eggs,honey s and milk:method validation according to the Commission Decision 2002/657/Ec criteria[J].Anal Chem Acta,2005,535(1):43-48.
[12]Wang Li,Zhang Yan,Gao Xiang.Determination of Chloramphenicol Residues in Milk by Enzyme-Linked Immunosorbent Assay:Improvement by Biotin Streptavidin-Amplified System[J].J Ag ric Food Chem,2010,58(6):3265-3270.
[13]陈 婷.酶联免疫分析法及其在兽药残留检测中的应用[J].福建畜牧兽医,2008,30(5):30-32.
[14]Wu A H B.A selected histo ry future of immunoassay development and applications in clinical chemistry[J].Clin Chim Acta,2006,369(2):119-124.
[15]Zhang Suxia,Zhang Zhen,Shi Weimin.Development of a Chemiluminescent ELISA for Determining Chloramphenicol in Chicken M uscle[J].J Ag ric Food Chem,2006,54(16):5718–5722
[16]林金明,赵丽霞,王 栩.化学发光免疫分析[M].化学工业出版社,2008:194-209.
[17]魏光伟,余永鹏,魏文康,罗胜军.化学发光免疫分析技术及其应用研究进展[J].动物医学进展,2010,31(3):97-102.
[18]Lin Si,Han Shi-quan,Liu Yi-bing.Chemiluminescence immunoassay for chloramphenicol[J].Anal Bioanal Chem,2005,382(5):1250-1255.
[19]Zola Heddy.单克隆抗体技术手册[M].周宗安,等,译.南京:南京大学出版社,1991:52-107.
[20]Beatty J D,Beatty B G,Vlahos W G.Measure of monoclonal antibody affinity by non-competitive enzyme immunoassay[J].J Immunol Methods,1987,100(1):173-197.
[21]杨利国,胡少昶,魏平华.酶免疫测定技术[M].江苏南京:南京大学出版社,1998:381-398.
[22]杨小姣,张建新,高志贤.用于检测氯霉素的免疫原和包被原的制备[J].解放军预防医学杂志,2007,25(2):87-90.
[23]Buther J E,Feldbush T L,McGivern P.The Enzyme-linked immunosobent assay:a measure of antibody concertration or affinity[J].Immunochemistry,1978,15(2):131.
[24]James W G.M onoclonal antibodies:principles and practice[M].Academic Press,1983:142-147.
[25]胥传来,彭池方,郝 凯.化学发光酶免疫法测定水产品中残留氯霉素[J].分析化学,2005,33(12):1809.
Preparation of the Monoclonal Antibodies Against Chloramphenicol and Establishment of Chemiluminescence Enzyme Immunoassay for Determination of Chloramphenicol
ZHANG Qi-mo1,2,3,YANG Shu2,MA Ling3,MA Yu-yuan2,GUO Yi2,ZHANG Jin-gang2,WU Jian-min3
(1.College of Animal Science and Technology,Guangxi University,N anning,Guang xi,530005,China;
2.Laboratory f or Viral Saf ety of National Centre of Biomedical Analy sis,Institute of Transfusion Medicine,
Academy of Military Medical Sciences,Beijing100850,China;3.Guang xi Veterinary Institute,Nanning,Guangxi,530001,China)
A hybridona cell line named 5D7 secreting monoclonal antibody against chloramphenicol(CAP)was established,after immunization of Balb/c mice with synthesized CAP-HS-BSA.Here,we characterized the immunological traits of the McAb such as titer,affinity and specificity.T he results showd that the ELISA titers of ascites and cell supernatant were 1∶1.2×105and 1∶512,respecively.The affinity constant(Ka)was 3.6×108L/mol.The McAb was applicated to the chemiluminescence immunoassay(CLIA),and has no cross-reactivity with other antibiotics.The assay showed good linearity between 0.001to 10 μg/L.T he McAb against CAP will be used for the development of chemiluminescence immunoassay for CAP.
chloramphenicol;monoclonal antibodies;chemiluminescence immunoassay
S859.796
A
1007-5038(2011)08-0012-05
2011-01-11
广西壮族自治区科技厅基本科研业务专项(桂兽研专项08-4)
张启模(1984-),男,山东威海人,硕士研究生,主要从事分子病毒学研究。张启模与杨姝为共同第一作者。

