毕赤酵母工程菌株表达人溶菌酶-鲎素融合蛋白发酵条件的优化
高 宇,赵红蕾,冯 新,刁昱文,刘珊珊,李林溪,顾敬敏,韩文瑜,雷连成
(1.吉林大学畜牧兽医学院,吉林长春 130062)
毕赤酵母工程菌株表达人溶菌酶-鲎素融合蛋白发酵条件的优化
高 宇,赵红蕾,冯 新,刁昱文,刘珊珊,李林溪,顾敬敏,韩文瑜,雷连成*
(1.吉林大学畜牧兽医学院,吉林长春 130062)
能分泌表达重组人溶菌酶-鲎素融合蛋白的巴斯德毕赤酵母(Pichia pastoris)工程菌(X33/pPICZα A-human lysozyme-TachyplesinⅠ构建的)。除了基因本身内在特性外,表达条件对外源基因的表达量也有着极显著的影响。本文在摇瓶水平上通过发酵液起始pH、甲醇诱导浓度、诱导时间这3个因素进行表达条件优化。通过生长曲线,Bradford检测以及平板扩散试验分析,获得摇瓶发酵表达人溶菌酶-鲎素融合蛋白的最佳条件为发酵液初始pH 5.0,甲醇诱导浓度为2.0%,诱导时间为72 h;Bradford检测法分析显示表达量最高,平板扩散试验显示融合蛋白对金黄色葡萄球菌(ATCC25923)抑菌能力最明显,为进一步大规模发酵表达人溶菌酶-鲎素融合蛋白奠定了基础。
毕赤酵母;人溶菌酶-鲎素融合蛋白;表达条件;优化
*通讯作者
抗生素的滥用不仅导致了动物性食品药物残留等公共卫生隐患,而且由于耐药性菌株的出现,使细菌性疾病的防治比较困难[1]。Human lysozyme(H LYZ)是一种具有显著效果的抗微生物肽,能够特异性的裂解N-乙酰葡萄糖胺和N-乙酰胞壁酸之间的β-1,4糖苷键,催化水解细胞壁的肽聚糖[2]。人溶菌酶独特的作用机制使其能同时有效地杀伤革兰氏阴性菌和革兰氏阳性菌[3]。由于HLYZ作用机制不同于化学抗菌药物,因而溶菌酶对耐药菌同样具有很好的抑杀作用。与人溶菌酶同属且结构相似的鸡蛋清溶菌酶已经作为洗眼剂和抗炎药物而成功应用于临床。HLYZ人溶菌酶比鸡蛋清溶菌酶具有更高的安全性和更低的免疫原性,所以人溶菌酶的大规模生产及其临床应用是究热点之一[4]。鲎素(TachyplesinⅠ)是从马蹄蟹血细胞中分离的一种具有17个氨基酸的小分子多肽,是马蹄蟹的内源性防御因子之一。鲎素和细菌脂多糖具有很高的亲和力,在低浓度下通过脂多糖介导就能抑制革兰阳性和阴性细菌生长[5]。目前应用的人溶菌酶大部分是从人乳和胎盘中提取的,由于受到来源和规模的限制,存在着人溶菌酶产量不高、质量不稳定且生产成本昂贵等问题。利用基因工程手段生产人溶菌酶不仅对上述问题的解决具有积极作用,也为人溶菌酶的生产提供了一条可选择的途径。
巴斯德毕赤酵母(Pichia pastoris)作为一种高效的外源基因表达系统已经被成功应用于多种外源蛋白的表达[6]。作为一种较为成熟的表达系统,具有原核生物生长快、易工业化的特点,而且能够生长在以甲醇作为单一碳源和能源的培养基上,具有和其他真核表达系统一样的优点,如蛋白质加工、折叠、翻译后修饰等[7,8]。本研究室已成功构建了表达人溶菌酶-鲎素融合蛋白的毕赤酵母X33工程菌株,然而影响外源基因表达的因素很多,因此,为了使外源基因在毕赤酵母中获得尽可能高的表达,非常有必要进行表达条件的优化。我们分别在不同诱导时间、不同的pH和不同的甲醇诱导浓度等方面进行了初步对比研究,得到了一套较完善的在巴斯德毕赤酵母人溶菌素-鲎素中表达基因的优化条件,为今后在发酵罐中大规模生产提供参考。
1 材料与方法
1.1 材料
1.1.1 菌株 巴斯德毕赤酵母表达菌株 X33/pPICZα A-HLYZ-TachyplesinⅠ由吉林大学兽医微生物与免疫实验室构建并保存;金黄色葡萄球菌标准菌株(ATCC25923)由吉林大学兽医微生物与免疫实验室保存。
1.1.2 主要试剂 酵母提取物(Yeast),蛋白胨(Peptone)和葡萄糖(D-glucose)购自Oxide公司;酵母氮源(YNB)为Invitrogen公司产品;基础培养基YPD(Yeast,Peptone and D-glucose)、增菌培养基Buffered minimal glycerol(BMGY)和诱导表达培养基Buffered minimal methanol media(BMMY)配方见Invitrogen公司提供的毕赤酵母操作手册;其余生化试剂均购自北京鼎国生物技术有限公司。
1.2 方法
1.2.1 不同诱导pH值及表达时间对菌体生长和蛋白表达量的影响 将酵母工程菌株 X33/pPICZα A-H LYZ-Tachyplesin Ⅰ接种于3 mL YPD培养基试管中,30℃250 r/min培养过夜。待菌液出现明显浑浊,取 500 μL转接于含50 mL BMGY培养基的 250 mL三角瓶中,在30℃、250 r/min继续培养至OD600=2~6。在室温以5 000 r/min离心5 min,弃上清,收集菌体重悬于用0.1 mol/L的磷酸缓冲液配出 pH分别为4、5、6、7的BMMY培养基中,使OD600值等于1;28℃250 r/min继续培养,每隔24h分别补加甲醇至0.5%,于 24 h、48 h、72 h和96 h各取样1 mL,测量各条件的菌体密度和蛋白表达含量。
1.2.2 诱导阶段甲醇浓度对蛋白表达量的影响
BMMY培养基中分别添加甲醇至终浓度为0.5%、1.0%、1.5%、2.0%、3.0%,pH 为 5.0,其他成分不变,培养72 h后测定蛋白表达量。
1.2.3 粗蛋白的提取 将条件诱导表达阶段所取的发酵液进行离心,条件为在4℃以14 000 r/min离心10 min。由于真核表达载体pPICZα A为分泌型表达载体,所以外源蛋白由信号肽牵引,蛋白酶切割后分泌到发酵液上清中,因此离心所取的上清液即为粗蛋白液。
1.2.4 蛋白表达量检测 蛋白表达量测定方法:Bradford检测法。
1.2.4.1 考马斯亮蓝试剂的配制 准确称取考马斯亮蓝G-250 100 mg溶于50 mL 95%乙醇中,加入100 mL 85%磷酸,用蒸馏水稀释至1 000 mL,中性滤纸过滤。使最终试剂中含0.01%(W/V)考马斯亮蓝G-250,4.7%(W/V)乙醇。
1.2.4.2 标准蛋白质溶液的配制 结晶牛血清白蛋白,预先经凯氏定氮法测定蛋白氮含量(86.13%),根据其纯度以蒸馏水溶解,定容至100 mL,配制成1 mg/mL的蛋白溶液。
1.2.4.3 制定标准曲线以及测量粗蛋白含量 取10支试管,1支留作空白,其余试管按表1中顺序,分别依次加入样品、水和试剂,即用1 mg/mL的标准蛋白质溶液给各试管分别加入0、0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、1.0 mL,然后用蒸馏水补充到1.0 mL。最后在各试管中分别加入5.0 mL考马斯亮蓝G-250试剂,每加完一管,立即在旋涡混合器上混合。加完试剂2~5 min后,即可开始用比色皿在分光光度计上测定各样品在595 nm处的光吸收值OD595。然后以标准蛋白质量(μg)为横坐标,用吸光度值OD595为纵坐标,绘制标准曲线。取发酵上清液,测定方法同上,根据所测定的OD595值,在标准曲线上查出其相当于标准蛋白的量,计算出原样品中的蛋白浓度。
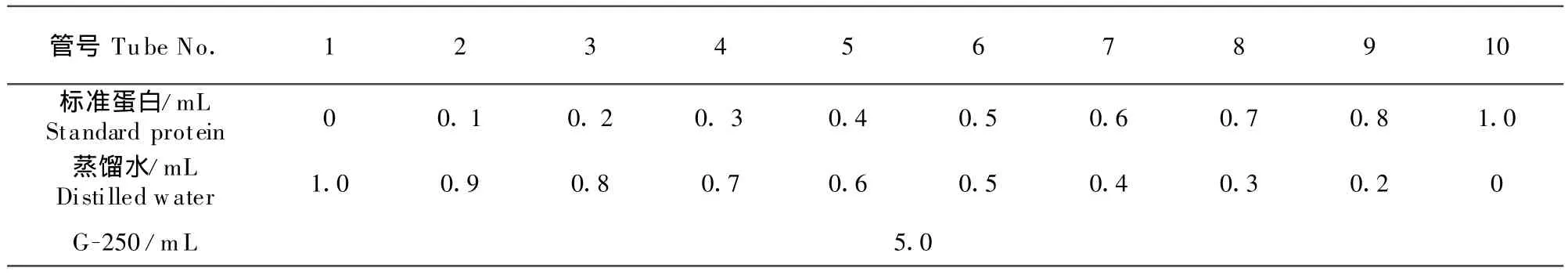
表1 考马斯亮蓝法试验表Table 1 Table of Bradford assay
1.2.5 融合蛋白的抑菌活性验证 采用平板扩散试验来验证融合蛋白的抑菌活性[9]。将过夜培养的金黄色葡萄球菌标准菌株ATCC25923稀释100倍,取 100 μL 涂布 LB 平板,菌数大约为 5×107cfu/mL,然后在平板上均匀打孔,随即加入 100 μL各条件优化时所提取的粗蛋白液,37℃温箱过夜培养,用游标卡尺测量抑菌圈直径大小。
2 结果
2.1 诱导pH及表达时间的优化
不同pH对菌体生长有一定的影响,但是对目的蛋白的表达影响明显。如图1所示,进入诱导表达阶段,酵母菌在pH 5.0时生长迅速,菌量增加最快,培养72 h后菌液OD600达到25.52,96h时发现OD600有所下降,可能开始进入衰亡期。pH为4、6和7时生长速度相对较慢。菌体湿重与蛋白表达成正比,当pH为5,诱导时间为72 h时蛋白表达量最高,达到 861.82 μg/mL,pH 为 4和 7时表达量很低,诱导时间到96 h时蛋白可能被裂解,表达量有下降趋势(图2)。所以在后续发酵生产目的蛋白时,诱导表达72 h即可停止发酵,并且诱导过程中需要用酸或碱不断地调整发酵液的pH,使其保持在5左右,以保证人溶菌酶-鲎素融合蛋白的高效表达。
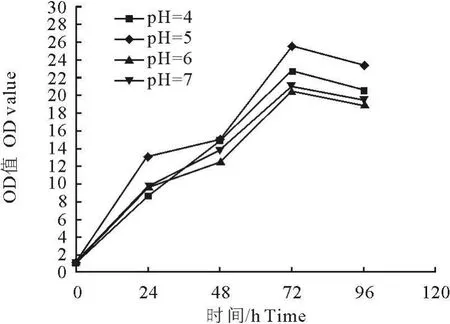
图1 不同pH对毕赤酵母X33生长的影响Fig.1 Effects of pH value on the grouth of Pichia pastoris X33
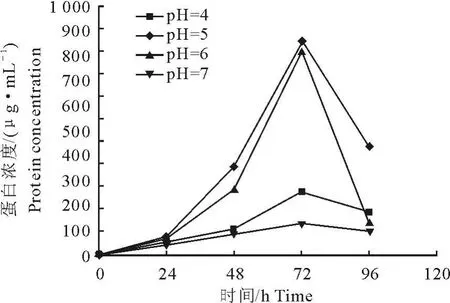
图2 同pH对蛋白表达量的影响Fig.2 Effects of pH value on the production of protein by Pichia pasto ris X33
2.2 不同甲醇浓度对蛋白诱导表达表达量的影响
甲醇营养型酵母具有醇氧化酶基因AOX1,在强启动子p AOX1和甲醇诱导条件下可实现外源蛋白的高效表达[10]。在诱导表达阶段,甲醇作为诱导物的同时又是碳源和能源。由于本菌种 X33为Mut+型,对甲醇的消耗能力较强。因此,甲醇浓度对外源蛋白的高效表达有很大的影响[11]。通过对诱导表达阶段不同甲醇浓度的优化试验我们发现在已经优化的诱导表达时间72 h时,蛋白表达量随甲醇添加量的增加而增加,呈正相关性,2.0%的甲醇浓度最适合于蛋白的表达,表达量达到963.46 μg/mL;甲醇浓度为3.0%时,蛋白表达量比2.0%时下降了18.1%,可能是过高的甲醇浓度对酵母有毒性,抑制了蛋白的表达(图3)。
2.3 融合蛋白的抑菌活性验证
融合蛋白各个表达条件优化的结果可由平板扩散试验检测抑菌活性来进行进一步验证。通过pH和表达时间条件优化中所表达的粗蛋白液对金黄色葡萄球菌(ATCC25923)的抑菌圈直径大小比较,发现在各个pH条件下,诱导表达72 h时提取的粗蛋白液的抑菌活性最强,并且在 pH为5,抑菌圈最大,直径达到12.3 mm(图4)。在甲醇浓度优化试验中,抑菌圈的大小随甲醇浓度的增加而增加,在2%时出现的抑菌圈最大,直径达到14.2 mm,结果如图5所示。同时,平板扩散试验还显示抑菌圈的大小与蛋白表达量呈明显的正相关性。
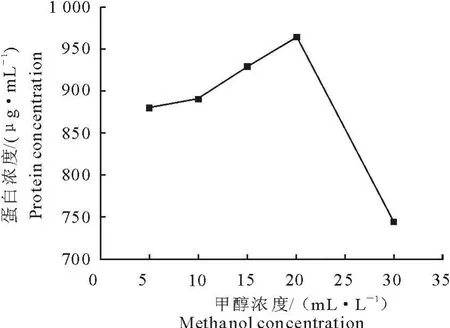
图3 不同甲醇浓度对蛋白表达量的影响Fig.3 Effects of methanol concentration on the production of protein by Pichia pastoris X33
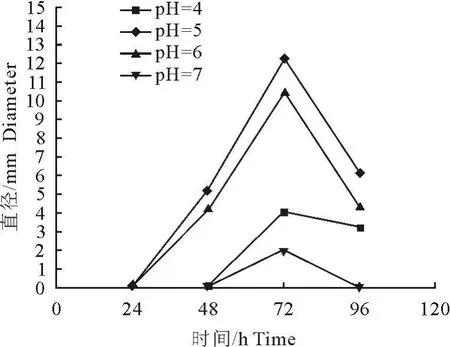
图4 诱导时间和pH优化时所取融合蛋白的抑菌环直径Fig.4 Diameter of inhibition zone by the fusion protein extracted in the optimization experiment of pH value and induction time
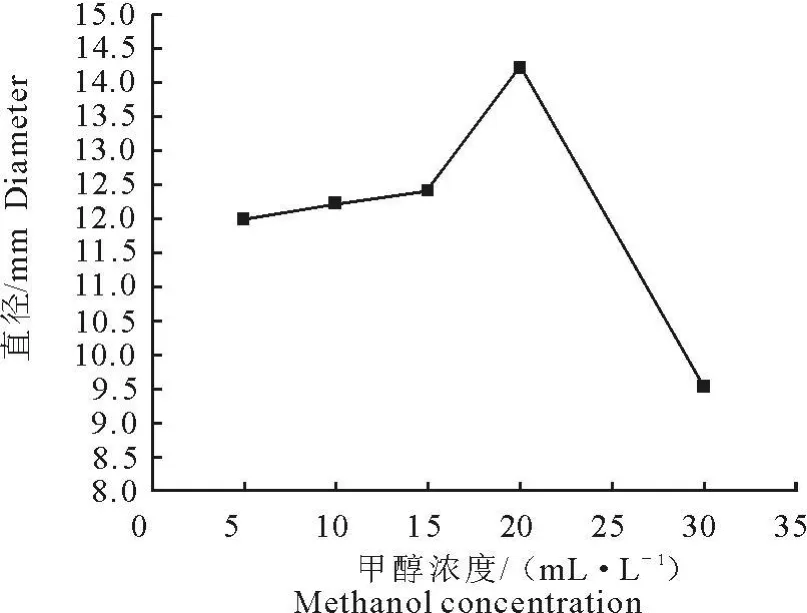
图5 甲醇浓度优化时所取融合蛋白的抑菌环直径Fig.5 Diameter of inhibition zone by the fusion protein extracted in the optimization experiment of methanol concentration
3 讨论
巴斯德毕赤酵母表达系统是目前分子生物学领域中用于表达重组蛋白的标准工具之一,具有与真核生物极其相似的分泌途径和很强的真核蛋白质修饰功能,并且其自身分泌的蛋白质很少且易于高密度发酵,因此在表达和分离纯化异源蛋白质等方面具有很强的优势[12]。影响外源蛋白在毕赤酵母中成功表达的因素有很多,除了基因偏适性等内源性因素以外,培养基成分、温度、pH、甲醇诱导浓度、诱导表达时间和溶解氧等外源因素对外源蛋白的高效表达都有重要的影响。本研究对基因工程菌 Pichia pastoris X33-HLYZ-TachyplesinⅠ产人溶菌酶-鲎素融合蛋白诱导表达的时间、pH和甲醇浓度等三个表达条件进行了研究。
毕赤酵母能在pH 3~7范围内正常生长[13],诱导阶段的pH对外源蛋白的表达有很大的影响[10,14-16]。然而,在发酵过程中,低pH能够抑制蛋白酶的切割活性,有利于外源蛋白的高效表达[13,17-18]。不同pH的BMMY甲醇培养基的表达表明,酵母细胞能在各pH条件下正常生长,在pH是5时生长速度最快,融合蛋白在低的pH中(pH 5.0、pH 6.0)表达量均好,而在 pH 4.0、pH 7.0中表达量低。可能是由于低pH会通过改变细胞膜表面电荷分布来改变影响细胞膜的通透性,干扰细胞的代谢水平,从而抑制外源蛋白的表达[19]。另外融合蛋白的理论等电点为9.36,在中性和弱碱性环境下不利于其表达。
在诱导表达阶段,甲醇既是碳源又是诱导物,所以在诱导表达阶段必须添加甲醇到一定的浓度才能保证酵母细胞的生长和外源蛋白的表达[20]。Carolina等[21]发现过高或者过低的甲醇添加量都会抑制外源蛋白的表达,属于一种典型的对甲醇的底物抑制反映。甲醇利用的快慢与重组菌的表型有关,本研究构建的工程菌株是甲醇利用正常型(Mut+),甲醇添加量的条件优化试验表明,蛋白表达量随着甲醇添加量的增加而增加,甲醇终浓度为2%时获得最高表达量,浓度为3%时表达量有所下降,可能是因为甲醇浓度过高会对酵母细胞产生毒性,从而抑制了外源蛋白的表达,而Mu等[16]在用毕赤酵母表达人成纤维细胞生长因子时发现其最适甲醇终浓度为0.5%,这表明表达不同的外源蛋白需要不同的甲醇添加浓度。
[1]王秀青,朱明星,张爱君,等.基因工程抗菌肽表达条件的优化及生物活性试验[J].动物医学进展,2009,11):62-67.
[2]Nash J A,Ballard T N,Weaver T E,et al.The peptidoglycandegrading property of lysozyme is not required for bactericidal activity in vivo[J].J Immunol,2006,177(1):519-526.
[3]Cole A M,Liao H I,Stuchlik O,et al.Cationic polypeptides are required for antibacterial activity of human airway fluid[J〛。J Immunol,2002,169(12):6985-6991.
[4]M orita S,Kuriyama M,Nakatsu M,et al.Secretion of active human lysozyme by Acremonium chrysogenum using a Fusarium alkaline protease promoter system[J].J Biotechnol,1995,42(1):1-8.
[5]Nakamura T,Furunaka H,Miyata T,et al.Tachy plesin,a class of antimicrobial peptide from the hemocytes of the horseshoe crab(T achypleus tridentatus).Isolation and chemical structure[J].J Biol Chem,1988,263(32):16709-16713.
[6]M acauley-Patrick S,Fazenda M L,M cNeil B,et al.Heterologous protein production using the Pichia pastoris expression system[J].Yeast,2005,22(4):249-270.
[7]焦 颖,龚劲峰,何校澎,等.O型口蹄疫病毒VP1基因在毕赤酵母中的表达及免疫原性分析[J].动物医学进展,2010(2):73-77.
[8]王艳华,殷 宏,罗建勋,等.皮蝇素A基因的克隆及其毕赤酵母表达载体的构建[J].动物医学进展,2007(9)15-18.
[9]Lewinstein I,Matalon S,Slutzkey S,et al.Antibacterial properties of aged dental cements evaluated by direct-contact and agar diffusion tests[J].J Prosthet Dent,2005,93(4):364-371.
[10]Guo M J,Zhuang Y P,Chu J,et al.Production and purification of a novel thermostable phytase by Pichia pastoris FPHY34[J].Process Biochemistry,2007,42(12):1660-1665.
[11]Zhang T,Gong F,Peng Y,et al.Optimization for high-level expression of the Pichia guilliermondii recombinant inulinase in Pichia pastoris and characterization of the recombinant inulinase[J].P rocess Biochemistry,2009,44(12):1335-1339.
[12]Hong F,Meinander N Q,Jonsson L J.Fermentation strategies for improved heterologous expression of laccase in Pichia pastoris[J〛。Biotechnol Bioeng,2002,79(4):438-449.
[13]Cregg J M,Vedvick T S,Raschke W C.Recent advances in the expression of foreign genes in Pichia pastoris[J].Biotechnology(N Y),1993,11(8):905-910.
[14]He X P,Liu N,Li W W,et al.Inducible and constitutive expression of a novel thermostable alkaline beta-mannanase from alkaliphilic Bacillus sp N16-5 in Pichia pastoris and characterization of the recombinant enzy me[J].Enzyme and Microbial Technology,2008,43(1):13-18.
[15]Ayed A,Rabhi I,Dellagi K,et al.High level production and purification of human interferon alpha-2b in high cell density culture of Pichia pastoris[J].Enzyme and Microbial Technology,2008,42(2):173-180.
[16]M u X,Kong N,Chen W,et al.High-level expression,purification,and characterization of recombinant human basic fibroblast growth factor in Pichia pastoris[J].Protein Expr Purif,2008,59(2):282-288.
[17]Inan M,Chiruvolu V,Eskridge K M,et al.Optimization of temperature-gly cerol-pH conditions for a fed-batch fermentation process for recombinant hookworm(Ancy lostoma caninum)anticoagulant peptide(AcAP-5)production by Pichia pastoris[J].Enzyme and Microbial Technology,1999,24(7):438-445.
[18]Shi X Z,Karkut T,Chamankhah M,et al.Optimal conditions for the expression of a single-chain antibody(scFv)gene in Pichia pastoris[J].Protein Expression and Purification,2003,28(2):321-330.
[19]Werten M W T,T J Van den Bosch,Wind R D,et al.Highyield secretion of recombinant gelatins by Pichia pastoris[J].Yeast,1999,15(11):1087-1096.
[20]Li Z M,Ping X B,Ye Q,et al.Production and optimization of recombinant human augmenter of liver regeneration by Pichia pastoris[J].Enzyme and Microbial T echnology,2010,47(5):222-227.
[21]A rnau C,Ramon R,Casas C,et al.Optimization of the heterologous production of a Rhizopus oryzae lipase in Pichia pastoris system using mixed substrates on controlled fed-batch bioprocess[J].Enzyme and Microbial Technology,2010,46(6):494-500.
Optimization of Conditions to Stabilize and Maximize Pichia pastoris Fermentation of human lysozyme-TachyplesinⅠfusion protein
GAO Yu,ZHAO Hong-lei,FENG Xin,DIAO Yu-wen,LIU Shan-shan,LI Lin-xi,GU Jing-min,HAN Wen-yu,LEI Lian-cheng*
(College of Animal Science and Veterinary Medicine,J ilinUniversity;Changchun130062,China)
The engineering strain of Pichia pastoris,X33/pPICZα A-human lysozyme-T achyplesin Ⅰ ,which was constructed by our lab,can express secretory recombinant human lysozyme-TachyplesinⅠfusion protein.Becides their internal properties of foreign gene,the culture and inducing conditions also has a significant impact to the expression.In this paper,the expression conditions of recombinant H LYZ-TachyplesinⅠwere optimized of three factors such as initial medium pH,methanol concentration and the induction time.Growth curve,Bradford and the plate diffusion test had been used to analysis and we found that the optimum induction conditions for recombinant HLYZ-TachyplesinⅠexpression were:an initial pH of 5.0,a final methanol concentration of 2.0%,and 72 hours for induction Under these conditions,the Bradford analysis showed the high level expression and the agar diffusion tests showed that the fusion protein antimicrobial activity for Staphylococcus aureus(ATCC25923).Thus sets up an optimized expression system for hLYZ-TachyplesinⅠfusion protein,which will play an important role in its further large-scale fermentation and industrial production.
Pichia pastoris;human lysozyme-TachyplesinⅠfusion protein;Expression condition;Optimization
Q93;Q789
A
1007-5038(2011)08-0032-05
2011-05-17
吉林省科技平台计划项目(20070210)
高 宇(1986-),男,四川雅安人,硕士研究生,主要从事兽医微生物和免疫学研究。

